Больничная бактерия что это
Когда убивает не ковид, а суперинфекция. Петербургские врачи рассказали, почему больничные микробы опаснее коронавируса
Пандемия принесла новую опасность — суперинфекцию, которая у пациентов с COVID-19, особенно находящихся на ИВЛ, вызывает смертельные осложнения. Сколько на самом деле погибает пациентов с COVID-19 от «супермикробов» и почему с ними так трудно бороться, выяснял «Доктор Питер».
В Петербурге самые экзотичные возбудители
О том, что существует некая суперинфекция, от которой умирают пациенты с коронавирусом, заявил на конгрессе по профилактике инфекций главный врач московской больницы № 40 в Коммунарке Денис Проценко. По его словам, многие пациенты, поступившие с коронавирусом, умирают не от него, а от суперинфекции, полученной уже в стационаре. «Особенность пациентов с COVID-19 — быстрое формирование чрезвычайно опасных бактерий-суперинфектов в их организме,— сказал Проценко. — Причем это проблемные штаммы со множественной устойчивостью, что ограничивает возможности лечения. И мы выявляем их все чаще».
Суперинфекция — один из вариантов термина «вторичная инфекция», супер- здесь играет роль приставки «над», когда одна инфекция наслаивается на другую. Проблема эта давняя, специалистам хорошо знакомая. «Ничего супер-ужасного, супер-убивающего в этом нет», говорят эксперты «Доктора Питера».
Читайте также
Интересно, что, по словам врачей, в стационарах Петербурга обитает своеобразный спектр возбудителей, который отличается от того, что чаще всего встречается в стране. Самые распространенные микробы вызываются бактерией Klebsiella pneumoniae (клебсиелла), или Acinetobacter baumannii (акинетобактер), Pseudomonas aeruginosa, которую по-русски называют синегнойная палочка.
Их широкое использование уже привело к селекции больничных микробов. Эксперты прогнозируют, что к 2050 году смертность от антибиотикорезистентных инфекций в мире может обогнать смертность от онкозаболеваний.
Госпитальные микробы самые опасные
Самым грозным проявлением вторичной инфекции при коронавирусе считается псевдомембранозный колит (острое заболевание толстого кишечника).
Внутрибольничные инфекции: особенности, источники, возбудители
Ежегодно в США регистрируют около 1,7 млн случаев внутрибольничных инфекций, вызванных микроорганизмами, при этом 99 тыс. из них заканчиваются летально. В развитых странах Европы смертность от внутрибольничных инфекций составляет 25 тыс. случаев в год, из них две трети обусловлены грамотрицательными бактериями. В нашей стране внутрибольничные инфекции в два раза повышают риск летального исхода
Внутрибольничные инфекции
Изучение внутрибольничных инфекций (ВБИ) началось более 150 лет назад, но по-прежнему они остаются серьезной проблемой, приводя к удлинению сроков лечения, хронизации процесса, инвалидности, а в наиболее тяжелых случаях — к смерти больных. Согласно определению ВОЗ, внутрибольничными инфекциями считаются любые клинически выраженные заболевания микробного происхождения, поражающие больного в результате его госпитализации или посещения лечебного учреждения либо возникающие в течение 30 дней после выписки из больницы.
К внутрибольничным инфекциям также относятся инфицирование сотрудников больницы, связанное с их профессиональной деятельностью. Эти болезни отличаются механизмами и факторами передачи, особенностями течения эпидемиологического и инфекционного процессов, а также особой ролью медицинского персонала в возникновении, поддержании и распространении инфекции. Подобные инфекции могут быть обусловлены широким внедрением в практику инструментальных, эндоскопических, биохимических и других методов диагностики, которые сопряжены с нарушением целости покровов тела человека. Проблема в том, что конструкция некоторых медицинских приборов не позволяет произвести их полную стерилизацию после каждой процедуры, оставляя лазейку для проникновения нежелательных микробов во внутреннюю среду организма человека.
Агенты ВБИ
Всего насчитывается более 200 агентов, которые могут быть причиной внутрибольничных инфекций. До появления антибиотиков основными из них были стрептококки и анаэробные палочки. Однако после начала клинического применения антибиотиков возбудителями основных внутрибольничных инфекций стали ранее непатогенные или условно-патогенные микроорганизмы. К ним относятся стафилококки (Staphylococcus aureus, St. epidermidis, St. saprophiticus), стрептококки (Streptococcus spp.), энтерококки (Enterococcus faecalis, Enterococcus durans), эшерихия (Escherichia coli), клебсиелла (Klebsiella spp.), энтеробактер (Enterobacter spp.), протей (Proteus mirabilis), серрация (Serratia marcescens), псевдомонада (Pseudomonas aeruginosa). Нередко встречаются ВБИ, вызываемые Providencia spp., Stenotrophomona smaltophilia, Acinetobacter baumannii, Citrobacter spp., Clostridium difficile и другими микроорганизмами.
Всего насчитывается более 200 агентов, которые могут быть причиной внутрибольничных инфекций
Очень опасна комбинация «стафилококк+протей+синегнойная палочка», поскольку в результате развивается особо тяжелый деструктивно-некротический энтероколит с парезом кишечника и симптомами его динамической непроходимости, следствием которых нередко является летальный исход.
Роль облигатно-патогенных микроорганизмов в развитии внутрибольничных инфекций невелика. В неинфекционных стационарах регистрируют несколько нозологических форм инфекций, вызванных возбудителями этой группы. К ним относятся вирусы гепатитов В, С, D, ВИЧ, гриппа и других ОРВИ, острых кишечных вирусных инфекций, герпеса, цитомегаловирусной инфекции, а также анаэробные клостридии и хламидии.
ВОЗ предупреждает
Эксперты ВОЗ совместно с отделом инфекционных заболеваний при Тюбингенском университете (Германия) назвали 12 бактерий, которые представляют наибольшую опасность для здоровья человека.
В первую критическую группу вошли Acinetobacter baumannii, Pseudomona saeruginosa и Enterobacteriaceae, которые часто выявляют в больницах и домах престарелых, причем заражение ими может привести к развитию смертельных инфекций, например пневмонии и заболеваний крови. Эти бактерии устойчивы к большинству антибиотиков, в том числе карбапенемам и цефалоспоринам.
Основные пути приспособления больничных штаммов — это устойчивость к одному или нескольким антибиотикам широкого спектра действия и снижение чувствительности к антисептикам
Во вторую группу списка ВОЗ включены Enterococcus faecium, Staphylococcus aureus, Helicobacter pylori, Campylobacter spp., Salmonellae и Neisseria gonorrhoeae. К третьей категории отнесены Streptococcus pneumoniae, Haemophilus influenzae и Shigella spp.
Госпитальные штаммы
В результате циркуляции условно-патогенных микроорганизмов в больнице происходит их естественный отбор с образованием наиболее устойчивого госпитального штамма. Мутации или горизонтальный перенос генов с помощью плазмид позволяет больничным микроорганизмам приобрести новые свойства, не характерные для «диких» штаммов этого вида.
Основные пути приспособления больничных штаммов — это устойчивость к одному или нескольким антибиотикам широкого спектра действия и снижение чувствительности к антисептикам. Госпитальные штаммы очень разнообразны, в каждой больнице или отделении возможно появление своего характерного штамма со свойственным только ему набором биологических свойств. При этом популяции возбудителей внутрибольничных инфекций отличаются не только гетерогенностью, но и динамичностью во времени.
Из больниц антибиотикорезистентные штаммы, особенно это касается грамотрицательных бактерий, постепенно начинают распространяться во внебольничную среду.
Эковары
Эковары — это варианты одного вида микроорганизма, которые приспособились к обитанию в определенной экосистеме. В данном случае выделяют больничные и внебольничные эковары. Больничными эковарами люди заражаются в основном во время инъекций, операций, переливания крови, гемосорбции, гемодиализа, мануальных и эндоскопических исследований и др.
Госпитальные инфекции, обусловленные внебольничными эковарами, часто возникают при нарушении целости покровов тела на фоне общего снижения иммунитета. Возбудители инфекций проникают во внутреннюю среду организма при повреждении слизистых оболочек, через ожоги, травматические раны, открытые гнойно-воспалительные очаги.
Устойчивые к большинству антибиотиков штаммы золотистого стафилококка (methicillinresistant Staphylococcus aureus — MRSA) стали настоящим бичом больниц. Несмотря на все усилия, ликвидировать инфекцию не удается
Больничные эковары способны вызывать госпитальную инфекцию не только при снижении функции иммунной системы, но и при нормальном иммунном ответе после инъекций или операций. Причем инфицирующая доза больничного эковара может быть относительно небольшой. Для появления инфекции, вызванной внебольничным эковаром, кроме снижения иммунитета, необходимо еще два условия: пассивное проникновение возбудителя во внешнюю среду организма и массивная инфицирующая доза.
Генетическая стабильность больничных инфекций Pseudomonas aeruginosa
Прежде считалось, что в больничной среде бактерии изменяются ускоренными темпами, увеличивая таким образом генетическое разнообразие внутрибольничной микрофлоры. Для изучения этого вопроса датские ученые проследили генетические изменения бактерии Pseudomonas aeruginosa, которые произошли с 70-х годов прошлого века в пределах одной из больниц Копенгагена. Для этого они использовали бактериальные штаммы, выделенные в анализах больных муковисцидозом, поскольку Pseudomonas aeruginosa является источником инфекций дыхательных путей, осложняя течение этой болезни.
Хирург и специалист по инфекционным заболеваниям Марк Шпигельман из Университетского колледжа в Лондоне считает, что повышенные требования к гигиене в хирургических клиниках парадоксальным образом способствуют распространению внутрибольничных инфекций
Один вариант штамма в течение 35 лет дал около 200 000 поколений, переходя от одного пациента к другому. В связи с высокой неоднородностью условий и длительным временем можно было бы ожидать широкой генетической диверсификации исходного штамма, но оказалось, что внутрибольничные инфекционные возбудители после периода быстрых адаптаций изменяются относительно мало, скорость мутирования у них низкая и расщепления на отдельные линии не происходит.
Эти наблюдения на первый взгляд кажутся противоречивыми, так как долгая эволюция в нестабильных условиях могла бы способствовать повышению генетического разнообразия. Тем не менее выяснилось, что, несмотря на то что внутренняя среда больного весьма неустойчива и разнородна из-за инфекций и постоянного лечения всевозможными препаратами, эта разнородность не способствует быстрому увеличению генетического разнообразия.
Clostridium difficile
Спорообразующая бактерия Clostridium difficile относится к стойким и трудноискоренимым возбудителям больничных инфекций. Заражение происходит через руки медицинского персонала, например, при измерении ректальной температуры, причем не помогает даже использование индивидуальных чехлов для датчиков.
У получавших антибиотики больных (даже однократно перед операцией) под влиянием токсинов Clostridium difficile возможно развитие псевдомембранозного колита, основным проявлением которого является диарея. У некоторых больных профузная диарея сопровождается интоксикацией, высокой лихорадкой, лейкоцитозом. Если пациент продолжает получать антибиотики вплоть до выписки, то псевдомембранозный колит может начаться дома.
MRSA — повод для изменений правил больничной гигиены
Устойчивые к большинству антибиотиков штаммы золотистого стафилококка (methicillinresistant Staphylococcus aureus — MRSA) стали настоящим бичом больниц. Несмотря на все усилия, ликвидировать инфекцию не удается. Вне больниц бактерия, как правило, теряет активность. Однако в последнее время все чаще отмечают случаи, когда инфекция выходит за пределы медицинских учреждений.
Хирург и специалист по инфекционным заболеваниям Марк Шпигельман из Университетского колледжа в Лондоне считает, что повышенные требования к гигиене в хирургических клиниках парадоксальным образом способствуют распространению внутрибольничных инфекций. При этом он указывает на два принципиальных факта, которые должны объяснить неэффективность борьбы с инфекцией в больницах. Во-первых, избыточные меры гигиены, применяемые в больницах, особенно в хирургических отделениях, уничтожают безвредные бактерии, создавая тем самым среду для заселения бактериями MRSA. Во-вторых, применение антибиотиков с гигиенической целью, в частности использование антибактериального мыла, не только приводит к появлению устойчивых к антибиотикам штаммов, но и активизирует защитные механизмы у бактерий, которые в менее агрессивной среде не действуют.
Как специалист по истории и развитию инфекционных заболеваний в древних человеческих популяциях Марк Шпигельман предлагает предпринять ряд мер по борьбе с инфекцией. Прежде всего надо строго разделить больницы, где используют антибиотики, от тех, где их не применяют (прежде всего это касается хирургических отделений). Разделение должно быть очень жестким. Персонал не должен совмещать работу в больницах разного типа.
В случае необходимости использовать антибиотики в клинике, где они запрещены, больного следует перевести в другое медицинское учреждение. Кроме того, выдвинуто неожиданное предложение по изменению гигиенических процедур. Предлагается вместо антибиотиков при подготовке к операции использовать пробиотики, которые помогут противостоять болезнетворным бактериям.
Татьяна Кривомаз, д-р техн. наук, канд. биол. наук, профессор
Внутрибольничные инфекции (инфекции, связанные с медицинским вмешательством)
Автор: врач – клинический фармаколог Трубачева Е.С.
Автор: врач – клинический фармаколог Трубачева Е.С.
Заканчивается 2019 год, который для автора стал знаменательным по очень многим причинам, одна из которых в том, что благодаря интересу компании «Видаль» удалось начать воплощать давнюю идею написания «Азбуки антибиотиков», основной целью которой было не только знакомство коллег с азами антибактериальной терапии, но и с такой важнейшей темой – как для нас, врачей, так и для наших пациентов – внутрибольничным инфицированием, точнее, методами его профилактики. Теперь мы, имея некоторый задел знаний, поговорим о внутрибольничных инфекциях (ВБИ) более подробно.
Еще не так давно, каких-то лет 20 назад, считалось, что стоит пациенту попасть в стационар, как он тут же обсеменяется всей живущей внутри микрофлорой. В принципе, так и было в стационарах, ведущих плановый прием, так как стоило переступить порог отделения, как в пациента тут же начинали колоться антибиотики из арсенала «что дали в аптеке» в качестве предоперационной подготовки. Естественно, первыми жертвами такого подхода становились микробы, которые не обладали никакой антибактериальной устойчивостью и просто мирно жили на человеке, ничем ему не мешая, а на их место закономерно приходило внутрибольничное зверье, пользуясь полученным за счет нерадивых нас селективным преимуществом. Как раз в первую неделю госпитализации весь процесс и укладывался. Потом пациент ложился на операционный стол и не менее закономерно развивалась минимум внутрибольничная раневая инфекция. Врачи убеждались в правоте своего подхода, следующие пациенты получали уже не один, а несколько антибиотиков на входе, их атаковало еще более злющее зверье, которое в результате настолько порочного подхода отращивало все новые и новые навыки антибиотикорезистентности, и в итоге порочный круг замкнулся. Но необходимо добавить, что внутри этого круга было еще и достаточное количество нас – врачей, сестер, санитарок, так или иначе соприкасающихся с пациентом, скорее, часто, чем редко, без перчаток, а если и в них, то с немытыми нормально руками, с масками только на полости рта, не закрывая нос и награждая несчастного все новыми и новыми штаммами уже собственной микрофлоры. И если первый путь заражения пациентов, связанный с превентивным использованием антибиотиков, так или иначе удалось преодолеть (но до сих пор автор регулярно натыкается на попытки оправдания той, 20-летней давности, о том, что пациент самопроизвольно внутрибольничной флорой обрастает), то изжить «грязные» руки пока не удалось нигде, и я до сих пор ощущаю себя Земмельвейсом, или Дон Кихотом, борющимся с ветряными мельницами.
Давайте посмотрим на проблему более конкретно, тем более, что от нее напрямую зависит жизнь самых тяжелых и сложных пациентов. Предупредим сразу, теоретическую часть вопроса вы можете прочитать в огромном количестве публикаций научного и научно-популярного характера. Мы поговорим как врачи-практики, что и откуда берется, и как от этого избавиться.
Итак, первое и основное, что уже неоднократно сказано, но что необходимо запомнить, – МИКРОБЫ, ВЫЗЫВАЮЩИЕ ВБИ, НЕ УМЕЮТ НИ ЛЕТАТЬ, НИ ХОДИТЬ, НИ ПОЛЗАТЬ, и оказываются в организме пациента только с нашей медицинской помощью, потому эти состоянии и названы – инфекции, связанные с медицинским вмешательством. А под вмешательством может рассматриваться вообще любое действие с пациентом – перевязка, установка зонда или дренажа, отсасывание мокроты, эндоскопические манипуляции и т.д. и т.п.
Кто более других подвержен рискам ВБИ?
Какие ЛПУ и отделения наиболее рискованны по ВБИ?
Что делать?
Отвечая на этот вопрос, автор мог бы написать пособие толщиной в «Войну и мир», но постарается уместиться в отведенный ему формат.
1. Мыть руки. Нет, даже вот так – МЫТЬ РУКИ – и делать это правильно. Методику мытья вы все прекрасно знаете. Если не знаете – берите СанПин и внимательно его изучайте по всем пунктам:
12.4. Гигиеническая обработка рук
12.4.1. Гигиеническую обработку рук следует проводить в следующих случаях:
12.4.2. Гигиеническая обработка рук проводится двумя способами:
12.4.3. Для мытья рук применяют жидкое мыло с помощью дозатора (диспенсера). Вытирают руки индивидуальным полотенцем (салфеткой), предпочтительно одноразовым.
12.4.4. Гигиеническую обработку рук спиртосодержащим или другим разрешенным к применению антисептиком (без их предварительного мытья) проводят путем втирания его в кожу кистей рук в количестве, рекомендуемом инструкцией по применению, обращая особое внимание на обработку кончиков пальцев, кожи вокруг ногтей, между пальцами. Непременным условием эффективного обеззараживания рук является поддержание их во влажном состоянии в течение рекомендуемого времени обработки.
12.4.5. При использовании дозатора новую порцию антисептика (или мыла) наливают в дозатор после его дезинфекции, промывания водой и высушивания. Предпочтение следует отдавать локтевым дозаторам и дозаторам на фотоэлементах.
12.4.6. Кожные антисептики для обработки рук должны быть легко доступны на всех этапах лечебно-диагностического процесса. В подразделениях с высокой интенсивностью ухода за пациентами и с высокой нагрузкой на персонал (отделения реанимации и интенсивной терапии и т.п.) дозаторы с кожными антисептиками для обработки рук должны размещаться в удобных для применения персоналом местах (у входа в палату, у постели больного и др.). Следует также предусматривать возможность обеспечения медицинских работников индивидуальными емкостями (флаконами) небольших объемов (до 200 мл) с кожным антисептиком.
12.4.7. Использование перчаток.
12.4.7.1. Перчатки необходимо надевать во всех случаях, когда возможен контакт с кровью или другими биологическими субстратами, потенциально или явно контаминированными микроорганизмами, слизистыми оболочками, поврежденной кожей.
12.4.7.2. Не допускается использование одной и той же пары перчаток при контакте (для ухода) с двумя и более пациентами, при переходе от одного пациента к другому или от контаминированного микроорганизмами участка тела к чистому. После снятия перчаток проводят гигиеническую обработку рук.
12.4.7.3. При загрязнении перчаток выделениями, кровью и т.п. во избежание загрязнения рук в процессе их снятия следует тампоном (салфеткой), смоченным раствором дезинфицирующего средства (или антисептика), убрать видимые загрязнения. Снять перчатки, погрузить их в раствор средства, затем утилизировать. Руки обработать антисептиком.
Перевожу с бюрократического на русский — перед каждым контактом с пациентом, а также при контакте с разными частями тела пациента (там разные микробы живут), моем руки и меняем перчатки. Нет, я не знаю, как нагнуть администрацию, чтобы перчатки были в товарных количествах, но если держать в голове второй «закон Яровой», может, и получится найти слова, чтобы заваливать служебками эпидемиолога (тогда он виноват будет, как и получилось в случае с Хабаровском).
Руки под перчатки надо мыть! Ибо они имеют свойство рваться, причем в самый неподходящий момент. Потом будете следователю долго объяснять, как вы торопились и вообще никогда такого не было, а тут… Лучше все-таки до автоматизма отработать навык, чем потом расхлебывать его отсутствие.
2. Правильно вести документацию. Автор в курсе, как не любят, а где-то даже ненавидят бумажную работу хирурги. Что «лучше семь операций, чем одна история», но судить и сажать будут за историю, а не за операцию. И отбивать вас легче, когда документы в порядке. И одной из обязательных записей должна стать «перед началом манипуляции, перевязки, исследования (нужное подчеркнуть) руки обработаны так-то, надеты перчатки размера такого-то». Да, автор в курсе, что похож на Земмельвейса, но тот-то в итоге оказался прав, а опыт автора показывает, что при таком подходе и дотошности и от ВБИ вполне реально избавиться, и докторов от всяких «экспертов» отбивать.
3. Регулярно терзать эпидемиологическую службу на предмет результатов мониторингов или служебок по расходникам и т. п. Не все же им вас терзать. Приставать лучше всего письменно, чтобы следы этих приставаний оставались, они могут очень сильно пригодиться в будущем.
4. Ну и учиться, учиться и еще раз учиться. Или менять специальность, так как к огромному сожалению все, что связано с медициной, особенно критических состояний, стало слишком опасным.
Но несмотря на такой невеселый разговор, автор и редакция Видаль от всей души хотела бы поздравить Вас с наступающим 2020 годом и выражает надежду, что наш цикл стал полезной частичкой уходящего 2019 года.
Внутрибольничные инфекции
Общие сведения
Понятие о внутрибольничной инфекции
Под внутрибольничной инфекцией (ВБИ) подразумевается инфекция, которая возникает у пациента/медицинского работника при нахождении в условии стационара вне зависимости от появления симптомов заболевания во время его пребывания в стационаре или после выписки. Ее синонимами являются нозокомиальные инфекции или внутригоспитальные, госпитальные и ятрогенные инфекции. Также, нозокомиальные инфекции в современной научной литературе, нормативных документах и публикациях ВОЗ описываются термином «инфекции, связанные с оказанием медицинской помощи» (ИСМП), который, по мнению большинства, является более точным, поскольку подразумевает не только случаи инфекции, присоединившиеся к основному заболеванию у госпитализированных пациентов, но и инфекции, обусловленные оказанием всех видов медицинской помощи в мед. учреждениях различного профиля — амбулаториях, поликлиниках, на дому (при оказании скорой медицинской помощи), санаторно-оздоровительных учреждениях, также включает случаи инфицирования работников медицинских учреждений, связанные с их профессиональной деятельностью.
Частота регистрации ИСМП в разных странах варьирует в широких пределах. Так, в РФ этот показатель составляет 1-1,5% (40-60 тыс. случаев/год), США — 3-5 % (2,5 млн. случаев/год), Великобритании — 5-6 %, Германии —3,5 %, Китае — 7-8 %. Однако, эти показатели, особенно в странах СНГ и, в частности, России не отражают реальную эпидемиологическую ситуацию. Результаты научных исследований ведущих специалистов-эпидемиологов РФ свидетельствуют, что реальное количество ИСМП составляет в среднем около 10% и находится на уровне 2-2,5 миллионов случаев/год. Присоединение ИСМП к основному заболеванию увеличивает продолжительности лечения (пребывания в стационаре) пациента на 7-10 дней, а прямые затраты лечебных учреждений на 65-85 млрд рублей в год. Летальность при различных нозологических формах ИСМП варьирует в пределах 3,5-35%.
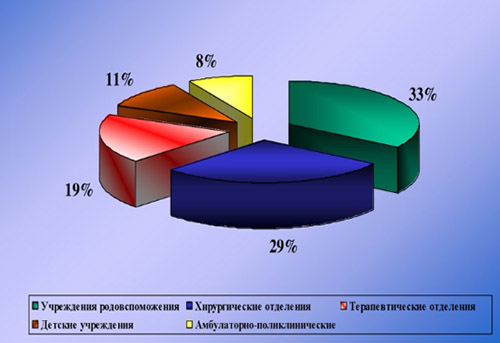
Наибольший удельный вес ИСМП приходится на хирургические и акушерские стационары (отделения травматологии, урологии, реанимации, абдоминальной хирургии, гинекологии, ожоговой травмы, стоматологии, отоларингологии, онкологии). Наиболее драматичны проявления ИСМП в отделениях интенсивной терапии и реанимации, где они в различных нозологических формах регистрируются в 25-30% случаев.
Патогенез
Патогенез внутрибольничных инфекций существенно различается и определяется видом заболевания, этиологическим фактором (видом возбудителя, факторами его вирулентности), механизмом и путями передачи инфекции.
Классификация
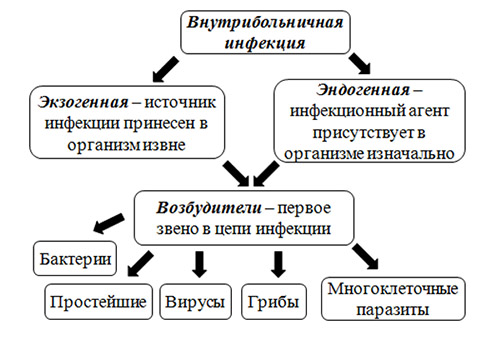
Прежде всего, различают две больших группы ИСМП (рис. ниже):
Группы и этиологический фактор ИСМП
В основу классификации ВБИ положены различные факторы. В зависимости от путей/факторов передачи различают воздушно-капельные, контактно-бытовые, контактно-инструментальные, постоперационные, постинфекционные, постэндоскопические, послеродовые, посттрансфузионные, постдиализные, посттравматические, постгемосорбционные и другие инфекции.
В зависимости от степени распространения инфекции различают:
Причины
К возбудителям ВБИ, имеющими наибольшее значение относятся:
Значимость различных видов ИСМП во многом определяется профилем ЛУ. Так, в гинекологических и родильных отделениях ведущую роль играет стафилококковая инфекция (золотистый стафилококк), кишечная палочка, энтерококки, диплоидный грибок (молочница); в ожоговых стационарах — синегнойная инфекция; в урологических отделениях — грамотрицательная микрофлора: кишечная, синегнойная палочка; в детских отделениях — вирусы краснухи, кори, эпидемического паротита, ветряной оспы.
Чрезвычайно большое значение в распространении ВБИ имеют так называемые «госпитальные штаммы», для которых характерны высокая вирулентность, повышенная устойчивость к антибиотикам, ультрафиолетовому облучению, дезинфицирующим растворам, неприхотливость и способность размножаться в различных условиях окружающей среды. Основная причина мутации и селекции микрофлоры с приобретенной устойчивостью — неадекватное использование в лечебном процессе антимикробных средств и создание в ЛПУ благоприятных условий для размножения и роста микроорганизмов.
Формирование госпитального штамма (с приобретенной устойчивостью) обеспечивается за счет их преимущества (доминирования) перед другими представителями микробной популяции. Основными отличиями госпитального штамма микроорганизма от стандартного являются: повышенная вирулентность (патогенность), формирующаяся за счет многократного пассажа через организм больных ЛПУ, высокая устойчивость к воздействию неблагоприятных факторов (дезинфектантам, антисептикам, химиопрепаратам, применяемым в конкретном мед. учреждении) и способность к длительному выживанию, постоянная циркуляция в среде больничного стационара среди больных и персонала.
Основную массу всех форм ВБИ (около 80%) составляют:
Эпидемиология
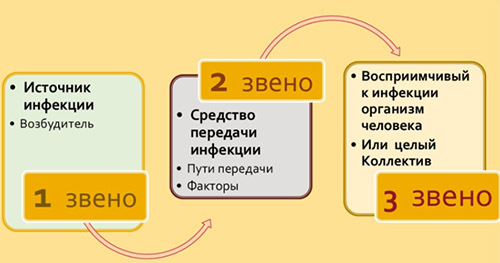
Любая нозологическая форма ВБИ развивается только при наличии всех звеньев эпидемического процесса: источника инфекции, механизма (факторов) передачи и восприимчивого организма человека.
Основные источники внутрибольничной инфекции:
Ведущие механизмы передачи инфекционного возбудителя
Аэрогенный — процесс заражения осуществляется через воздушную среду. Выделяют:
Факторы передачи инфекционного агента
Заболеваемость ИСМП носит преимущественно эндемический характер и обусловлена индивидуальными факторами риска и клиническими процедурами. Значительно реже ИСМП протекают в виде локальных эпидемий. Развитию эпидемических вспышек способствует несвоевременная диагностика стертых форм заболевания и выявление носителей инфекционных агентов, как среди поступающих пациентов, так и среди медицинского персонала, контаминация предметов общего пользования, систематическое нарушение методов асептики при выполнении инструментальных процедур.
Факторы риска развития ИСМП
Специфичны для каждого вида инфекционного возбудителя. Однако, в целом для большинства нозологических форм ИСМП определяющими факторами являются параметры, характеризующие организм хозяина:
Факторы риска ИСМП, связанные с предметами окружающей среды (загрязнение поверхностей, воздуха, воды в распространении инфекции) имеют меньшую значимость.
Что способствует распространению внутрибольничных (нозокомиальных) инфекций?
Возникновению и распространению ИСМП способствуют:
Симптомы
Симптоматика внутрибольничных инфекций определяется конкретной нозологической формой и симптомами основного заболевания, формой и тяжестью их течения, вирулентностью инфекционного агента и состоянием организма больного.
Анализы и диагностика
К ВБИ относятся случаи, отвечающие следующим критериям:
Для точной диагностики заболевания и определения конкретного штамма возбудителя инфекции, требуется проведение лабораторных—бактериологических/серологических исследований различных биоматериалов (мазок из зева, мокрота, кровь, моча, кал, раневое отделяемое).
Лечение
Проблема лечения госпитальных инфекций представляет значительную трудность, что обусловлено неэффективностью большинства широко применяемых антибиотиков, в частности цефалоспоринов. Для лечения таких инфекций применяются карбапенемы (Меропенем, Дорипенем), имеющие широкий спектр антимикробной активности, в частности к микроорганизмам, устойчивым к пенициллинам/цефалоспоринам или в ряде случаев комбинированные лекарственные препараты пенициллинов с ингибиторами бета-лактамаз (Пиперациллин + Тазобактам, Тикарциллин, Амоксициллин-Клавуланат и др.).
Карбапенемы используются для лечения тяжелых нозокомиальных пневмоний и других инфекций верхних дыхательных путей; инфекций органов малого таза, гинекологических, абдоминальных, мочеполовых инфекций; кожи и мягких тканей; сепсиса. Однако, препараты этой группы могут вызывать побочные реакции в виде крапивницы, сыпи, диспепсических расстройств, поражения печени и почек, дисбактериоза.
При выявлении метициллинрезистентных штаммов золотистого стафилококка, являющегося частым возбудителем внутрибольничных резистентных стафилококковых инфекций для лечения, используются гликопептидные антибиотики (Ванкадицин, Тейкопланин-Тева, Ликованум, Таргоцид и др.), которые высокоактивны по отношению к грамположительным аэробным/анаэробным инфекционным агентам — стафилококкам, стрептококкам, пневмококкам, энтерококкам, клостридиям, листериям, коринебактериям и другим. Показаниями к назначению являются тяжелые инфекции, вызванные энтерококками, инфекционный эндокардит, ассоциированный с зеленящими стрептококками, менингит и пневмонии, вызванные пневмококком, катетер-ассоциированный сепсис, перитонит, антибиотик-ассоциированная диарея и других инфекций, угрожающих жизни. В ряде случае гликопептидные антибиотики сочетаются с цефалоспоринами 3 поколения (Цефтибутен, Цефиксим, Цефотаксим, Цефоперазон, Цефтазидим и др.) или фторхинолонами (Офлоксацин, Ципрофлоксацин, Пефлоксацин, Норфлоксацин, Левофлоксацин и другие).
Необходимо отметить, что спектр возбудителей внутригоспитальных осложнений, а также их антибиотикорезистентность существенно различаются в отделениях различного профиля, поэтому при выборе антибиотика следует ориентироваться на чувствительность выделенной микрофлоры к ним, в также учитывать эпидемиологическую ситуацию в каждом конкретном лечебном учреждении.
Кроме антибиотикотерапии назначается специфическое лечение при той или иной конкретной нозологической форме ВБИ с учетом клинических проявлений, тяжести течения, риска развития осложнений. В индивидуальном порядке проводится симптоматическое лечение. В качестве дополнительной терапии назначают иммуностимуляторы: интерферон; бактериофаги, витаминно- минеральные комплексы.
В настоящее время для борьбы с тяжелыми проявлениями ВБИ разработана стратегия деэскалационной терапии, базирующаяся на нескольких принципах:
Эта стратегия предполагает безотлагательное назначение стартового антибиотика широкого спектра действия (комбинации антибиотиков) с целью максимально полного охвата спектра вероятных возбудителей с последующим переходом на антибиотик, к которому отсутствует устойчивость согласно данным микробиологического исследования. Именно своевременная и адекватная антимикробная терапия является ключевым условием и благоприятным прогностическим фактором, увеличивающей вероятность благоприятного исхода заболевания.