Брадикинезия при паркинсоне что это
Брадикинезия при паркинсоне что это
Брадикинезия (симптом Крюше—Верже), как и олигокинезия, — одно из проявлений гипокинетического синдрома. Для адекватной оценки всех проявлений гипокинезии необходимо обращать внимание на особенности естественного двигательного поведения, отмечая уровень двигательной активности, естественность и пластичность движений, эмоциональную живость и выразительность моторики в процессе общения.
Эти клинические наблюдения, весьма ценные сами по себе, целесообразно дополнять некоторыми несложными, но информативными тестами. Мы использовали тест попеременной плантарной и дорсальной флексии стопы, позволяющий выявить даже легкую гипокинезию, оценить ее степень и симметричность; тест максимально быстрого сгибания и разгибания кисти; тест «писания ногой в воздухе», тест Фурнье (больному предлагают максимально быстро совершить серию движений — встать, сесть, наклониться, повернуться и т. д.).
Можно рекомендовать также пробу с наполненной чашей, застегивание и расстегивание мелких пуговиц (каждой рукой отдельно), одевание и раздевание, шнуровку и расшнуровку обуви, причесывание и некоторые другие приемы (повороты туловища в положении лежа вокруг оси и пр.), имеющие второстепенное значение. Учитывая трудности количественной оценки гипокинезии, целесообразно использовать систему тестов различной степени сложности, обращая внимание на скорость и качество их исполнения.
По данным некоторых перечисленных выше тестов, гипокинезия может носить односторонний характер (при гемипаркинсонизме); она может выявляться и в качестве первого симптома на противоположной (клинически якобы не пораженной) стороне тела. По нашим наблюдениям, на первых этапах заболевания чаще определяется односторонняя либо асимметрично латерализованная гипокинезия; у больных, длительно страдающих паркинсонизмом, чаще выявлялась двусторонняя и несколько более сильно выраженная гипокинезия.
Результаты разных тестов обычно коррелируют между собой, однако степень выраженности гипокинезии в верхних и нижних конечностях иногда Может быть различной. Выполнение сложных движений нарушено у всех больных с гипокинезией.
Больные с выраженной акинезией в далеко зашедших стадиях паркинсонизма становятся совершенно беспомощными и нуждаются в постоянной посторонней поддержке даже при выполнении таких элементарных действий, как простая смена положения тела в постели, одевание, умывание, отправление физиологических потребностей и т. д.
Тремор различной интенсивности можно обнаружить у подавляющего большинства больных паркинсонизмом. В дебюте заболевания тремор обычно носит преходящий характер, появляясь в ситуации эмоционального напряжения. Лишь в редких случаях дрожание сразу приобретает выраженную стабильность. Мы наблюдали больного, у которого дрожание возникло остро в момент психотравмы в виде выраженного, высокоамплитудного и с тех пор практически неугасимого тремора в дистальных отделах рук.
У больных с дрожательными формами паркинсонизма тремор покоя, хотя и колеблется в своей интенсивности, наблюдается практически постоянно. Сначала дрожание появляется в дистальных отделах одной или (реже) обеих конечностей. По мере прогрессирования заболевания тремор может распространяться по гемитипу или приобретать генерализованный характер, однако максимально выраженным он остается в дистальных отделах рук (кисти и предплечья). При выраженных дрожательных формах в тремор могут вовлекаться и проксимальные группы мышц.
Брадикинезия
Как проявляется брадикинезия
Брадикинезия проявляется замедленностью движений и действий, в зависимости от участка поражения экстрапирамидной системы мозга различают следующие нарушения:
Развитие брадикинезии идет медленно, диагностирование болезненного состояния чаще всего происходит через несколько лет после его развития. Больной не может быстро говорить, развивается ригидность мышц, повышается тонус мышц. Мимика становится невыразительной, больной все делает очень медленно. Появляется неустойчивость тела, нарушается координация движения, при поднятии рук вверх отмечается тремор.
Причины брадикинезии
Брадикинезия может быть неврологической и психогенной. На развитие психогенной брадикинезии влияют психические заболевания, неврологический тип заболевания развивается при поражении экстрапирамидной системы. Неврологическая брадикинезия сопутствует следующим заболеваниям:
Нормальная работа экстрапирамидной системы доводит до автоматизма различные навыки, приобретенные нами за жизнь, произвольные движения, умение. Экстрапирамидная система представляет собой совокупность различных структур головного мозга, играющих важную роль в регулировании произвольных движений во время ходьбы, разговора, выполнения каких-либо действий. Нарушение согласованного функционирования структур экстрапирамидной системы приводит к появлению брадикинезии и других расстройств. При болезни Паркинсона снижается количество дофамина, нейромедиатора, влияющего на регуляцию структур экстрапирамидной системы. Усиливается действие базальных ганглиев, в результате проявляются первые симптомы заболевания.
Лечение брадикинезии
Лечение брадикинезии начинают с лечения заболевания, истинной причины, вызвавшей нарушение. Диагностика начинается с осмотра пациента, затем врач назначает ряд исследований:
Наиболее часто брадикинезию диагностируют при болезни Паркинсона. Симптомы болезни – это дрожь, отмечаемая во всем теле; обильное слюнотечение, которое не контролируется больным; частые запоры и недержание мочи; больной не может контролировать непроизвольные движения конечностей; частично утрачена память. Брадикинезия чаще всего отмечается на начальном этапе развития заболевания, проявляясь нарушением походки, нарушением работы лицевых мышц, изменением речи, сильным слюнотечением. Разработаны эффективные методики лечения болезни Паркинсона, которые применяют в неврологическом отделении Юсуповской больницы. Эффективное лечение основного заболевания помогает избавиться от брадикинезии.
Если брадикинезия развилась из-за злокачественной или доброкачественной опухоли мозга, лечение представляет собой комплексный подход: хирургическое вмешательство, химиотерапия, радиотерапия. Брадикинезия, вызванная черепно-мозговой травмой, лечится путем снижения риска развития отека мозга, поддержки основных показателей жизненно важных функций организма больного. Лечением заболеваний, вызвавших брадикинезию, занимаются врачи клиники неврологии Юсуповской больницы, где можно пройти диагностику неврологических заболеваний на инновационном оборудовании известных мировых производителей. Врачи высшей категории оказывают эффективную помощь пациентам с неврологическими патологиями. Записаться на консультацию к врачу можно по телефону.
Брадикинезия при паркинсоне что это
Во всем мире от болезни Паркинсона (БП) страдает более 1% населения старше 65 лет. Основная причина болезни Паркинсона — гибель нигростриарных нейронов с последующим снижением количества дофамина в полосатом теле. [ 18 F]флюородопа — вещество с умеренной радиоактивностью, которое после внутривенного введения способно к связыванию с дофаминовыми рецепторами полосатого тела. У пациентов с симптомами БП при ПЭТ определяют выраженное снижение связывания [ 18 F]флюородопы с дофаминовыми рецепторами (и, соответственно, снижение числа самих рецепторов).
[Иофлупан-I-123 — это радиофармпрепарат, представляющий собой аналог кокаина, который поглощают нейроны полосатого тела. Его захват можно оценить при помощи однофотонной эмиссионной компьютерной томографии (БРЕСТ) головного мозга; подобный метод исследования помогает обследовать пациентов с подозрением на болезнь Паркинсона]. В результате у пациентов повышается активность полосатого тела, а прямой двигательный путь начинает преобладать над непрямым.
Разрушение нигростриарного пути, вероятно, имеет форму «дистальной нейропатии», поскольку в полосатом теле дофамин начинает разрушаться раньше, чем в среднем мозге. Шипиковые нейроны полосатого тела также погибают, уменьшается длина дендритов, снижается число шипиков. Возможно, что дофаминергическая активность необходима шипиковым нейронам для защиты от потенциально токсичного влияния глутамата.
Для появления первых признаков заболевания необходима гибель около 60% нейронов верной субстанции. Задержка в развитии симптомов связана с (а) повышением продукции дофамина оставшимися нейронами; (б) повышением экспрессии дофаминовых рецепторов нейронами полосатого тела (положительная регуляция).
Для болезни Паркинсона (БП) характерны следующие симптомы/признаки: тремор, брадикинезия, ригидность и нарушение постуральных рефлексов. Однако все симптомы одновременно проявляются не у всех пациентов.
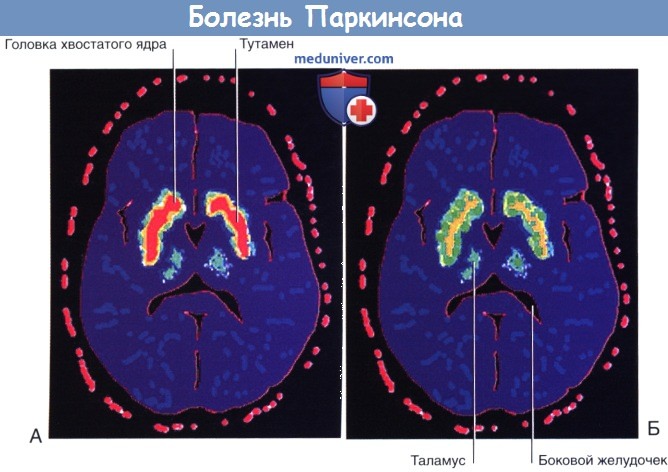
Интенсивность поглощения отображена красным (максимальная), желтым, зеленым и синим (минимальная) цветами.
(А) Здоровый человек. (Б) Болезнь Паркинсона.
а) Тремор. Тремор, имеющий частоту 3—6 Гц в одной конечности, — первый симптом болезни у двух третей пациентов. Выраженность тремора не коррелирует с другими двигательными симптомами БП; также тремор не прогрессирует с той же скоростью, что и брадикинезия, ригидность или нарушения походки. Чаще всего тремор сначала появляется в одной из рук, затем в течение 1 года начинает страдать нога с этой же стороны, затем в течение еще трех лет тремор появляется на противоположной стороне. Отчетливо определяют тремор губ и языка, постоянные пронацию и супинацию предплечий, сгибание и разгибание пальцев.
Характерен также признак «скатывания пилюль» (в русскоязычной литературе чаще используют термин «счет монет»), когда пациент постоянно проводит II и III пальцами кисти вдоль большого пальца. Обычно тремор проявляется только в покое и исчезает при начале движения. Пациент, у которого имеется только тремор покоя, может без больших проблем поднять и выпить стакан воды. Для БП характерен именно тремор покоя, в то время как при расстройствах мозжечка развивается интенционный тремор. Интенционный тремор отсутствует в покое (за исключением случаев тяжелого повреждения мозжечка) и появляется только при произвольных движениях. (Причиной тремора при болезни Паркинсона (БП) может стать сочетание дисфункции базальных ганглиев и мозжечково-таламо-корковых путей.)
Тремор связан с ритмичным возбуждением нейронов всех пяти клеточных групп прямого пути двигательной петли и нейронов переднего рога спинного мозга. Ниже будет описано, как нарушение аутогенного торможения приводит к проявлению тремора покоя и ригидности.
Небольшой тремор действия обычно можно наблюдать у пациентов с выраженным тремором покоя; как правило, он более выражен на той же стороне, где сильнее проявляется тремор покоя. Сильнее всего тремор действия проявляется в пальцах кисти при полностью вытянутых руках. Одно из его проявлений—нарушение почерка. Следует отметить, что при отсутствии тремора покоя наличие небольшого тремора действия свидетельствует о доброкачественном эссенциаль-ном треморе (см. далее).
б) Ригидность. Ригидность захватывает одновременно все соматические мышцы, однако из-за того, что в большей степени ей подвержены мышцы-сгибатели, у пациента возникает характерная «поза просителя». Сопротивление пассивному сгибанию и разгибанию крупных суставов имеется на протяжении всего диапазона движения. Такую ригидность называют ригидностью «по типу свинцовой трубы». Она отличает болезнь Паркинсона (БП) от заболеваний, сопровождающихся повреждением верхних мотонейронов, при которых возникает спастичность по типу «складного ножа». При этом врач может также обнаружить небольшой тремор, возникающий при пассивных движениях. Именно поэтому кажется, что мышцы напрягаются «прерывисто», по типу «зубчатого колеса» (тремор накладывается на ригидность).
Ранее для устранения ригидности прибегали к хирургическому пересечению задних нервных корешков. Это доказывает, что ригидность имеет периферическое чувствительное происхождение. Ригидность также можно устранить путем хирургического разрушения бледного шара или ВЛЯ таламуса. Поскольку при болезни Паркинсона не происходит усиления сгибательных рефлексов, внимание исследователей сосредоточено на афферентных волокнах сухожильного органа Гольджи, отвечающего за аутогенное торможение. Эти афферентные волокна образуют синапсы с тормозными вставочными нейронами 1b, которые активируются во время мышечного сокращения и подавляют активность мотонейронов, иннервирующих эту же мышцу и все гомонимные мышцы (т. е. нервный импульс, возникший в сухожильном органе двуглавой мышцы плеча, будет тормозить нейроны самого бицепса и плечевой мышцы).
У пациентов с болезнью Паркинсона (БП) эндогенное торможение снижено, оно замедляется до такой степени, что начинает смешиваться со стимулами, нисходящими от головного мозга, в результате чего усугубляется тремор. Нарушение торможения также способствует и развитию ригидности, поскольку при болезни Паркинсона во время движения может происходить одновременное сокращение основной мышцы и ее антагониста.
Учитывая, что для активации сухожильных органов требуется сокращение мышцы, возникает вопрос: почему у пациентов проявляется «тремор покоя», если мышцы, предположительно, неактивны? На самом деле, даже если руки человека лежат на коленях или подлокотниках кресла, мышцы рук/кистей не находятся в полном покое. Тремор исчезает только в том случае, если рука полностью фиксирована на уровне локтевого сустава и запястья. Тремор также исчезает во время сна.
В норме волокна корково-спинномозгового и ретикуло-спинномозгового путей постоянно активируют тормозные вставочные нейроны 1b. При болезни Паркинсона активация первичной двигательной коры за счет ДМО снижена и происходит неравномерно, поэтому и появляются характерные симптомы со стороны руки и кисти. Нарушение работы ретикуло-спинномозгового пути, вероятно, сильнее влияет на состояние мышц нижних конечностей.
От нейронов скорлупы проекции отходят не только к бледному шару, но и к ГАМК-ергическим нейронам, в первую очередь, нейронам СЧЧС. Компактная часть черной субстанции также отдает волокна к сетчатой части. Последняя, в свою очередь, имеет связи с локомоторным центром ствола мозга. Один из ожидаемых вторичных эффектов повышенной активности скорлупы при болезни Паркинсона — торможение нервных импульсов, идущих от локомоторного центра к волокнам ретикуло-спинномозгового пути моста и продолговатого мозга.
Один из ранних симптомов болезни Паркинсона — сложности при письме. Отдельные буквы становятся мелкими и неровными. Нарушение письма, вероятно, связано с одновременным сокращением сгибателей и разгибателей кисти, которое возникает из-за выраженного нарушения супраспинальной активации вставочных нейронов 1а, образующих синапсы с мотонейронами мышц-антагонистов.
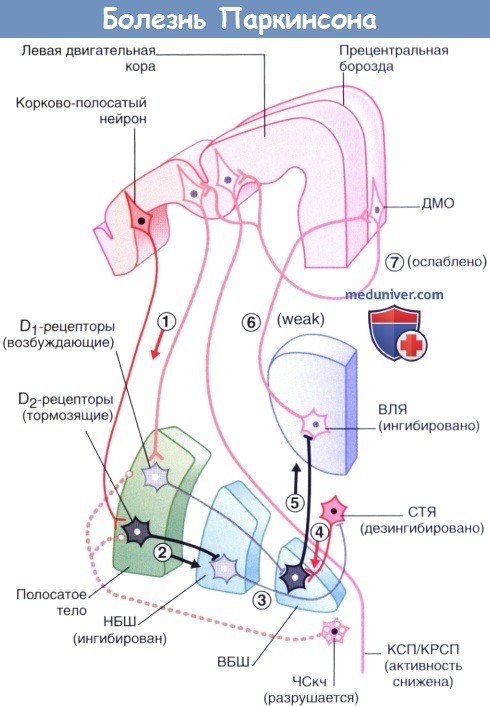
Клинические проявления болезни становятся следствием нарушения тонического возбуждения шипиковых нейронов полосатого тела, экспрессирующих D1-рецепторы, а также следствием нарушения тонического ингибирования нейронов, экспрессирующих D2-рецепторы.
Целостность прямого пути нарушена, активным по умолчанию становится непрямой путь.
(1) Корково-полосатый нейрон активирует ГАМК-ергические нейроны (2) полосатого тела, которые образуют синапсы с нейронами (3) наружного сегмента бледного шара (НБШ).
В результате такого двойного эффекта происходит дезингибирование субталамического ядра (СТЯ).
Нейроны СТЯ влияют на (4) ГАМК-ергические нейроны внутреннего сегмента бледного шара (ВБШ), которые затем воздействуют на (5) вентральное латеральное ядро (ВЛЯ) таламуса, в результате чего снижается передача нервного импульса таламо-корковых волокон, (6) идущих к дополнительной моторной области (ДМО).
Сигналы (7) от ДМО к волокнам корково-спинномозгового и корково-ретикуло-спинномозгового путей (КСП/КРСП) становятся все слабее, в результате чего у пациента появляются сложности с началом движений и их выполнением.
в) Брадикинезия. Под брадикинезией понимают замедление движений. Пациенты жалуются на то, что повседневные действия, например открывание двери, начинают требовать тщательного планирования и сознательного контроля. При электромиографии мышц конечностей определяют снижение начальной электрической активности мышц-агонистов, которая в норме возникает при первом сокращении соответствующих мышц. В норме базальные ганглии начинают контролировать двигательный акт через миллисекунды после того, как премоторная кора и мозжечок подняли частоту генерации потенциала действия нейронами двигательной коры до уровня, необходимого для активации нижних мотонейронов спинного мозга. При болезни Паркинсона нервные импульсы, идущие к мотонейронам спинного мозга, становятся слабее из-за сниженного влияния ДМО.
г) Постуральная неустойчивость. Пациенты легко теряют равновесие, их легко сбить с ног простым случайным толчком («падают как телеграфный столб»). Это происходит из-за нарушения корректирующих постуральных движений: в норме при толкании верхней половины туловища должно произойти немедленное сокращение мышц нижних конечностей, достаточное для восстановления равновесия.
Два других симптома болезни Паркинсона — глазодвигательная дискинезия и деменция — описаны в отдельных статьях на сайте.
д) Дифференциальная диагностика. Болезнь Паркинсона имеет два основных клинических варианта. В первом случае ведущим симптомом выступает тремор, во втором доминируют акинезия и ригидность. В настоящее время известно, что более чем у 20% пациентов, которым был поставлен диагноз БП и начато соответствующее лечение, болезнь Паркинсона отсутствует вовсе либо имеет место синдром «паркинсонизм-плюс» (при мультисистемной дегенерации).
1. Доброкачественный эссенциапьный тремор, который очень часто принимают за БП, встречают в два раза чаще БП. Сначала это заболевание проявляется лишь небольшим тремором, который лучше всего заметен при полностью вытянутых руках. Позднее появляются дрожание головы (не характерное для болезни Паркинсона) и ортостатический (проявляющийся в положении стоя) тремор туловища. Из-за тремора диафрагмы может развиться вокальный тремор. Иногда доброкачественный эссенциальный тремор называют семейным, поскольку его наследуют по аутосомно-доминантному механизму; чаще всего он проявляется на пятом десятилетии жизни. Эссенциальный тремор, наблюдаемый у пожилых, раньше называли сенильным.
Причина заболевания неизвестна. Леводопа (L-допа, см. далее) неэффективна, хотя у больных с болезнью Паркинсона она облегчает оба вида тремора.
В руководствах по клинической неврологии описаны и другие заболевания со схожей клинической картиной, например прогрессирующий надъядерный паралич и корково-базальная дегенерация.
е) Лечение болезни Паркинсона:
1. Консервативное. Наиболее эффективный метод лечения болезни Паркинсона — прием L-допы. Этот препарат проникает через гематоэнцефалический барьер и затем выжившими нейронами черной субстанции метаболизируется в дофамин. Назначение L-допы эффективно примерно у 75% пациентов, выраженность симптомов снижается на 50% и более. Спустя несколько лет приема у пациентов могут развиваться побочные эффекты терапии, в том числе спонтанные хореиформные движения, вызванные чрезмерной активацией полосатого тела. Спустя год и более, по мере прогрессирующей гибели нейронов черной субстанции, эффективность L-допы начинает снижаться. В этом случае для стимуляции постсинаптических дофаминовых рецепторов полосатого тела можно использовать агонисты дофамина (иногда их применяют в качестве терапии первой линии в надежде уменьшить выраженность или замедлить появление побочных эффектов L-допы).
Антихолинергические препараты снижают активность холинергических вставочных нейронов полосатого тела. Они способны снижать выраженность обоих видов тремора, но необходимые для этого дозы могут вызывать побочные реакции со стороны вегетативной нервной системы.
2. Хирургическое лечение болезни Паркинсона. В настоящее время оптимальным методом хирургического лечения болезни Паркинсона считают высокочастотную (133 Гц) стимуляцию СТЯ посредством имплантируемых электродов. Однако механизм(ы) действия этого способа лечения полностью не установлены. При помощи высокочастотной стимуляции удается уменьшить проявления тремора, брадикинезии и ригидности у пациентов с болезнью Паркинсона. Часто стимуляцию необходимо проводить с двух сторон. Посредством введения электродов в СТЯ можно судить о его когнитивных и поведенческих функциях. Подобные изменения, не относящиеся к двигательной сфере, наблюдают при установке электродов в вентральные отделы СТЯ.
Следовательно, в пределах СТЯ имеются различные функциональные отделы. Другой возможный участок стимуляции при болезни Паркинсона — ножкомостовое ядро. Стимуляцию ВБШ в последнее время используют редко.
К другим методам лечения, эффективность которых только определяют, относят использование черной субстанции плода в качестве трансплантата, введение в полосатое тело факторов роста, генотерапию.
Видео этиология, патогенез болезни Паркинсона
Редактор: Искандер Милевски. Дата публикации: 23.11.2018
Биомаркеры болезни Паркинсона
Болезнь Паркинсона имеет много общих клинических признаков с некоторыми другими нейродегенеративными заболеваниями, в том числе множественную системную атрофию синуклеинопатий (MSA), прогрессирующий надъядерный паралич (PSP), деменцию с тельцами Леви (DLB), кортикобазальную дегенерацию (CBD) и т. д. Сообщалось, что на ранней стадии болезни Паркинсона частота ошибочного диагноза может достигать 25%.
Моторные симптомы брадикинезии, тремора в покое и ригидности мышц можно рассматривать как наиболее значимый и прямой диагностический маркер болезни Паркинсона. В то же время, эти двигательные функции также могут быть использованы для мониторинга реакции на лечение и оценки прогрессирования заболевания PD. Для ранней диагностики заболевания имеют значения многие немоторные особенности, включая гипосмию, расстройство сна во время быстрых движений глаз (REM) и запор, последние часто наблюдаются за несколько лет до появления двигательных симптомов.
Аносмия
Еще в 1975 году Ансари и Джонсон обнаружили связь между обонятельной дисфункцией и возникновением болезни Паркинсона (Ansari and Johnson, 1975 ). Впоследствии во многих исследованиях сообщалось, что примерно 75% пациентов с Болезнью Паркинсона имеют повышенный порог обнаружения запаха, и до 90% из них страдают от дефицита идентификации запаха. Многие исследования также показали, что обонятельная дисфункция у «бессимптомных» по отношению к болезни Паркинсона родственников первой степени родства связана с повышенным риском развития этого нейродегенеративного расстройства. С учетом современных достижений в области методов анализа патологии и визуализации головного мозга было выявлено, что нейродегенеративные изменения, в том числе наличие аномальных цитоплазматических белковых включений (тельца Леви), обычно наблюдаются в областях мозга, ответственных за обоняние, таких как обонятельная луковица, гиппокамп, миндалина и орбитофронтальная кора. Согласно теории Браака патологические процессы прогрессирования при болезни Альцгеймера делятся на шесть стадий. Эта теория предложила восходящий путь в патологии головного мозга, начиная с обонятельной луковицы и моторного ядра X дорсального ядра, затем достигая нижнего ствола мозга и, в конечном итоге, распространяясь на кору головного мозга (Braak et al., 2003 ; Goedert и др., 2013 ). Следовательно, обонятельная дисфункция может быть признана ранним диагностическим маркером болезни Паркинсона. В настоящее время UPSIT и Sniffin’s Sticks являются наиболее широко используемым инструментом для проверки обонятельной идентификации. Кроме того, также сообщается, что гипосмия связана с нарушением памяти, а гипосмия является значимым клиническим маркером когнитивной дисфункции при болезни Паркинсона.
Запор
Биохимические маркеры
Ураты
Ураты, образующиеся в печени и тонкой кишке, играют важную антиоксидантную роль, удаляя синглетный кислород, гидроксильные радикалы, гидроксипероксид и пероксинитрит. Ослабление антиоксидантных способностей может сделать клетки тканей организма более уязвимыми для свободных радикалов. Считается, что антиоксидантная защита уратов особенно важна для предотвращения окислительного повреждения мозга человека. Окислительный стресс может быть одной из причин потери и дегенерации дофаминергических нейронов в черной субстанции при болезни Паркинсона. in vitro ураты способны предотвратить самопроизвольную дегенерацию культивируемых нейронов черного вещества в моделях PD, а также гибель дофаминергических нейронов, вызванную окислительными и митохондриальными токсинами. Между тем in vivo на моделях мышей с PD повышенные концентрации урата в центральной нервной системе (ЦНС) приводят к улучшению фенотипа и гистопатологических данных. В двух клинических испытаниях, антиоксидантной терапии депренилом и токоферолом при паркинсонизме (DATATOP) и в исследовании Parkinson Research CEP-1347 (PRECEPT), исследователи предположили, что более высокий уровень сывороточного урата тесно связан с более медленной скоростью прогрессирования заболевания. Концентрация урата в CSF, которая составляет около 10% от концентрации периферической крови, зависит от концентрации урата в периферической крови и целостности гематоэнцефалического барьера. Кроме того, исследование DATATOP также показало, что у пациентов с когнитивной дисфункцией концентрация урата, очевидно, ниже по сравнению с пациентами с PD без когнитивной дисфункции.
Белок DJ-1
Белок DJ-1 является повсеместно распространенным многофункциональным белком, который участвует во многих клеточных метаболических процессах, включая нейропротекторную роль в окислительном стрессе во время нейродегенерации, связывание РНК, шаперон, протеазу и регуляцию митохондрий. Ослабление функции DJ-1 может привести к возникновению заболеваний, связанных с окислительным стрессом, таких как болезнь Паркинсона. Таким образом, мутации в гене DJ-1 PARK7 связаны с наследственным рецессивным вариантом болезни Паркинсона. Несколько исследований показали, что уровни DJ-1 повышены в CSF или плазме пациентов с PD по сравнению с контрольной группой. Кроме того, обширные эксперименты показали, что остаток цистеина в положении 106 (Cys-106) предпочтительно окисляется, когда он подвергается окислительному стрессу. Антиоксидантное действие Cys-106 определяет функции DJ-1. Более того, уровни окисления DJ-1 у Cys-106 в эритроцитах нелеченных пациентов с болезнью Паркинсона заметно повышены по сравнению с пациентами, получающими лекарственные препараты, и контрольными пациентами без PD. Таким образом, окислительный ответ Cys-106 играет важную роль в патогенезе PD.
Исследователи также показали, что уровень DJ-1 в крови, модифицированной 4-гидрокси-2-ноненалом (4-HNE), значительно снижается у пациентов с поздней стадией болезни Паркинсона и может быть полезным биомаркером.
Коэнзим Q10
Гомоцистеин
8-гидроксидезоксигуанозин
8-гидроксидезоксигуанозин (8-OHdG) является основным продуктом реакции окисления гидроксильных радикалов и остатков гуанина в ДНК и является одним из лучших биомаркеров повреждения ДНК вследствие окислительного стресса. Несколько исследований показали, что концентрации 8-OHdG избирательно повышаются в черной субстанции пациентов с болезнью Паркинсона.
Продукты из окисленных белков (AOPP) являются надежным биомаркером галогенирующего стресса, а галогенирование белков является разновидностью окислительного стресса, вызванного фагоцитарной чрезмерной стимуляцией. При количественном определении концентраций AOPP с помощью иммуноферментных анализов (ELISA) исследователи обнаружили, что уровни AOPP в сыворотке пациентов с Болезнью Паркинсона значительно выше, чем у контрольных субъектов.
α-синуклеин
Нейрофиламенты
Нейрофиламенты, как основные компоненты промежуточных филаментов в нейронах, являются основными структурными компонентами аксонов. У пациентов с болезнью Паркинсона выявлено патологическое фосфорилирование нейрофиламентов. Являясь одной из трех субъединиц, нейрофиламенты играют ключевую роль в проведении нервных импульсов и поддержании целостности морфологии нейронов. Это потенциальный клинический биомаркер дегенерации крупных миелиновых аксонов.
IGF-1
Биомаркеры воспаления
Активированная микроглия может секретировать воспалительные цитокины, такие как IL-6, IL-1β и TNF-α, атаковать дофаминергические нейроны и приводить к дегенерации нейронов. В то же время она может также представлять антигены CD4 + T-клеткам и CD8 + цитотоксическим T-лимфоцитам по пути MHC-II, чтобы принимаь участие в иммунной регуляции. Нейровоспалительные реакции приводят к повышенной секреции IL-2, IL-6, IL-10, TNF-α, IL-1β и IFN-γ в плазме и в CSF. Следовательно, увеличение этих воспалительных факторов может стать потенциальным биомаркером для ранней диагностики и выявления прогрессирования болезни Паркинсона.
miRNA