Браф мутация при меланоме что это
Онкологическая клиника в Москве
+7(925)191-50-55
Анализ мутации гена BRAF
За последние десятилетия учеными был обнаружен ряд генетических мутаций, предрасполагающих к возникновению меланомных опухолей.
При этой онкопатологии, впрочем, как и при прочих заболеваниях подобного рода, перерождение здоровых клеток в раковые сопряжено с изменениями генов, ответственных за деление клеток, их пролиферацию и/или апоптоз (естественное самоуничтожение).
Как показывают наблюдения, для злокачественной трансформации необходимо в среднем от четырех до шести таких мутаций. Однако существуют гены, влияние которых на перечисленные процессы так велико, что одной-единственной мутации в них оказывается достаточно для злокачественного перерождения и дальнейшего поддержания роста опухолевого новообразования без внешних природных сигналов.
Один из этих генов – BRAF (серин/треонин-киназа), мутации в котором, согласно статистике, обнаруживаются приблизительно у 40-70% больных меланомой. BRAF входит в число протеинов, формирующих основной сигнальный путь, активирующий рост и отвечающий за сохранение клеточных элементов.
В норме с EGF-рецептором на поверхности клеточной мембраны взаимодействует специфический эпидермальный фактор роста, в результате чего происходит запуск определенного сигнала, передающегося, как известно, по цепочке белков (в т.ч. и по BRAF-гену) к ядру клетки.
Когда же BRAF-ген мутирует, он начинает передавать ростовой сигнал беспрерывно, вне зависимости от упомянутых внешних сигналов, что приводит к аномальному, неконтролируемому делению, размножению клеток и, следовательно, появлению опухолевых образований.
Диагностируют мутации гена BRAF путем постановки молекулярных проб: теста на мутации в структуре гена BRAF V600E, ПЦР в режиме RT (реального времени). Чтобы исследование на наличие мутации было достоверным, нужно свыше 20% злокачественно-перерожденных клеток.

Поэтому пациенту нужно взять в ней парафиновый блок с фрагментами новообразования и предоставить его на консультацию экспертам молекулярной лаборатории.
Кстати, следует отметить, что для данного исследования вполне подходит и первичная меланомная опухоль на кожных покровах, и ее метастатические очаги.
Для качественного выполнения молекулярного анализа на мутацию BRAF-гена обязательно требуется достаточное количество сохранного генетического материала. Таким образом, с одной стороны, крайне важно чтобы в гистологических лабораториях были соблюдены все правила обработки биоматериала, а с другой, чтобы в молекулярной лаборатории имелось высококачественные реактивы и оборудование, что даст возможность выявить мутации гена в наименьшем объеме исходного материала.
Меланомные опухоли, при которых у пациентов выявляется патологический BRAF-ген, принято называть BRAF-позитивными. По мнению специалистов очень важно сделать все необходимые анализы на определение указанной мутации у лиц с распространенными вариантами меланомы и в тех ситуациях, когда злокачественное новообразование не может быть адекватно удалено хирургическим путем.
Оценив статус мутации на этапе разработки индивидуальной лечебной тактики, доктора смогут назначить больному инновационные препараты, способные блокировать измененный ген и в значительной мере повысить эффективность лечения. Эти современные лекарственные средства, которые не так давно были разработаны и внедрены в мировую онкологическую практику, воздействуют на опухоль независимо от того, где она располагается. Их прием позволяет существенно увеличить продолжительность жизни больных с распространенными меланомами.
+7(925)191-50-55
г. Москва, Духовской переулок, 22б
+7(925)191-50-55 — европейские протоколы лечения в Москве
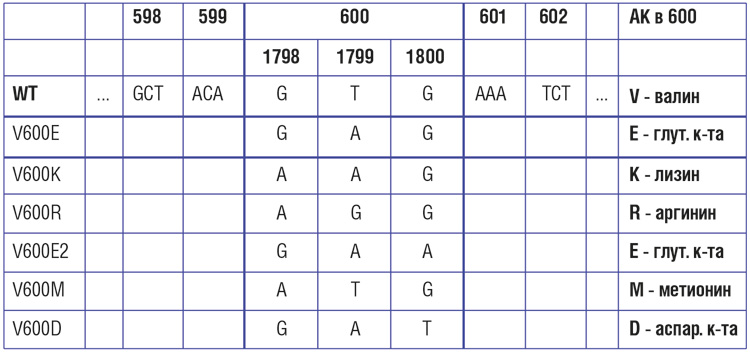
Мутация гена BRAF при меланоме
Частота и виды мутаций в гене BRAF
Частота мутаций в гене BRAF при меланоме кожи, по данным разных исследователей, варьирует от 30-40% до 70%. Наиболее распространенной (69-94% случаев) разновидностью BRAF-мутаций является V600E – замена валина на глутамин в 600-м кодоне. Эта мутация представляется доминирующей, но далеко не единственной разновидностью нарушений BRAF [14, 15]. Второй по частоте является мутация V600К – ее частота может достигать 5-10%. Мутации V600D и V600R встречаются значительно реже.
Cтатус мутации гена BRAF и выбор тактики лечения
За последние годы достигнуты значительные успехи в изучении патогенетических основ развития меланомы и сделан огромный шаг к выявлению новых потенциальных молекулярных мишеней. Открытие молекулярной мишени BRAF и понимание ее роли в патогенезе меланомы легли в основу разработки нового класса препаратов – низкомолекулярных ингибиторов мутированного фермента BRAF. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и, таким образом, тормозить развитие опухоли. Следует особо отметить, что воздействие данной группы препаратов на опухолевые клетки с нормальной последовательностью BRAF, напротив, может сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Этот феномен свидетельствует об исключительной важности достоверной диагностики статуса гена BRAF.
BRAF ингибиторы не должны использоваться в тех случаях, когда статус мутации BRAF не определен или мутация не обнаружена!
Следует подчеркнуть, что ингибиторы BRAF и MEK зарегистрированы к применению только для терапии метастатической формы меланомы. В настоящее время отсутствуют данные по использованию ингибиторов BRAF и MEK в адъювантном режиме, поэтому они не могут быть рекомендованы пациентам, перенесшим (условно-)радикальное удаление первичной меланомы и метастических очагов.
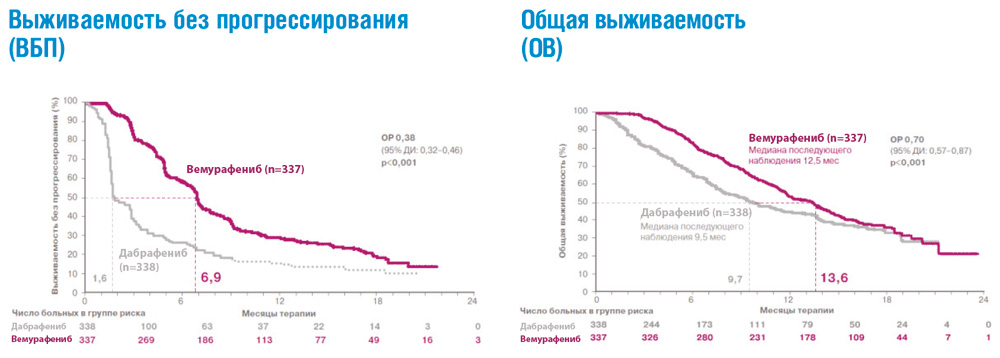
В рандомизированных клинических исследованиях ингибиторы BRAF – вемурафениб и дабрафениб – продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией в отношении частоты объективных ответов, продолжительности жизни без прогрессирования и общей продолжительности жизни у пациентов с метастатической меланомой и подтвержденной мутацией гена BRAF, ранее не получавших системного лечения (см. рис. 2). Полученные результаты привели к пересмотру международных клинических рекомендаций, которые включили эти препараты в современные стандарты лечения метастатической меланомы кожи с BRAF мутацией.
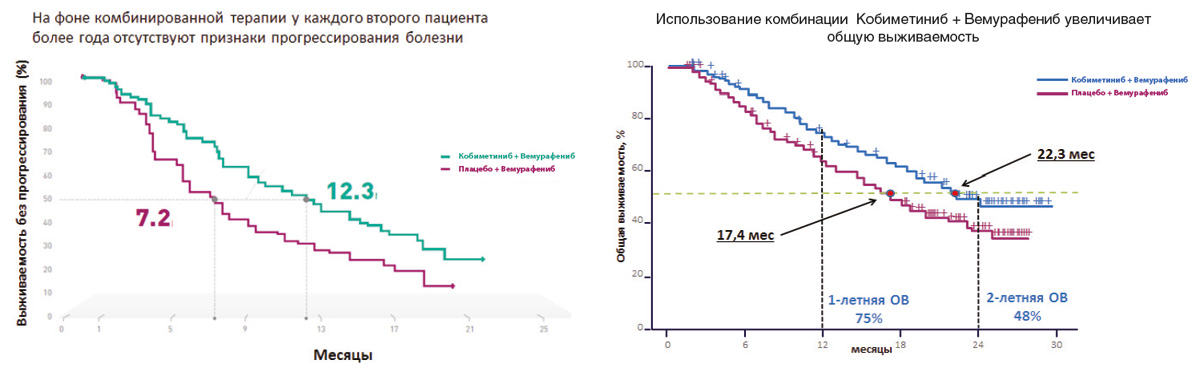
Результаты последних исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, обладает более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме. Важно отметить, что помимо более высокой эффективности комбинация препаратов снижает вероятность развития резистентности к проводимой терапии и отдельных нежелательных явлений, в том числе плоскоклеточного рака кожи. В рамках клинического исследования coBRIM было подтверждено, что комбинированная терапия с использованием препаратов вемурафениб и кобиметиниб в 90% случаев позволяет достичь ответа на терапию у больных BRAF+ метастатической меланомой. У каждого второго пациента более года отсутствовали признаки прогрессирования заболевания, а общая выживаемость приближалась к 2 годам (рис. 3).
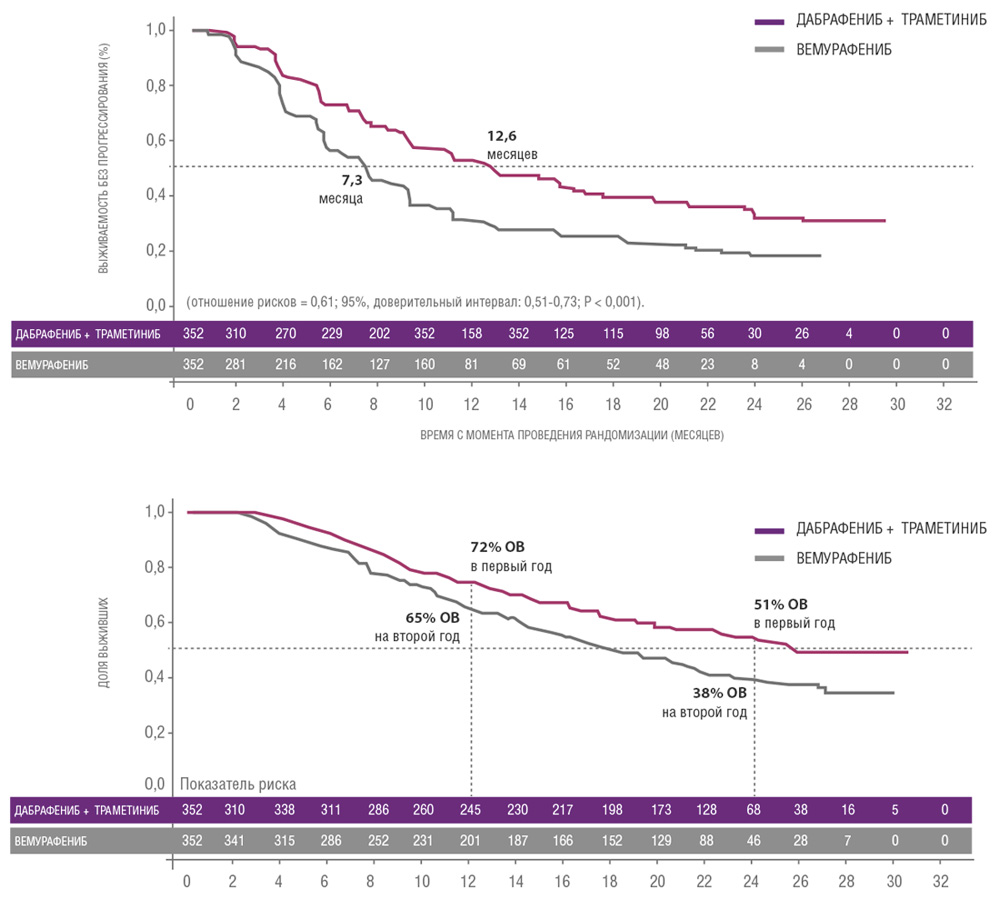
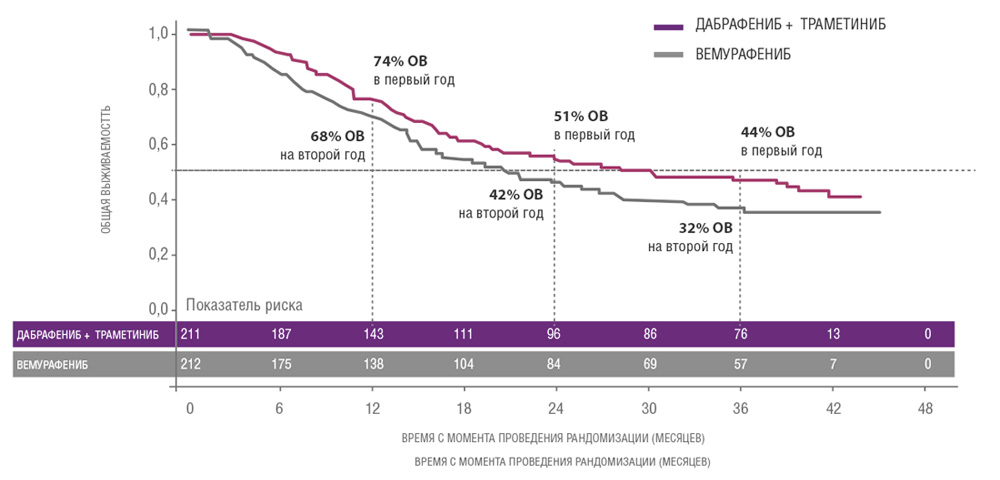
Сходные результаты были продемонстрированы в исследованиях дабрафениба и траметиниба. В частности, исследование COMBI-V (дабрафениб+траметиниб vs монотерапия вемурафенибом) продемонстрировало значимой увеличение общей продолжительности жизни у пациентов, получавших комбинированную терапию, по сравнению с применением вемурафениба без ингибитора MEK (25.6 мес. vs 18 мес.; рис. 4, табл. 1). В клиническом испытании COMBI-D сравнивалась эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо. Примечательно, что в этом исследовании были зарегистрированы практические идентичные показатели общей продолжительности жизни (25.1 мес. vs 18.7 мес.; рис. 5, табл. 1).
Определение статуса гена BRAF является обязательным компонентом выработки тактики лечения всех пациентов с неоперабельной/метастатической меланомой кожи.
Рисунок 2. Результаты рандомизированного исследования BRIM-3: сравнение эффективности вемурафениба и дабрафениба в 1-й линии терапии метастатической меланомы с мутацией BRAF.
Рисунок 3. Результаты рандомизированного исследования coBRIM: сравнение эффективности комбинации кобиметиниба+вемурафениба и вемурафениба+плацебо в 1-й линии терапии метастатической меланомы с мутацией BRAF.
Рисунок 4. Результаты клинического исследования COMBI-V: (дабрафениб+траметиниб vs монотерапия вемурафенибом).
Рисунок 5. Результаты клинического испытания COMBI-D: эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо.
Сводные данные по всем исследованиям представлены в таблице 1.
| Исследование | COMBI-d | COMBI-v | ||
|---|---|---|---|---|
| Препарат(ы) | Д + T | Д + пла | Д + T | В |
| Кол-во пациентов, n | 211 | 212 | 352 | 352 |
| Медиана ВБП, мес. | 11,0 | 8,8 | 12,6 | 7,3 |
| Медиана ОВ, мес. | 25,1 | 18,7 | 25,6 | 18,0 |
| Медиана ОВ, ЛДГ≤ВГН | Нет анализа | НД | 21,5 | |
| Медиана ОВ, ЛДГ>ВГН | 10,8 | 8,9 | ||
Сокращения: В – вемурафениб, К – кобиметиниб, Д – дабрафениб, Т- траметиниб, пла – плацебо, НД – не достигнута, ВГН – верхняя граница нормы.
Таким образом, использование BRAF/MEK ингибиторов у пациентов с мМК, имеющей BRAF мутацию, представляет первый успешный пример персонализированной терапии, изменившей представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Эти препараты пришли на смену химиотерапии и стали новым стандартом лечения меланомы с BRAF мутацией, что подтверждает ранее сформулированный постулат о необходимости разработки различных подходов к лечению для различных молекулярно-генетических подтипов меланомы. Появляются результаты исследований таргетных препаратов и при других типах меланомы, имеющих альтернативные мутации (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлимой частью разработки стратегии лечения каждого пациента, имеющего диагноз «меланома».
На сегодняшний день все существующие BRAF и MEK ингибиторы зарегистрированы на территории Российской Федерации и, при соответствующем лекарственном обеспечении, с успехом могут быть использованы для терапии мМК. Профиль безопасности этих препаратов позволяет использовать их в амбулаторных условиях.
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Онкоген BRAF: ключевая роль в развитии меланомы и пути преодоления его влияния.
BRAF является достаточно известным онкогеном, а вот приставка V600E после его названия ясна не каждому. Между тем мутация в структуре данного онкогена играет ключевую роль в развитии меланомы — опухоли с одним из самых неблагоприятных прогнозов. В этом материале будут рассмотрены история разработки средств против меланомы с мутацией в гене BRAF и пути преодоления резистентности последнего к современной таргетной терапии.
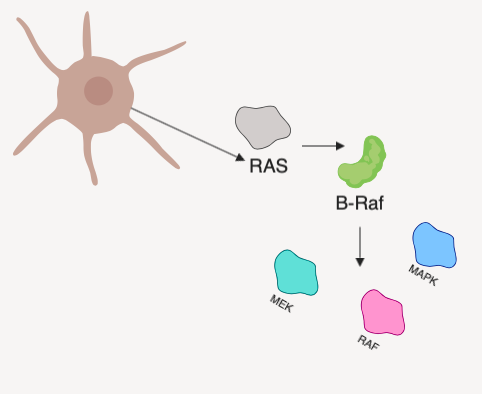
BRAF представляет собой онкоген, кодирующий белок B-Raf — серин-треонин протеинкиназу, участвующую в функционировании высокоонкогенных сигнальных путей RAS/RAF/MEK/ERK (название одного из перечисленных сигнальных путей и дало имя данному белку и его гену). Продукт BRAF обнаруживается в клетках абсолютно разных типов в неактивном состоянии. Его функциональная активация происходит путем димеризации под действием сигнального пути RAS. Активированный B-Raf фосфорилирует и активирует другие ассоциированные сигнальные пути, и киназный каскад, запускаемый в результате этих процессов, поддерживает выживание клеток и их пролиферацию, одновременно ингибируя дифференцировку [1].
Рисунок 1 | Упрощенная схема активации сигнальных путей, в которых принимает участие протеин B-Raf.
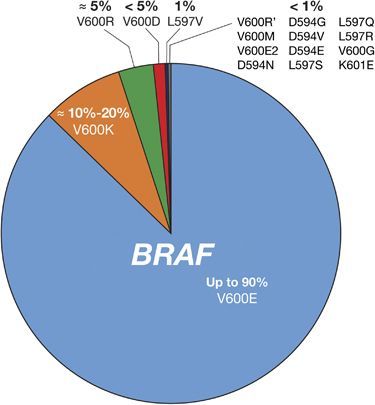
BRAF и его продукт играют критическую роль в формировании опухолей человеческих тканей. Около 7 % всех опухолей связаны с мутацией данного гена, включая 100 % случаев волосатоклеточного лейкоза, 50–60 % случаев меланомы, 30–50 % случаев папиллярной карциномы щитовидной железы, 10–20 % случаев колоректальных опухолей и 3–5 % случаев немелкоклеточного рака легкого. Самой распространенной мутацией является нуклеотидная замена, которая превращает валин в позиции 600 в глутамин (мутация V600E), лизин (мутация V600K) или другую аминокислоту (V600 A/D/G/L и другие). Подобные мутации способствуют тому, что B-Raf перестает зависеть от активации сигнального пути RAS и становится функционально активным в форме мономера [1].
Рисунок 2 | Частота встречаемости наиболее распространенных мутаций BRAF.
Обнаружение активирующих мутаций в данной серин-треонин киназе послужило основой волны последующих исследований того, насколько критическую роль играют ассоциированные с ней сигнальные пути в инициации и прогрессии меланомы и других опухолей. Так, активация ассоциированного с B-Raf сигнального пути МАРК in vivo ассоциируется с пролиферацией клеток меланомы. Доклинические исследования, длившиеся более 15 лет, утвердили, что центральную роль в контроле пролиферации клеток меланомы играет мутация BRAF V600E. Кроме того, данная активирующая мутация оказывает влияние на апоптоз, миграцию, инвазию клеток меланомы, метаболизм глюкозы в них, их адаптацию к гипоксии и ангиогенез формирующейся опухоли. Таким образом, чувствительность опухоли к химиотерапии обретает зависимость не только от функциональной активности B-Raf, но и от скорости протекания в ее клетках процессов, связанных с активацией МАРК [2].
Определение и характеристика мутаций BRAF оказывает существенное влияние на подбор терапии меланомы. Выявление мутаций в структуре этого онкогена осуществляется путем проведения методов генетического секвенирования [3]. Подробнее эти методы рассмотрены в данном материале.
До открытия активирующих мутаций в гене BRAF, меланома крайне тяжело поддавалась терапии. Классическая химиотерапия и пролекарство дакарбазин демонстрировали небольшие терапевтические возможности для клиницистов, стремящихся снизить заболеваемость данным типом опухоли. В 2002 году было обнаружено наличие мутаций BRAF в 60 % случаев меланом, что сыграло огромную роль в определении сущности данного гена в инициации и прогрессировании опухолей кожи. Сегодня известно, что активирующая мутация BRAF обнаруживается в 50 % случаев меланом и в 80 % тканей меланоцитарных невусов. Явная ассоциация данного онкогена с формированием меланоцитарных опухолей дала основу для разработки средств таргетной терапии меланомы, что принесло новую надежду как клиницистам, так и пациентам.
Первый препарат антител, активных против B-Raf, был разработан в 2011 году [4]. Первоначально для таргетной терапии меланомы ингибиторы BRAF (вемурафениб, дабрафениб) использовались как самостоятельные агенты. В дальнейшем была выявлена способность клеток меланомы к формированию резистентности против таких агентов. Одни из наиболее распространенных путей такой фармакорезистентности — это реактивация сигнального пути МАРК, ограничение апоптоза клеток меланомы, а также активация сигнального пути PI3K, стабилизирующего выживаемость меланомных клеток «в обход» МАРК [2, 5].
В настоящее время во избежание формирования терапевтической резистентности при лечении меланомы ингибиторы BRAF комбинируют с ингибиторами другого онкогенного сигнального пути — МЕК (такими препаратами являются биниметиниб и траметиниб). Систематические обзоры и мета-анализы продемонстрировали, что применение подобной комбинации увеличивает общую продолжительность жизни пациентов и замедляет прогрессирование опухоли в сравнении с монотерапией только ингибиторами BRAF [6].
К сожалению, несмотря на обилие современных разработок, меланома по-прежнему ассоциируется с крайне негативным терапевтическим прогнозом и малой общей выживаемостью. Разработки средств таргетной терапии данной опухоли непременно должны продолжаться — возможно, еще одна новая комбинация поможет существенно снизить смертность от этой патологии и сделать диагноз «меланома» менее пугающим.
Источники:
1. The landscape of BRAF transcript and protein variants in human cancer. / Andrea Marranci, Zhijie Jiang, Marianna Vitello [et al]. // Mol Cancer. — 2017. — Vol. 16. — p. 85.
2. Overcoming resistance to BRAF inhibitors. / Imanol Arozarena, Claudia Wellbrock. // Ann Transl Med. — 2017. — Vol. 5, №19. — p. 387.
3. Rapid BRAF mutation tests in patients with advanced melanoma: comparison of immunohistochemistry, droplet digital PCR, and the Idylla mutation platform. / Cornelis Bisschop, Arja ter Elst, Lisette J. Bosman [et al]. // Melanoma Res. — 2018. — Vol. 28, №2. — p. 96-104.
4. BRAF V600E-specific antibody: a review. / Ritterhouse LL, Barletta JA. // Semin Diagn Pathol. — 2015. — Vol. 32, №5. — p. 400-408.
5. BRAF-mutant melanoma: treatment approaches, resistance mechanisms, and diagnostic strategies. / Francesco Spagnolo, Paola Ghiorzo, Laura Orgiano [et al]. // Onco Targets Ther. — 2015. — Vol. 8. — p. 157-168.
6. Combination therapy of BRAF inhibitors for advanced melanoma with BRAF V600 mutation: a systematic review and meta-analysis. / Kim S, Kim HT, Suh HS. // J Dermatol Treat. — 2018. — Vol. 29, №3. — p. 314-321.
BRAF мутация – ключ эффективности терапии меланомы
Анализ применяется для определения больных с метастазами меланомы, которые могут реагировать на BRAF таргетную терапию.
Более чем в 50% случаев у пациентов с меланомой выявляется мутация гена БРАФ. Возможны различные варианты мутации, которые обозначаются различными комбинациями букв и цифр, например: V600K, V600E и другие. Случай меланомы, при котором выявляется такая генная мутация, получил название BRAF-положительной меланомой. Этот момент имеет практическое значение, особенно в случае выявления распространенной или неоперабельной меланомы. В настоящее время разработаны специальные лекарственные средства, например Зелбораф (вемурафениб), которые обладают способностью воздействовать именно на этот сигнальный путь и таким образом тормозить опухолевую прогрессию. Существенно увеличивается процент выживаемости таких пациентов и их качество жизни.
Выявление мутаций
Как определяется мутация
Факт наличия или отсутствия BRAF мутации важен с точки зрения выбора терапии меланомы. Мутацию можно рассматривать как один из факторов, который позволит предсказать дальнейшую эффективность противоопухолевой терапии.
Эффективность BRAF таргетного лечения
Установлено, что выявление мутации в гене является одним из возможных критериев эффективности терапии меланомы и ее вторичных метастатических очагов. Определить мутацию необходимо для проведения целевой терапии пациентов с метастазирующей меланомой, которые могут положительно реагировать на БРАФ таргетное лечение. Если диагноз меланомы установлен на ранних этапах заболевания, то эта опухоль достаточно хорошо реагирует на специфическое лечение.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Современная терапия метастатической BRAFположительной меланомы
Меланома кожи – одна из наиболее злокачественных опухолей человека, характеризующаяся непредсказуемым и агрессивным течением. В рамках XI Съезда онкологов России, организованного Ассоциацией онкологов России, МНИОИ им. П.А. Герцена – филиалом ФГБУ «НМИЦ радиологии» Минздрава России и Ярославской областной клинической онкологической больницей при поддержке компании «РОШ», прозвучали доклады ведущих онкологов России, посвященные вопросам применения комбинации таргетных препаратов в терапии метастатической BRAF-положительной меланомы кожи.
Движение вперед – сегодня и завтра в лечении BRAF+ метастатической меланомы
Современные подходы к лечению меланомы кожи основаны на знании о молекулярно-генетических механизмах развития данного заболевания. Принципиально важное значение для прогноза и определения тактики ведения пациентов с меланомой имеет выявление мутации гена BRAF. Как известно, у пациентов с мутацией BRAF заболевание характеризуется более агрессивным течением, чем у BRAF-негативных больных. С 2015 г. в первой линии терапии у пациентов с метастатической или неоперабельной меланомой кожи с мутацией в гене BRAF успешно применяют комбинации ингибиторов протеинкиназы BRAF и MEK, в частности вемурафениба и кобиметиниба. Использование в первой линии терапии ингибиторов протеинкиназы BRAF и MEK позволяет внести серьезные коррективы в подходы к лечению BRAF-положительной (BRAF+) метастатической неоперабельной меланомы. По данным исследований, клиническая эффективность комбинации «кобиметиниб + вемурафениб» подтверждена примерно у 90% больных метастатической меланомой с мутацией BRAF V600 [1]. При этом полный ответ отмечен в 21% случаев, частичный ответ – в 49%, стабилизация заболевания – в 18% случаев. Результаты наблюдений продемонстрировали, что на фоне комбинации «кобиметиниб + вемурафениб» у пациентов частота объективного ответа (ЧОО) достигла 70%, контроль заболевания достигнут в 88% случаев.
Лишь у 7% больных зафиксировано прогрессирование заболевания. Большинство нежелательных явлений 3-й и более степени тяжести регистрируются в течение первых 28 дней терапии и, как правило, потом нивелируются [2]. Профиль пациента для назначения двойной комбинации «вемурафениб (Зелбораф®) + кобиметиниб (Котеллик®)» – пациенты с метастатической меланомой BRAF+ любого возраста в общем удовлетворительном состоянии (по шкале Eastern Cooperative Oncology Group (ECOG) 0–1 балл), с нормальными показателями лактатдегидроденазы (ЛДГ), средней опухолевой нагрузкой, отсутствием метастазов в головной мозг и печень, со стадией М1a/М1b. Допускается наличие у пациентов аутоиммунных заболеваний. Итак, комбинированную терапию вемурафенибом и кобиметинибом отличают быстрый старт, быстрое клиническое воздействие и снижение симптоматической нагрузки. Однако даже двойное ингибирование BRAF и MEK не гарантирует полного преодоления резистентности у пациентов с метастатической меланомой BRAF+. Поэтому были продолжены исследования, целью которых было получение комбинации, обеспечивающей не только быстрый ответ на терапию, но и продление длительности ответа.
В 2020 г. компания «РОШ» впервые зарегистрировала тройную комбинацию ингибиторов BRAF и MEK с иммуноонкологическим препаратом – PD-L1-ингибитором атезолизумабом для лечения неоперабельной местно-распространенной или метастатической меланомы кожи.
Преимущества данной комбинации в лечении метастатической или неоперабельной меланомы кожи были продемонстрированы в международном многоцентровом рандомизированном исследовании TRILOGY. Получены данные о том, что медиана выживаемости без прогрессирования (ВБП) в группе пациентов, получающих тройную комбинацию «атезолизумаб + кобиметиниб + вемурафениб», превосходит ранее достигнутые значения во всех известных комбинациях и составляет 15,1 месяца. Кроме того, отмечено увеличение длительности ответа в группе тройной комбинированной терапии по сравнению с другими схемами терапии. Так, длительность ответа на комбинации «атезолизумаб + кобиметиниб + вемурафениб» увеличилась почти в два раза по сравнению с двойной комбинацией (кобиметиниб + вемурафениб) – 21,0 против 12,6 месяца соответственно [3].
Важно, что тройная комбинация «атезолизумаб + кобиметиниб + вемурафениб» показала наивысшую ЧОО среди иммунотерапевтических схем при минимальном уровне прогрессирования заболевания. Прогрессирование заболевания на фоне тройной комбинации составило всего 5,5%, тогда как при приеме монотерапии ниволумабом – 38%, а при комбинации «ниволумаб + ипилимумаб» – 24%. Показатели ЧОО в группе пациентов, получающих тройную комбинированную терапию, составили 66,3%, что значительно превышает результаты, полученные на фоне лечения комбинацией «ниволумаб + ипилимумаб», – 58%. Также добавление атезолизумаба к комбинации кобиметиниба и вемурафениба приводило к увеличению показателей частичного ответа практически в два раза по сравнению с другими комбинациями. Промежуточный анализ общей выживаемости (ОВ) в исследовании TRILOGY демонстрирует положительный тренд в группе тройной комбинации «атезолизумаб + кобиметиниб + вемурафениб» по сравнению с двойной (кобиметиниб + вемурафениб) – расхождение на уровне 15,7 месяца.
Очевидно, что лечение пациентов с метастатической меланомой требует особого подхода. Среди данной популяции больных отмечается высокая частота отмены терапии с использованием различных схем. Последние данные свидетельствуют, что при использовании тройной комбинации частота отмены терапии в три раза ниже, чем на комбинированной иммунотерапии, и составляет всего 12,6%. Таким образом, тройная комбинация не только обеспечивает более продолжительный ответ на терапию, но и реже приводит к отмене терапии из-за нежелательных явлений. Безусловно, пациентам с меланомой и массивным метастатическим поражением следует назначать терапию, способную обеспечить быстрый и длительный ответ, снижение опухолевой нагрузки и улучшение клинического состояния. На сегодняшний день после длительных дискуссий специалистов определен профиль пациента для применения тройной комбинации «атезолизумаб (Тецентрик®) + кобиметиниб (Котеллик®) + вемурафениб (Зелбораф®)» в первой линии терапии метастатической меланомы:
Таким образом, соблюдая тщательный подбор пациентов под данную комбинацию, можно достичь хорошего эффекта терапии, быстрого и длительного по своей продолжительности.
Трилогия в реальной клинической практике. Первые результаты
Докладчик рассказал об опыте применения тройной комбинации «атезолизумаб + кобиметиниб + вемурафениб» в реальной клинической практике.
Пациентка, 67 лет. В 2015 г. обнаружила у себя рост давно существующего пигментного образования на коже правого бедра. 19 августа 2015 г. по месту жительства в Архангельском клиническом онкологическом диспансере выполнено широкое иссечение образования кожи правого бедра. Установлен диагноз: меланома кожи правого бедра T3bN0M0, IIВ стадия. В соответствии с актуальными на тот момент клиническими рекомендациями пациентке было рекомендовано динамическое наблюдение. В мае 2019 г. при контрольном обследовании у пациентки выявлено прогрессирование заболевания в виде появления метастазов в регионарных паховых лимфатических узлах справа и солитарного метастаза в мягких тканях правого бедра. 21 июня 2019 г. пациентке выполнено хирургическое лечение – пахово-бедренная лимфаденэктомия (операция Дюкена) справа и удаление солитарного одиночного метастаза в мягких тканях правого бедра.
У пациентки была выявлена BRAF-мутация, в связи с чем назначена адъювантная таргетная терапия – дабрафениб + траметиниб.
Через 10 месяцев от начала адъювантной таргетной терапии, в мае 2020 г. при контрольном обследовании выявлено прогрессирование заболевания. По данным ультразвукового исследования, обнаружен местный рецидив в области мягких тканей правого бедра, метастазы в печени. В июне при проведении компьютерной томографии (КТ) выявлены метастазы в легких, в медиастинальных лимфатических узлах.
Пациентке была назначена иммунотерапия пембролизумабом. С 17 августа по 28 сентября 2020 г. ей выполнено три введения препарата пембролизумаб с удовлетворительной переносимостью. Эффектом терапии явилось клиническое прогрессирование заболевания, отрицательная динамика. При этом не только увеличились уже имевшиеся очаги, но и появилось множество новых очагов в легких, плевре, почках, надпочечниках, поджелудочной железе, паранефральной клетчатке. В октябре – декабре 2020 г. был сделан перерыв в лекарственной терапии.
В ноябре 2020 г. пациентка впервые обратилась за помощью в Ленинградский областной клинический онкологический диспансер, поскольку приехала из Архангельска к родным в Санкт-Петербург. Основные жалобы пациентки были обусловлены наличием крупного мягкотканного метастаза мягких тканей правого бедра. Ей были даны рекомендации для продолжения таргетного лечения ингибиторами BRAF и MEК по месту жительства.
Далее 18 ноября 2020 г. после обращения в Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина больной произведено паллиативное удаление рецидива опухоли кожи правого бедра. Пациентка была проконсультирована профессором С.А. Проценко, которая также рекомендовала реиндукцию таргетной терапии ингибиторами BRAF и MEК. В Ленинградский областной клинический онкологический диспансер пациентка снова обратилась в конце декабря 2020 г. Ее состояние ухудшилось, она самостоятельно не перемещалась, предъявляла жалобы на выраженную слабость, болевой синдром, отек нижней правой конечности. В связи с тяжелым состоянием пациентки 25 декабря 2020 г. принято решение о назначении терапии комбинацией «вемурафениб 1920 мг/сут + кобиметиниб 60 мг/сут».
В первый месяц комбинированного лечения у пациентки развились нежелательные явления (НЯ) 1–3-й степени, прежде всего выраженная кожная токсичность, гипертермия до 39 ºС, стоматит. Пациентка самостоятельно редуцировала дозу вемурафениба до 480 мг два раза в сутки (960 мг/сут), при этом выраженность НЯ уменьшилась. С 14 января 2021 г. доза вемурафениба увеличена до 960 мг утром и 720 мг вечером (1680 мг/сут), больная получает симптоматическую терапию. На фоне лечения состояние пациентки стабилизировалось.
В начале февраля 2021 г., через полтора месяца лечения таргетной терапией, состояние пациентки значительно улучшилось по сравнению с прежними данными, полученными в декабре 2020 г. Так, состояние больной по шкале ECOG – 1 (в декабре – 2–3), пациентка самостоятельно перемещалась, приходила на прием, отсутствовали жалобы на болевой синдром, отечность нижних конечностей минимальная. Уровень ЛДГ на фоне проводимой терапии остается в пределах нормы.
Пациентка субъективно стала чувствовать себя значительно лучше, хотя некоторая слабость присутствовала. Она стала выполнять домашнюю работу, готовить пищу.
По данным КТ, крупный метастаз в S6 правого легкого практически исчез, визуализируется небольшой очаг в легком S10 справа, уменьшились депозиты в правом надпочечнике, правой почке. В левой почке метастаз не описывается, в печени метастазы уменьшились. По сравнению с данными КТ от октября 2020 г. на фоне назначения комбинированной таргетной терапии вемурафенибом и кобиметинибом отмечена стабилизация заболевания.
Таким образом, в данном клиническом случае получен объективный ответ на комбинированную таргетную терапию. Накопленные данные показывают, что реиндукция таргетной терапии позволяет добиться быстрого ответа на терапию у пациентов, обеспечивает контроль заболевания, улучшает ВБП у пациентов с метастатической меланомой кожи.
Однако для увеличения медианы ВБП, длительности терапевтического эффекта у пациентов с метастатической меланомой к комбинации ингибиторов протеинкиназы BRAF и MEK целесообразно добавление иммуноонкологической терапии.
Добавление 5 марта 2021 г. атезолизумаба (Тецентрик®) в дозе 1200 мг/3 недели к комбинации вемурафениба и кобиметиниба не привело к серьезному изменению профиля токсичности, все НЯ манифестировали в начале лечения и хорошо контролировались. При этом пациентка не почувствовала серьезного изменения в самочувствии после первого введения препарата. При проведении КТ в конце марта 2021 г. отмечена положительная динамика и продолжающийся положительный эффект тройной терапии. Субъективно пациентка стала чувствовать себя значительно лучше (ECOG – 0), она самостоятельно ухаживает за собой, выходит из дома, много гуляет. На сегодняшний день продолжается динамическое наблюдение за состоянием пациентки на фоне проводимой тройной комбинированной терапии.
Таким образом, данный клинический случай наглядно демонстрирует возможности таргетной комбинированной терапии метастатической меланомы. Назначение комбинированной таргетной терапии (вемурафениб + кобиметиниб) пациентке 67 лет с метастатической меланомой привело к значительной положительной динамике субъективного ответа через полтора месяца лечения. С первых недель терапии наблюдалась стабилизация состояния пациентки. Кроме того, комбинированная таргетная терапия показала удовлетворительный профиль переносимости. А интенсификация терапии до тройной комбинации «вемурафениб (Зелбораф®) + кобиметиниб (Котеллик®) + атезолизумаб (Тецентрик®)» не показала значимого изменения профиля токсичности