что означает состояние больного по ecog 0 1
Шкала ECOG в онкологии
Содержание Скрыть
Шкала Карновского в онкологии – это система, по которой происходит оценка общего состояния больных раком. Благодаря такому методу появляется возможность не только устанавливать, насколько эффективно прошла предоперационная подготовка, но и отслеживать в целом проведение терапевтических мероприятий.
Чтобы оценить состояние пациента, может использоваться индекс Карновского по 100-бальной системе или шкала боли у онкобольных, предусматривающая 4-бальный критерий.
Что такое
Индекс Карновского, или шкала ECOG в онкологии, представляют собой широко востребованную систему, предназначенную для отслеживания функционального состояния людей с раковыми опухолями. Впервые введение понятия было отмечено в 1949 году.
Система позволяет описывать состояние пациентов благодаря использованию 11-бальной шкалы в соотношении с процентным значением, не превышающем 100% (отсутствуют признаки болезни) и 0% — летальный исход.
Зачем нужна
Качество жизни представляет собой ряд параметров, которые будут отражать состояние в период развития онкологического процесса и проведения терапевтических мероприятий. В результате специалист может оценить психологические, физические и функциональные особенности онкобольного.
Поскольку качество жизни представляет собой динамическое состояние, значения которого способны меняться во времени, то необходимо использовать систему в течение определенного периода как изменяющийся параметр, который будет зависеть от течения и разновидности злокачественного процесса, а также применяемых методов терапии.
Благодаря полученным данным специалист может более правильно подбирать тактику терапевтических мероприятий.
Методы оценки состояния онкологических пациентов
Определение состояния больного при помощи индекса Карновского выглядит следующим образом:
Если оценивать качество жизни онкологического больного по системе Еcog, то у показателей будут следующие значения:
Описанная система позволяет оценивать не только качество жизни, но и уровень применяемого лечения. В настоящее время для определения подобных значений применяется комплекс методик.
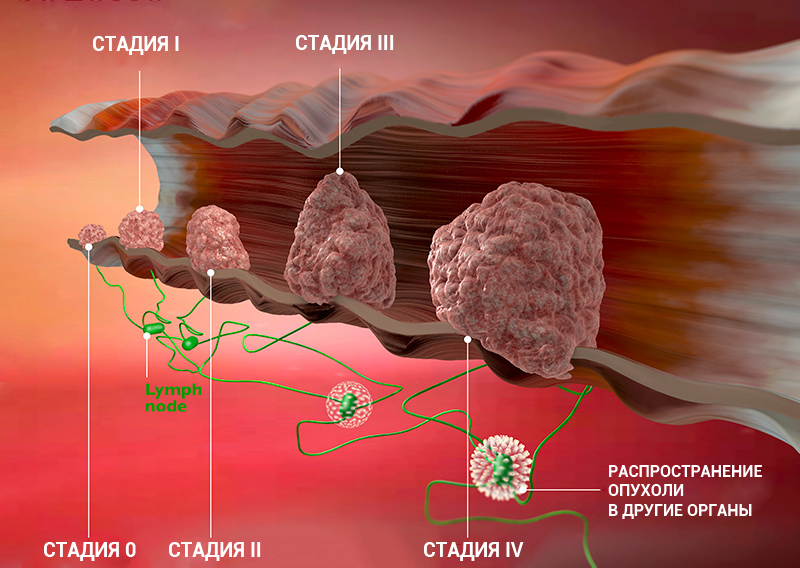
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Материалы конгрессов и конференций
37 съезд Американского общества клинической онкологии (ASCO)
12-15 мая 2001 года, Сан-Франциско, США
ASCO 2001: Рак легкого.
Трякин А.А.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
За последнее десятилетие большинство докладчиков по раку легкого заканчивали свои выступления словами, что «только лучшее понимание биологии этой опухоли может улучшить результаты терапии распространенного рака легкого». В 2001г мы, наконец, располагаем новыми препаратами, возможно отвечающими нашим ожиданиям. На сессионных заседаниях, посвященных раку легкого, основное внимание было сосредоточено на больших рандомизированных исследованиях существующих препаратов, а также по I/II фазе небольших поисковых исследованиях с новыми агентами. Большинство рандомизированных исследований не смогли показать существенных преимуществ между основными текущими активными режимами при раке легкого.
Лечение распространенного немелкоклеточного рака легкого (НМРЛ) у пожилых.
Впервые успех химиотерапии у пожилых больных был показан Gridelli et al. в исследовании ELVIS [1], продемонстрировавшем лучшую выживаемость при монотерапии винорельбином в сравнении с лучшей поддерживающей терапией. В этом году Gridelli представил первые результаты исследования MILES (Multicenter Italian Lung Cancer Study) [2]. В данном исследовании пациенты старше 70 лет с IIIB/IV стадией НМРЛ рандомизировались в три группы: монотерапия винорельбином (30 мг/м 2 1 и 8 дни), монотерапия гемцитабином (1200 мг/м 2 1 и 8 дни), комбинация винорельбин/гемцитабин (25 мг/м 2 и 1000 мг/м 2 оба препарата в 1 и 8 дни). Курсы химиотерапии проводились с 3-недельным интервалом. Результаты исследования представлены в табл. 1.
Таблица 1.
Результаты исследования MILES у пожилых больных НМРЛ.
| Vn | G | Vn/G | |
|---|---|---|---|
| Число больных | 233 | 233 | 232 |
| Стадия IIIB (%) | 29 | 30 | 31 |
| Объективный эффект (%) | 18.5 | 17.3 | 20 |
| Медиана выживаемости (мес.) | 8.8 | 6.6 | 7.6 |
| 1-годичная выживаемость | 41% | 26% | 31% |
Vn = винорельбин;
G = гемцитабин.
Основной задачей MILES было сравнение эффективности комбинированной химиотерапии и монотерапии. Не было выявлено различий в общей эффективности и выживаемости больных между комбинацией винорельбин/гемцитабин и монотерапией каждым из этих препаратов. Как и следовало ожидать, комбинированный режим приводил к достоверно большей токсичности. Важно отметить, что в данном исследовании не ставилась задача сравнить эффективность монотерапии гемцитабином и винорельбином между собой.
Результаты исследований ELVIS и MILES твердо поддерживают необходимость монотерапии у больных НМРЛ старше 70 лет. Нельзя однозначно сказать, какой из этих двух препаратов предпочтительней. Важно также отметить, что больным старше 70 лет в хорошем общем состоянии можно рекомендовать проведение платино-содержащей химиотерапии, так как по общему мнению не возраст, а общее состояние должно быть основным критерием отбора больного на лечение.
ECOG в прошлом году на ASCO представила ретроспективный анализ 5592 пожилых больных НМРЛ, подвергшихся либо наблюдению, либо цисплатин-содержащей химиотерапии с включением этопозида или паклитаксела [3].
Только 17% из этих пациентов было старше 70 лет, что далеко не соответствует их реальной доле в общей популяции. Тем не менее, анализ включенных больных не показал существенных различий в качестве жизни, времени до прогрессирования и 1- и 2-летней выживаемости по сравнению с молодыми пациентами. Лишь частота лейкопений и психоневрологическая токсичность (по типу астений или субъективное ухудшение когнитивных функций) были выше у пожилых.
В этом году Dr. Karen Kelly [4] из SWOG провела аналогичный ретроспективный анализ двух рандомизированных исследований: SWOG 9308, показавшее превосходство комбинации цисплатин/винорельбин над монотерапией цисплатином; и SWOG 9509, где сравнивались комбинации винорельбин/цисплатин и паклитаксел/карбоплатин. Из 608 оцененных больных 117 (19%) имели возраст 70 лет и выше. Комбинация винорельбин/цисплатин переносилась больными хуже паклитаксела/карбоплатина, что отразилось в большей частоте прекращения терапии, особенно у пожилых больных. Кроме этого отмечена тенденция к худшей выживаемости пожилых пациентов, что не наблюдалось в анализе ECOG (табл. 2).
Таблица 2.
Выживаемость и токсичность в зависимости от возраста.
| Возаст 2 ) + карбоплатин (AUC = 6) у пожилых подтвердил и Dr. T. Hensing [5]. В его исследовании больные распространенным НМРЛ получали данный режим (4 курса или до прогрессирования) c интервалом в 3 недели. Из 230 включенных пациентов 67 (29%) было і 70 лет, что больше соответствует реальной картине. Возраст пациентов не отразился ни на токсичности, ни на их выживаемости. |
|---|
Химиотерапия распространенного НМРЛ.
За последнее десятилетие появились новые комбинации, улучшившие выживаемость по сравнению 80-ми годами. Большинство из них платино-содержащие и включают в себя такие новые препараты как доцетаксел, гемцитабин, иринотекан, паклитаксел и винорельбин.
Во всех режимах была достигнута схожая частота объективного эффекта и общая выживаемость. При этом наблюдалось умеренное увеличение безрецидивной выживаемости в группе цисплатин/гемцитабин. Результаты этих исследования обобщены в табл. 3.
Таблица 3.
Результаты некоторых последних рандомизированных исследований «двойных» режимов при НМРЛ.
| ECOG [6] | SWOG [7] | ECOG 1594 [8] | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Режим | C/Vp | C/T/G | C/T | Cb/T | C/Vn | C/T | C/G | C/D | Cb/T |
| Число пациентов | 200 | 201 | 198 | 207 | 201 | 292 | 288 | 293 | 290 |
| Объективный эффект | 12% | 28%* | 25%* | 27% | 27% | 21% | 21% | 17% | 15% |
| Продолж. жизни (мес.) | 7.6 | 10* | 9.5* | 8 | 8 | 7.8 | 8.8 | 7.4 | 8.2 |
| 1-летняя выживаемость | 32% | 40% | 37% | 36% | 36% | 31% | 36% | 31% | 35% |
C = цисплатин; Vp = этопозид; T = паклитаксел;
Cb = карбоплатин; Vn = винорельбин; G = гемцитабин;
D = доцетаксел.
В этом году исследователи представили 6 больших рандомизированных исследований по химиотерапии распространенного НМРЛ, в которых приняло участие свыше 3700 пациентов, главным образом, со стран Европы. Общая медиана выживаемости в них составила 9,1 мес., что сравнимо с 8 мес., достигнутыми в упомянутых выше исследованиях SWOG и ECOG.
На ASCО 2001 были доложены результаты крупного рандомизированного исследования из Италии [9], основные результаты которого представлены в табл. 4. Сравнивались три комбинации: гемцитабин (1250 мг/м 2 в 1 и 8 дни) + цисплатин (75 мг/м 2 в 1день) каждые 3 недели, винорельбин (25 мг/м 2 еженедельно 8 недель, далее 1 раз в две недели) + цисплатин (100 мг/м 2 каждые 4 недели) и паклитаксел (225 мг/м 2 в 1 день) + карбоплатин (AUC 6, в 1 день) каждые 3 недели. В группах с гемцитабином и винорельбином наблюдалось больше миелотоксичности, однако это не было клинически значимо. Dr. Scagliotti отметил, что тромбоцитопении в группе гемцитабин/цисплатин встречались реже при 3-недельной схеме, чем при классической 28-дневной. Около 36% больных после прогрессирования получали вторую линию терапии. Исследование показало одинаковую эффективность всех трех комбинаций как в частоте объективного ответа, так и выживаемости, что соответствует результатам более ранних исследований SWOG и ECOG.
Таблица 4.
Результаты исследования Итальянской Группы по изучению рака легкого.
| C/G | Cb/T | C/Vn | |
|---|---|---|---|
| Число больных | 205 | 201 | 201 |
| III стадия | 19% | 19% | 19% |
| Объективный ответ | 30% | 32% | 30% |
| Медиана выживаемости | 9.8 мес. | 9.9 мес. | 9.5 мес. |
| 1-годичная выживаемость | 37% | 43% | 37% |
C = цисплатин; G = гемцитабин;
Cb = карбоплатин; T = паклитаксел;
Vn = винорельбин.
Результаты другого рандомизированного исследования из Испании [10], схожим по дизайну с исследованиями из Италии и EORTC, обобщены в табл. 5. Сравнение комбинаций гемцитабин (1250 мг/м 2 в 1 и 8 дни) + цисплатин (100 мг/м 2 в 1 день) каждые 3 недели и гемцитабин (1000 мг/м 2 в 1 и 8 дни) + цисплатин (100 мг/м 2 в 1 день) + винорельбин (25 мг/м 2 в 1 и 8 дни) каждые 3 недели показало их одинаковую эффективность при большей токсичности последней. Второй основной задачей исследования было сравнение «безплатиновой» комбинации (гемцитабин/винорельбин с последующим режимом ифосфамид/винорельбин) со стандартной (гемцитабин/цисплатин). При одинаковых показателях выживаемости частота объективного ответа в экспериментальной группе была достоверно ниже.
Таблица 6.
Результаты исследования Испанской Группы по раку легкого 98-02.
| C/G | C/G/Vn | G/Vn с последующим I/Vn | |
|---|---|---|---|
| Число пациентов | 166 | 176 | 175 |
| III стадия | 22% | 22% | 19% |
| Объективный эффект | 43%* | 39% | 26% |
| Медиана выживаемости | 8.7 мес. | 7.9 мес. | 8.1 мес. |
| 1-годичная выживаемость | 35% | 31% | 35% |
Таблица 7.
Результаты исследования EORTC 8975.
| C/T | C/G | T/G | |
|---|---|---|---|
| Число пациентов | 159 | 160 | 161 |
| III стадия | 18% | 21% | 19% |
| Объективный эффект | 31% | 26% | 27% |
| Медиана выживаемости | 8.1 мес. | 8.8 мес. | 6.9 мес. |
| 1-годичная выживаемость | 36% | 33% | 26.5% |
C = цисплатин; T = паклитаксел; G = гемцитабин.
Таблица 8.
Результаты исследования ТАХ326.
| DC | DCb | VnC | |
|---|---|---|---|
| Число пациентов | 408 | 406 | 404 |
| III стадия | 34% | 32% | 31% |
| Медиана выживаемости | 10.9 мес. * | 9.1 мес. | 10 мес.* |
| 1-годичная выживаемость | 47% | 38% | 42% |
| 2-годичная выживаемость | 21% | 16% | 14% |
В группе доцетаксел/цисплатин было достигнуто незначительное, но статистически достоверное увеличение медианы выживаемости в сравнении с группой винорельбин/цисплатин. Обращает на себя внимание еще более худшая выживаемость больных, получавших доцетаксел/карбоплатин. К сожалению, дизайн исследования не позволяет непосредственно сравнить две группы с доцетакселом между собой, однако напрашивается вывод о превосходстве цисплатина над карбоплатином при НМРЛ. До настоящего времени практически не проводилось прямых сравнений цисплатин и карбоплатина при НМРЛ. В одном из исследований, доложенном на ECCO 10 [13], было показано достоверное преимущество выживаемости больных при комбинации паклитаксел/цисплатин в сравнении с режимом паклитаксел/карбоплатин.
Новые препараты в лечении НМРЛ.
Препараты, блокирующие эпидермальный фактор роста (ЭФР)
Ингибиторы матриксной металлопротеиназ (ММР) не улучшают эффективность стандартной химиотерапии при раке легкого.
ММР представляют собой группу ферментов, отвечающих за деградацию клеточного матрикса. ММР обнаружены во многих типах опухолей и ассоциируются с плохим прогнозом. Маримастат явился первым пероральным ингибитором ММР. Dr. Frances A. Shepherd сообщила результаты рандомизированного двойного слепого совместного исследования EORTC и NCIC-CTG, в котором приняло участие 555 больных мелкоклеточным раком легкого, достигших после химиотерапии полной или частичной регрессии опухоли [16]. После рандомизации пациенты получали либо маримастат 10 мг х 2 раза в день, либо плацебо. Не было зафиксировано различий в продолжительности как безрецидивной, так и общей выживаемости в обеих группах. Прием маримастата чаще сопровождался анорексией, тошнотой, летаргией и мышечными болями.
Адъювантная химиотерапия НМРЛ.
Во втором исследовании, проведенном Dr. Wolf [19], приняло участие 150 радикально прооперированных больных с поражением лимфоузлов средостения (N2). После рандомизации пациенты получали либо стандартную лучевую терапию (СОД 60Гр), либо 4 курса химиотерапии ифосфамид + цисплатин с последующей лучевой терапией. В группе химиолучевого лечения выживаемость оказалась даже хуже, однако различия не достигли статистической достоверности. Основные результаты этих двух исследований представлены в табл. 9.
Таблица 9.
Основные результаты двух рандомизированных исследований по адъювантной терапии при III стадии НМРЛ.
| Ichinose 18 | Wolf 19 | |||
|---|---|---|---|---|
| ХТ | Наблюдение | ХТ + ЛТ | ЛТ | |
| Продолжительность жизни | 35,5 мес. | 35,2 мес. | 26 мес. | 32 мес. |
| 3-летняя выживаемость | 49 % | 49% | 25% | 42% |
Полученные разочаровывающие результаты не являются неожиданными. Большинство исследований также не смогло выявить успеха от назначения адъювантной химиотерапии. Известно лишь два исследования с положительными результатами: одно из Японии, где адъювантно назначался препарат UFT [20] ; и второе из Финляндии, с применением комбинации циклофосфамид, доксорубицин и цисплатин при ранних стадиях [21].
Комбинированная терапия нерезектабельного распространенного НМРЛ.
В последние годы накапливается все больше данных, подтверждающих преимущество конкурентной химиолучевой терапии перед их последовательным применением. Так, в одном из них, сообщенном Dr. K. Furuse [22], конкурентный расщепленный курс лучевой терапии с химиотерапией митомицином, винбластином и цисплатином улучшил выживаемость в сравнении с их последовательным использованием (16,5 мес. и 13,3 мес., соответственно).
В прошлом году на ASCO Dr. Walter Curran [23] сообщил результаты рандомизированного исследования RTOG, в котором было показано увеличение продолжительности жизни при проведении одновременной химиолучевой терапии по сравнению с последовательным использованием двух методов лечения при одновременном возрастанием частоты эзофагитов.
Свыше 75% пациентов имели стадию IIIB. Токсичность, особенно эзофагиты, чаще наблюдались в группе В. При этом после двух лет наблюдения появилась тенденция к улучшению выживаемости в группе В, не достигшая, однако, статистической достоверности. Возможно, с увеличением срока наблюдения, различия станут достоверными. Основные результаты этого исследования представлены в табл. 10.
Таблица 10.
Результаты рандомизированного исследования по сравнению последовательной и одновременной химиолучевой терапии при НМРЛ.
| Группа A | Группа B | |
|---|---|---|
| Дисфагия | 6.1% | 20.4% |
| Эзофагиты | 6.1% | 28% |
| Тошнота/рвота | 20.2% | 20.4% |
| Время до прогрессирования | 9.6 мес. | 7.2 мес. |
| Продолжительность жизни | 13.9 мес. | 15.6 мес. |
| 1-годичная выживаемость | 57.7% | 57.3% |
| 2-годичная выживаемость | 24% | 36.4% |
Таблица 12.
Показатели выживаемости в исследованиях SWOG 9019 и 9504.
| Иссле- дование | Режим терапии | Медиана выжива- емости (мес.) | 1-годичная выжива- емость (%) | 2-годичная выжива- емость (%) | 3-летняя выжива- емость (%) |
|---|---|---|---|---|---|
| SWOG 9504 | PE/RT + D | 27 (18-43) | 78 (67-85) | 54 (43-64) | 40 (24-55) |
| SWOG 9019 | PE/RT + PE | 15 (10-22) | 58 (44-72) | 34 (21-47) | 17 (7-27) |
1. The Elderly Lung Cancer Vinorelbine Italian Study Group. Effects of vinorelbine on quality of life and survival of elderly patients with advanced non-small-cell lung cancer. J Natl Cancer Inst. 1999;91:66-72.
2. Gridelli F, Perrone F, Cigolari S, et al. The MILES (Multicenter Italian Lung Cancer Study) phase 3 trial: gemcitabine+vinorelbine vs. vinorelbine and vs. gemcitabine in elderly advanced NSCLC patients. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1230.
3. Langer C, Manola J, Bernardo P, Bonomi P, Kugler A, Johnson D. Advanced age alone does NOT compromise outcome in fit non-small cell lung cancer (NSCLC) patients (pts) receiving platinum (DDP)-based therapy (TX): implications of ECOG 5592. Program and abstracts of the 36th Annual Meeting of the American Society of Clinical Oncology; May 20-23, 2000; New Orleans, Louisiana. Abstract 1912.
4. Kelly K, Giarritta S, Hayes S, et al. Should older patients (pts) receive combination chemotherapy for advanced stage non-small cell lung cancer (NSCLC)? An analysis of Southwest Oncology Trials 9509 and 9308. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Fran-cisco, California. Abstract 1313.
5. Hensing TA, Socinski MA, Schell MJ, Lee J, Lee J. Age does not alter toxicity or survival for patients (pts) with stage IIIB/IV non-small cell lung cancer (NSCLC) treated with carboplatin (C) and paclitaxel (P). Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1382.
6. Bonomi P, Kim K, Fairclough D, et al. Comparison of survival and quality of life in advanced non-small-cell lung cancer patients treated with two dose levels of paclitaxel combined with cisplatin versus etoposide with cisplatin: results of an Eastern Cooperative Oncology Group trial. J Clin Oncol. 2000;18:623.
7. Kelly K, Crowley J, Bunn P, et al. A randomized phase III trial of paclitaxel plus carboplatin (PC) versus vinorelbine plus cisplatin (VC) in untreated advanced non-small cell lung cancer (NSCLC): a Southwest Oncology Group (SWOG) trial. Program and abstracts of the 35th Annual Meeting of the American Society of Clinical Oncology; May 15-18, 1999; Atlanta, Georgia. Abstract 1777.
8. Schiller J, Harrington D, Sandler A, et al. A randomized phase III trial of four chemo-therapy regimens in advanced non-small cell lung cancer (NSCLC). Program and abstracts of the 36th Annual Meeting of the American Society of Clinical Oncology; May 20-23, 2000; New Orleans, Louisiana. Abstract 2.
9. Scagliotti G, De Marinis F, Rinaldi M, et al. Phase III randomized trial comparing three platinum-based doublets in advanced non-small cell lung cancer. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1227.
10. Alberola V, Camps C, Provencia M, et al. Cisplatin/gemcitabine vs. cisplatin/gemcitabine/vinorelbine vs sequential doublets of gemcitabine/vinorelbine followed by ifosfamide/vinorelbine in advanced non-small cell lung cancer: results of a Spanish Lung Cancer Group phase III trial (GEPC/98-02). Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1229.
11. Van Meerbeeck J, Smit F, Lianes P, et al. A EORTC randomized phase III trial of three chemotherapy regimens in advanced non-small cell lung cancer. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1228.
12. Rodriguez J, Pawel J, Pluzanska A, et al. A multicenter, randomized phase III study of docetaxel+cisplatin and docetaxel+carboplatin vs. vinorelbine+cisplatin in chemotherapy naive patients with advanced and metastatic non-small cell lung cancer. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1252.
13. Gatzemeier U, Rosell R, Belticher D, et al. Randomized Pan-European trial comparing paclitaxel/carboplatin versus paclitaxel/cisplatin in advanced non-small cell lung cancer. Abstracts and Proceedings of ECCO 10. Sept 12-16, 1999; Vienna, Austria. Abstract 973.
14. Perez-Soler R, Chachoua A, Huberman M, et al. A phase II trial of the epidermal growth factor receptor (EGFR) tyrosine kinase inhibitor OSI-774 following platinum based chemotherapy in patients with advanced EGFR expressing non-small cell lung cancer. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1235.
15. Yuen A, Halsey J, Fisher G, et al. Phase I/II trial of ISIS 3521, an antisense inhibitor of PKC-alpha, with carboplatin and paclitaxel in non-small cell lung cancer. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1234.
16. Shepherd FA, Giaccone G, Debruyne C, et al. Randomized double-blind placebo-controlled trial of marimastat in patients with small cell lung cancer (SCLC) following response to first-line chemotherapy: and NCIC-CTG and EORTC study. Program and abstracts of the American Society of Clinical Oncology 37th Annual Meeting; May 12-15, 2001; San Francisco, California. Abstract 11.
17. Smylie M, Mercier R, Aboulafia D, et al. Phase III study of the matrix metalloprotease (MMP) inhibitor prinomastat in patients having advanced non-small cell lung cancer (NSCLC.) Program and abstracts of the American Society of Clinical Oncology 37th Annual Meeting; May 12-15, 2001; San Francisco, California. Abstract 1226.
18. Ichinose Y, Tada H, Koike T, et al. A randomized phase III trial of postoperative adjuvant chemotherapy in patients with completely resected stage IIIa-N2 non-small cell lung cancer: Japan Clinical Oncology Group (JCOG 9304) trial. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1241.
19. Wolf M, Muller H, Seifart U, et al. Randomized phase III trial of adjuvant radiotherapy vs. adjuvant chemotherapy followed by radiotherapy in patients with N2 positive non small cell lung cancer (NSCLC). Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1242.
20. Wada H, Hitomi S, Teramatsu T. Adjuvant chemotherapy after complete resection in non-small-cell lung cancer. West Japan Study Group for Lung Cancer Surgery. J Clin Oncol. 1996;14: 1048-1054.
21. Niiranen A, Niitamo-Korhonen S, Kouri M, Assendelft A, Mattson K, Pyrhonen S. Adjuvant chemotherapy after radical surgery for non-small-cell lung cancer: a randomized study. J Clin Oncol. 1992;10:1927-1932.
22. Furuse K, Fukuoka M, Kawahara M, et al. Phase III study of concurrent versus sequential thoracic radiotherapy in combination with mitomycin, vindesine, and cisplatin in unresectable stage III non-small-cell lung cancer. J Clin Oncol. 1999;17:2692-2699.
23. Curran WJ Jr, Scott C, Langer C, et al. Phase III comparison of sequential vs concurrent chemoradiation for patients (pts) with unresected stage III non-small cell lung cancer (NSCLC): initial report of Radiation Therapy Oncology Group (RTOG) 9410. Program and abstracts of the 36th Annual Meeting of the American Society of Clinical Oncology; May 20-23, 2000; New Orleans, Louisiana. Abstract 1891.
24. Pierre F, Maurice P, Gilles R, et al. A randomized phase III trial of sequential chemo-radiotherapy versus concurrent chemo-radiotherapy in locally advanced non small cell lung cancer (NSCLC) (GLOT-GFPC NPC 95-01 study). Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1246.
25. Gaspar L, Gandara D, Chansky K, et al. Consolidation docetaxel following concurrent chemoradiotherapy in pathologic stage IIIb non-small cell lung cancer (NSCLC) (SWOG 9504): patterns of failure and updated survival. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Fran-cisco, California. Abstract 1255.