диффузионное мрт что это
МРТ головного мозга с трактографией (МР трактография)
МР трактография может быть выполнена в рамках протокола МРТ исследования головного мозга только по назначению врача. Как самостоятельная услуга не выполняется.
Диффузионная МРТ
Диффузионная МРТ всего тела – разновидность ядерно-магнитной томографии, с помощью которой врач может детально изучить внутренние органы и структуры на клеточном уровне. Процедура не обеспечивает настолько высокой точности визуализации, как это дает прицельное исследование определенного участка тела, однако дает возможность обнаружить первичные и вторичные опухоли любой локализации. Диффузное МРТ обычно применяется в качестве дополнительной диагностической процедуры к традиционной магнитно-резонансной томографии. С его помощью врач может обнаружить самые незначительные изменения в исследуемом органе и поставить точный диагноз на ранних стадиях, когда прогнозы на успешное излечение максимально благоприятные.
Что такое диффузное МРТ
Диффузно-взвешенное МРТ предполагает использование определенных последовательностей магнитно-резонансной томографии, а также специального программного обеспечения, генерирующего изображение из поступающих данных, которые используют диффузию молекул воды для создания контрастного усиления в томографических изображениях.
Молекулы в живом организме находятся в беспрерывном движении, проникая сквозь мембраны клеток и обратно. Такой процесс перемещения и называется диффузией. Нормальный клеточный обмен молекулами воды имеет существенные отличия по сравнению с патологическим. При наличии любых изменения порядок диффузии нарушается. Клетки отдают воду медленнее, чем поглощают, в результате чего они увеличиваются в размерах и деформируются. Бывают и обратные ситуации – клетки отдают больше молекул воды, чем поглощают.
МРТ диффузия фиксирует показатели обмена молекулами воды в клетках различных тканей. врач-диагност сравнивает полученные результаты с нормой и на основании этих данных составляет протокол МРТ исследования, где фиксируются все нарушения и отклонения.
Что показывает МРТ-диффузия всего тела?
Чаще всего МРТ трактография применяется при острой ишемии головного мозга. МРТ диффузия головного мозга позволяет визуализировать ишемический некроз при инфаркте головного мозга. Изменение визуализируется как цитотоксический отек, проявляющийся в виде высокого сигнала МРТ-диффузии в течение нескольких минут после артериальной окклюзии.
Еще одна медицинская область применения МРТ-диффузии – онкология. Злокачественные новообразования в большинстве случаев являются высококлеточными. Они обеспечивают ограниченную диффузию воды, поэтому характеризуются относительно высокой интенсивностью сигнала МРТ. Такой вид ядерно-магнитной томографии часто используется для обнаружения, а также определения стадии опухолей. Процедура информативна при отслеживании реакции злокачественных клеток на лечение на протяжении определенного периода.
Другие области применения технологии:
Трактография спинного мозга назначается при наличии таких показаний:
Если на снимках томографии визуализируются участки, которые не соответствуют параметрам нормы, проводится повторное МРТ, с помощью которого врач сможет более летально изучить патологическую зону.
Диффузно тензорное МРТ – единственный неинвазивный метод, с помощью которого врач может прижизненно изучить микроструктуру белого вещества головного мозга, а также количественно оценить полученные данные. С помощью диффузно-тензорного МРТ диагностируются такие нейродегенеративные патологии:
Благодаря тензорной МРТ обнаруживаются изменения белого вещества головного мозга, которые не видны на изображениях традиционной магнитно-резонансной томографии.
Подготовка к диффузионной МРТ всего тела
Магнитно-резонансная диффузия головного мозга и других внутренних органов не требует специальной подготовки. За 1 – 2 дня до процедуры необходимо лишь отказаться от продуктов, способствующих обильному газообразованию. К таким относятся:
Также в этот период желательно воздержаться от употребления алкоголя. Специалисты центра «Патеро Клиник» рекомендуют проходить томографию натощак. Если на руках у пациента есть результаты ранее проведенных исследований, таких как УЗИ, рентгенография, желательно взять заключение с собой, чтобы врач-диагност смог сопоставить полученные данные.
Как проходит исследование
Перед диагностикой необходимо снять с себя все предметы, украшения, аксессуары, изготовленные из металла:
Если в организме пациента есть протез, необходимо взять с собой документы, в которых указана вся информация о материале изделия.
Этапы проведения процедуры:
Результаты диффузионной МРТ
В результате сканирования в режиме диффузии получается большое количество изображений в трех взаимноперпендикулярных проекциях. Специалист детально изучает готовые снимки, сравнивая полученные показатели с параметрами здоровых тканей.
В завершении расшифровки составляется протокол МРТ головного мозга или других исследуемых органов. Заключение и диск с фотографиями выдаются пациенту на руки. Далее необходимо показать протокол МРТ врачу, который дал направление на диагностику. Если пациент обратился в клинику по собственному желанию, врач-диагност озвучит предварительный диагноз и объяснит, что делать дальше.
Сравнение с альтернативными методами исследования
Самым приближенным методом, который по своей сути похож на диффузионное МРТ является позитронно-эмиссионная томография, предусматривающая введение радионуклидного вещества, которое концентрируется в тканях, пораженных злокачественным процессом. Однако при ПЭТ-КТ на пациента оказывается лучевая нагрузка, которая при МРТ полностью отсутствует.
По сравнению с ПЭТ-КТ у диффузионной МРТ есть ряд других преимуществ:
Стоимость диффузной МРТ
Со стоимостью диффузионной МРТ можно ознакомиться на сайте нашей клиники, где цены регулярно обновляются, поэтому всегда являются актуальными. Если вы нуждаетесь в индивидуальной консультации и желаете записаться на диагностику, можете позвонить по номеру +7 (495) 966-64-87 либо заполнить форму обратной связи. Наши менеджеры сразу перезвонят вам и ответят на все возникшие вопросы.
МР-диффузия
МР-диффузия: инструкция по применению.
Диффузия – это процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого вещества, и данный процесс приводит к самопроизвольному выравниванию концентрации веществ по всему занимаемому объему.
Получить данные МР-диффузии возможно на базе различных импульсных последовательностей:
Single shot EPI
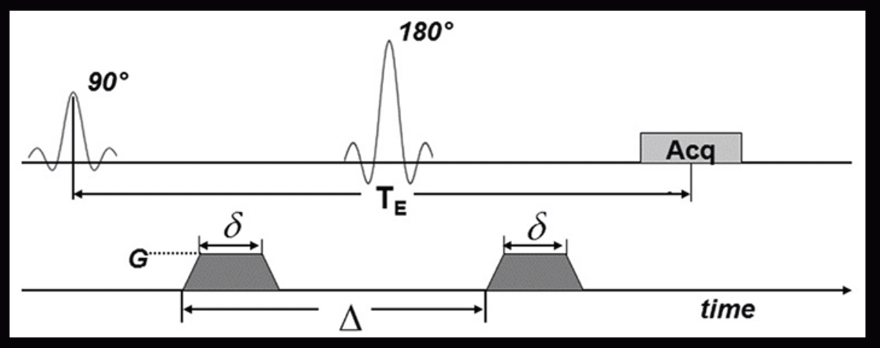
На графике заметно, что у данной импульсной последовательности 90 градусный импульс и 180 градусный импульс. У Single shot EPI TR=8000 мс, а TE=60 мс, то есть DWI изображение построено с Т2 контрастностью.
Отличие от Т2 изображений:
В нижней части графика видно, что при получении изображения накладываются два градиента. Данные градиенты и его показатели кодируют b-фактор, который в свою очередь определяет контраст диффузно-взвешенного изображения и зависит от таких показателей, как длительность градиентов, расстояние между данными градиентами и амплитудой данных градиентов.
Чем длиннее градиент, чем дольше они накладываются, чем больше амплитуда градиентов, чем больше расстояние между ними, тем больше b-фактор.
Контрастность ДВИ помимо Т2-эффекта определяется b-фактором.
Высокое значение b-фактора прямо пропорционально времени сбора данных.
Подавление сигнала от жировой ткани.
Для элиминации артефактов химического сдвига ДВИ всегда требует подавления сигнала от жировой ткани.
Если использовать ДВИ изображения с нулевым b-фактором, то есть не накладывать никаких градиентов, то в данном случае получится изображение с контрастностью, как у Т2 FS изображений.
По мере увеличения b-фактора от 0 до 700 увеличивается эффект диффузии. Интенсивность сигнала от органов с ограниченной диффузией на изображениях с низким b фактором будет низкая, а на изображениях b=600 сигнал от того же органа будет повышаться. Чем выше b-фактор, тем выше контраст изображения обусловлен диффузионным эффектом.
Слева представлены ДВИ с b=0, 100, 200, 500, 1000, 2000
Градиент, который идет первый до 180 градусного импульса помечает спины, а второй градиент после 180 градусного считывает.
Изображение с b=0 является аналогом Т2 изображения с подавлением жировой ткани.
Изображения с b=100. Вода не успевает покинуть пределы вокселя за данный период времени.
Изображения с b=500. Молекулы воды частично покинули воксель. В областях с ограниченной диффузией данное явление менее выраженное и протекает медленнее.
Изображения с b=1000.В зонах со свободной диффузией в вокселе не остается практически молекул воды, а в вокселе с ограниченной диффузией только часть молекул воды покинет.
Магнитно-резонансная томография с диффузионным тензором (DTI)
Тензор диффузии первоначально был предложен для использования при магнитно-резонансной томографии (МРТ, MRI) в работах Питера Бассера ( Peter Basser) в 1994 году. До DTI диффузионная МРТ развивалась из исследований в диффузионном ядерном магнитном резонансе. До введения модели тензора диффузии для измерения анизотропной диффузии необходимо было определить ориентацию аксонов в образце ткани, поэтому можно было сканировать только фиксированные образцы. Внедрение модели тензора диффузии впервые позволило получить вращательно-инвариантное описание формы диффузии воды. Инвариантность к вращению имеет здесь решающее значение, поскольку она позволила применить метод DTI к сложной анатомии волоконных путей в мозге человека, однако, тензор диффузии не в состоянии полностью описать пересечение волоконных трактов.
Тензор диффузии (DT) описывает диффузию молекул воды с использованием гауссовой модели. Технически он пропорционален ковариационной матрице трехмерного гауссова распределения, которая моделирует смещения молекул. DT представляет собой 3 × 3 симметричную положительно определенную матрицу, и эти свойства матрицы означают, что она имеет 3 ортогональных (взаимно перпендикулярных) собственных вектора и три положительных собственных значения. Основной собственный вектор тензора диффузии указывает на основное направление диффузии (направление самой быстрой диффузии). В анизотропных волокнистых тканях основной собственный вектор также определяет ось волоконного тракта ткани и, следовательно, три ортогональных собственных вектора можно рассматривать как локальную систему координат волокон. Для измерения диффузии с использованием МРТ градиенты магнитного поля используются для создания изображения, которое сенсибилизируется к диффузии в определенном направлении. Повторяя этот процесс диффузионного взвешивания в нескольких направлениях, можно оценить трехмерную диффузионную модель (тензор). В упрощенных выражениях диффузионная визуализация работает путем введения дополнительных градиентных импульсов, эффект которых «отменяет» для стационарных молекул воды и вызывает случайный сдвиг фазы для молекул, которые диффундируют. Из-за их случайной фазы сигнал от рассеивающих молекул теряется. Эта потеря сигнала создает более темные воксели (объемные пиксели). Это означает, что волокна белого вещества, параллельные направлению градиента, будут темными в диффузионно-взвешенном изображении для этого направления.
DTI обычно отображается путем уплотнения информации, содержащейся в тензоре, на одно число (скаляр) или на 4 числа (чтобы дать цвет R, G, B и значение яркости). Тензор диффузии можно также рассматривать с помощью глифов, представляющих собой небольшие трехмерные представления основного собственного вектора или целого тензора. Наконец, DTI часто просматривается путем оценки хода участков белого вещества через мозг через процесс, называемый трактографией.
Измеренные диффузионные эффекты усредняются по вокселю (трехмерный пиксель), что усложняет биофизическую интерпретацию тензора диффузии. Например, в научных исследованиях FA часто интерпретируется как «целостность белого вещества», однако многие факторы (например, гибель клеток, изменение миелинизации, увеличение внеклеточной или внутриклеточной воды и т. д.) могут вызывать изменения в FA. Чтобы дать представление о сложности человеческого мозга и размерах / временных масштабах эксперимента по диффузионной визуализации, перечисляет соответствующие количества, такие как количество нейронов в головном мозге (10 11 ) и расстояние, на котором вода диффундирует во время эксперимента по визуализации (1-15 мкм, расстояние, аналогичное диаметру аксона).
Значительная часть WM-вокселей в мозге содержит множественные пучки волокон, ориентированные в разных направлениях, где модель тензора диффузии не является надежной.
Новые диффузионные модели, сканирующие парадигмы и методы анализа постоянно разрабатываются для диффузионной МРТ. Диффузионное изображение с высоким угловым разрешением (HARDI) включает методы, которые получают данные диффузии с использованием более чем 6 направлений диффузии (например, 32 или выше). Эти методы обычно используют более высокое значение b, чем стандартное значение 1000 для DTI и / или несколько значений b (несколько «оболочек» данных). Предлагались модели диффузии, выходящие за пределы DTI, для извлечения важных биомаркеров, таких как компартментализация и диаметром аксона. Предложено расширить модели тензора более высокого ранга, чтобы расширить DTI. Было показано, что использование множественных пар диффузионных градиентов (двойной импульсной полевой диффузионной МРТ) повышает чувствительность к малым масштабам. Диффузионный анализ МРТ был полезен при внедрении новых методов трактографии, созданы многие типы атласов белого вещества, усовершенствованны методы количественной оценки результатов исследований и новые скалярные меры.
Диффузно-взвешенное изображение
Теоретические основы применения диффузионно-взвешенной последовательности.
Общеизвестно, что молекулы воды при температуре выше абсолютного нуля находятся в состоянии теплового (Броуновского) движения. В тканях человека диффузия молекул воды чаще всего не может осуществляться во всех возможных направлениях (изотропно) по причине наличия множества ограничивающих факторов, к которым относятся гидрофобные фосфолипиды клеточных мембран, внутриклеточные органеллы, клеточное ядро и прочие.
В основе клинического использования ДВИ лежит явление значимого ограничения скорости диффузии в опухолях, тканях в состоянии отека, воспаления. Причины ограничения диффузии могут быть различными.
В частности, цитотоксический отек головного мозга, в отличие от вазогенного, проявляется повышенным сигналом ДВИ, что объясняется различным патогенезом. В случае цитотоксического отека жидкость из межклеточного пространства переходит в клетку, вызывая увеличение ее объема, и приводит к более плотному контакту между клеточными мембранами, что представляется в виде ограниченного сигнала на карте ИКД. При вазогенном отеке, напротив, происходит переход плазмы из сосудистого русла в межклеточное пространство, не вызывая ограничения диффузии.
Ограничение диффузии в тканях опухоли объясняется высоким ядерно-цитоплазматическим соотношением и плотным расположением клеток с высокой плотностью гидрофобных мембран. Применение диффузионно-взвешенной последовательности позволяет выявить данные структуры как зоны повышения интенсивности сигнала.
Наиболее распространенным вариантом диффузионно-взвешенной последовательности является модификация спин-эхо Т2- взвешенного изображения (Т2-ВИ) с подавлением сигнала от жира и наличием двух дополнительных диффузионных градиентов. Сила, продолжительность и амплитуда диффузионного градиента определяются значением b-фактора (b value). Данный параметр задается исследователем и чаще всего находится в диапазоне от 0 с/мм2 до 1500 с/мм2. При значении b фактора, равном 0 с/мм2, будет получено изображение, практически неотличимое от «анатомического» Т2-ВИ с подавлением сигнала от жировой ткани, так как вклад диффузионного компонента в построении изображения будет отсутствовать. На основании ДВИ, полученных с использованием не менее 2-х b факторов, возможно построение карт измеряемого коэффициента диффузии (ИКД). Карты ИКД позволяют количественно оценить величину диффузии в тканях и служат отправной точкой в динамическом наблюдении ряда онкологических заболеваний.
На текущий момент на большинстве МР- томографов с индукцией поля 1,5 Тесла технически возможно выполнение МРТ всего тела от головы до середины бедер (аналогично стандарту выполнения большинства ПЭТ/КТ), включая Т1-ВИ, Т2-ВИ с подавлением сигнала от жировой ткани или STIR, а также ДВИ в течение 40- 50 минут, что вполне приемлемо в рутинной клинической практике.
Где возможно применение МРТ всего тела с протоколом ДВИ?
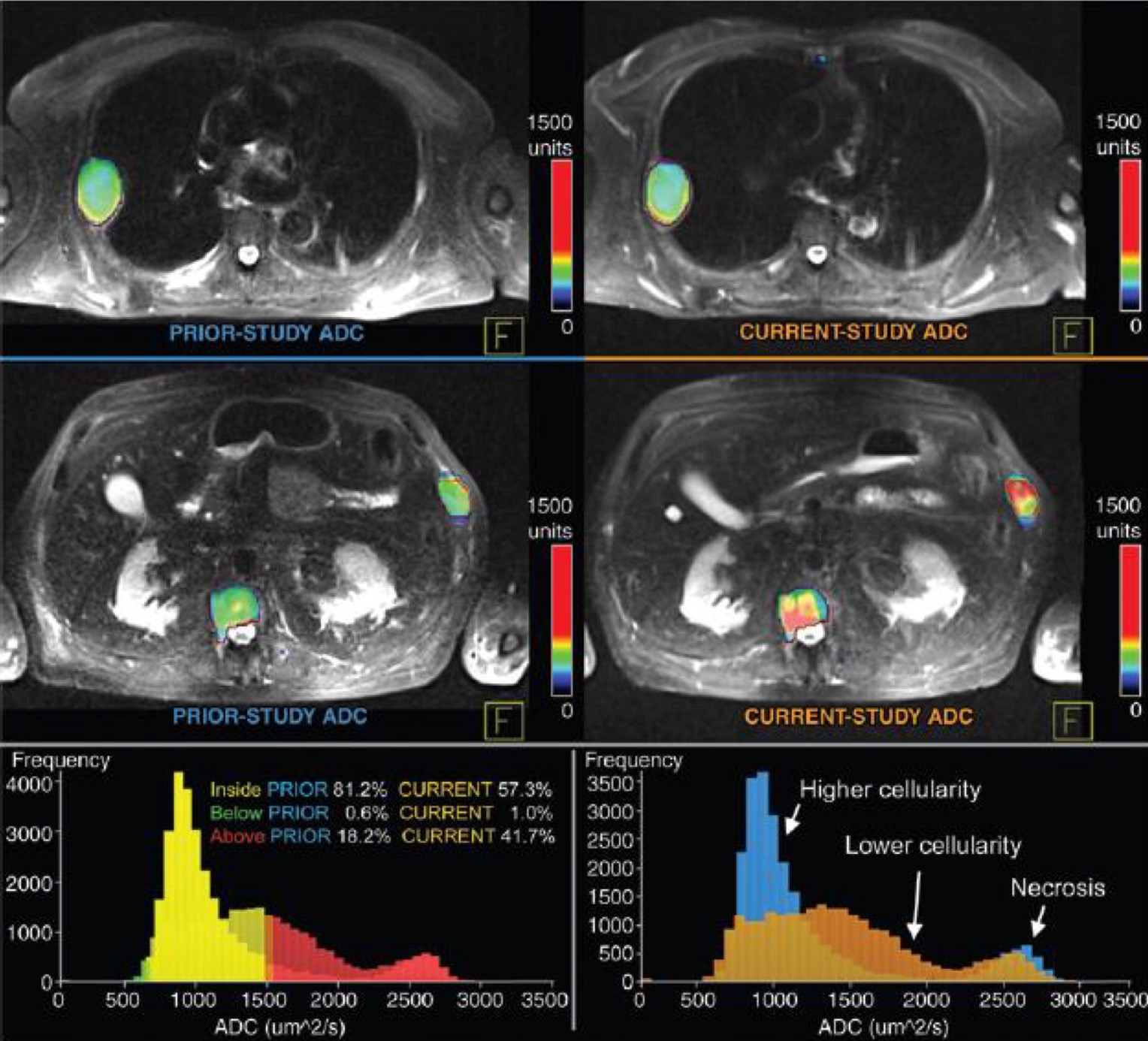
С точки зрения клинических перспектив, МРТ всего тела в первую очередь выступает в качестве дополнительного метода скрининга отдаленных метастазов. Высокие значения b фактора обеспечивают высокую интенсивность сигнала опухолевой ткани на фоне неизмененных тканей. Интенсивность сигнала на ДВИ и показатели ИКД зависят от особенностей строения клеток, в частности, ядерно-цитоплазматического соотношения, целостности клеточных мембран и прочих факторов, которые в том числе коррелируют со степенью злокачественности опухолей. Согласно данным Padhani et al., значения ИКД в опухоли могут быть использованы как прогностический фактор и служить одним из критериев подбора специфической терапии. Кроме того, как показывает ряд работ, динамика ИКД на фоне полихимиотерапии является достоверным количественным показателем ответа опухоли на лечение. Некоторые производители разрабатывают специализированное программное обеспечение для автоматического расчета объема опухолевой массы при миеломной болезни и оценки колебаний ИКД для динамического наблюдения таких пациентов (рис. 1). Описана возможность использования ДВИ всего тела для диагностики причины лихорадки неясного генеза, а также при поиске первичной опухоли на фоне выявленных метастазов.
Параметры получения изображения.
Основной целью при планировании ДВИ является достижение максимального соотношения «сигнал-шум», что достигается компромиссом между толщиной среза, относительно низким значением матрицы, полем обзора, минимальным значением TE и рядом других показателей. Одной из частых ошибок является приоритет высокого пространственного разрешения перед соотношением «сигнал-шум», что приводит к снижению контрастности патологических очагов и служит причиной разочарования в методике.
В исследованиях всего тела предпочтительным является использование только двух величин b факторов, так как при большем их количестве возрастает время сбора данных. В то же время, применение одного b фактора не рекомендовано, т.к. как говорилось выше, для расчета ИКД требуется минимум два b фактора. Рекомендуется ограничение минимального значения b фактора 50 с/мм2, при котором сохраняется «анатомичность» изображения, и вместе с тем подавляется перфузионный компонент, т.е. обнуляется сигнал от движущейся в сосудах крови. Это особенно актуально при выявлении мелких очаговых изменений паренхиматозных органов (в первую очередь, печени). Выбор максимального b фактора ограничен в первую очередь соотношением «сигнал-шум» и обычно составляет 750-1000 с/мм2).
Как правило, ДВИ не используется для исследования всего тела в качестве единственной последовательности исследования. В дополнение к ДВИ рекомендуется получение STIR или Т2-ВИ с жироподавлением в идентичной плоскости, для улучшения анатомической корреляции. Так как сбор данных обычно проводится в аксиальной плоскости, ряд авторов рекомендует дополнительно получать Т1-ВИ в сагиттальной плоскости, распланированной исключительно на позвоночный столб, для облегчения локализации очагов в осевом скелете.
Рис. 1 Пример полуавтоматической оценки опухолевой массы при миеломной болезни.
— ОСНОВЫ ИНТЕРПРЕТАЦИИ ДИФФУЗИОННО-ВЗВЕШЕННОЙ ТОМОГРАФИИ ВСЕГО ТЕЛА
Методика диффузионно-взвешенных магнитно-резонансных изображений у онкологических больных
1) Дорожная клиническая больница на ст. Новосибирск-главный ОАО «РЖД», Новосибирск, Россия
2) Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
3) Городская больница №40, Сестрорецк, Россия
Цель исследования: оценить возможности диффузионно-взвешенной магнитно-резонансной томографии всего тела у больных онокологического профиля.
Материалы и методы. На базе наших учреждений в период с сентября 2012 г. по март 2013 г. была разработана и опробована методика комплексной ДВ-МРТ всего тела у 120 онкологических пациентов. Исследование проводили на МР-системах с напряженностью магнитного поля 1,5Т (Magnetom Espree, Siemens); зона сканирования включала область от свода черепа до середины бедра.
Результаты. В обозначенный период было обследовано 120 пациентов, из которых у 117 имели место верифицированные первичные злокачественных опухоли вариабельной локализации как вне лечения (n=39), так и на фоне проводимого лечения (n=68). Большую часть пациентов составили больные с раком молочной железы (28%), колоректальным раком (27%) и раком желудка (15%). Для корреляции использовали результаты других методов исследования (сцинтиграфия, ПЭТ, КТ и/или МРТ отдельных зон с использованием стандартных протоколов), оперативного вмешательства, пункционной биопсии. Не все выявленные в ходе исследования очаги могут с уверенностью расцениваться как метастазы, поскольку не все очаги были морфологически верифицированы. В данной работе мы ставили перед собой цель сопоставить возможности традиционных на сегодняшний день методов визуализации (КТ, МРТ, сцинтиграфия, ПЭТ) и ДВ-МРТ в выявлении потенциальных метастатических изменений у онкологических пациентов. В результате ДВ-МРТ всего тела в сумме был выявлен 371 очаг, подозрительный на неоплазию, из них 206 (55,5%) составляли метастазы, о наличии которых было известно до исследования, 92 очага (25%) были выявлены впервые по результатам данного исследования и интерпретированы как метастатические. 73 очага (19,5%) интерпретированные как доброкачественные. К ложноположительным результатам относились очаговые изменения в легких (n=4, не обнаружены при КТ грудной клетки), к ложноотрицательным − остеосклеротические метастазы (n=1, обнаружены при ПЭТ-КТ) и метастаз в легком (n=1, обнаружен при КТ).
Выводы. В 27% наблюдений исследование ДВ-МРТ всего тела повлекло за собой смену тактики лечения пациента (отказ от хирургического в пользу химиотерапии, изменение объема планируемого оперативного вмешательства и др.). Первичный опыт применения диффузионно-взвешенной магнитно-резонансной томографии свидетельствует о том, что возможности ДВ-МРТ всего тела в выявлении очагов, подозрительных на метастатические, сопоставимы с традиционными методами визуализации (сцинтиграфия, ПЭТ, КТ, МРТ).
Ключевые слова: магнитно-резонансная диффузия всего тела, диффузионно-взвешенные изображения, магнитно-резонансная томография, метастазы, онкология.
В группе пациентов с опухолями, характеризующимися высоким риском метастазирования (рак молочной железы, предстательной железы, колоректальный рак и др.), скрининговые исследования всего тела являются необходимым этапом отбора для проведения оперативного лечения, а также одним из факторов, определяющих его тактику [1].
На сегодняшний день основным методом скрининга отдаленных и регионарных метастазов является позитронно-эмиссионная томография (ПЭТ) с 18-F-дезоксиглюкозой (FDG), однако ввиду низкой доступности данного исследования в нашей стране чаще для этой цели используют компьютерную томографию (КТ) грудной клетки, живота и таза [2].
Помимо аспекта доступности ПЭТ характеризуется такими ограничениями, как низкое анатомическое разрешение (что частично преодолено в совмещенных ПЭТ/КТ и ПЭТ/МРТ сканерах) и интенсивное накопление метаболита не только в опухолевой ткани, но также в зонах воспаления и грануляционной ткани, что служит источником ложно-положительных результатов [3]. Среди ограничений КТ в качестве метода М-стадирования злокачественных опухолей необходимо отметить низкую чувствительность к костным метастазам, относительно низкие показатели в дифференциальной диагностике изменений тазовых органов и мелких образований печени [3].
Альтернативой перечисленным методам исследования является магнитно-резонансная томография (МРТ) всего тела с включением в протокол исследования магнитно-резонансной-диффузии (МР-диффузии). Важными преимуществами диффузионно-взвешенных изображений (ДВИ) всего тела является отсутствие ионизирующего излучения и необходимости применения радиоизотопов. Исследование не занимает много времени (30-50 минут в зависимости от используемого протокола) и является относительно простым в техническом исполнении, что позволяет легко применять его в рутинной практике.
При интерпретации ДВИ необходимо помнить, что за счет особенностей гистологического строения, связанных с высокой клеточной плотностью, ряд органов и тканей характеризуется в норме гиперинтенсивным сигналом на изображениях с высоким фактором взвешенности (головной и спинной мозг, надпочечники, лимфоидная ткань − лимфатические узлы, миндалины, селезенка) [4,5].
ДВИ, как и ПЭТ, характеризуется достаточно низким анатомическим разрешением. Компенсировать это позволяет использование Т2-взвешеных изображений или STIR последовательностей. Комбинированный анализ ДВИ и Т2(STIR) дает возможность не только оптимизировать локализацию выявляемых очагов, но также избежать ошибок интерпретации и повысить специфичность исследования, что наглядно продемонстрировано в ряде исследований [4,5].
Первые публикации о применении ДВИ тела в онкологии относятся к 2004 г. С тех пор данная методика находит все новые точки приложения и показывает свою эффективность даже в прямом сопоставлении с ПЭТ и ПЭТ/КТ. На данный момент имеется достаточное количество публикаций, не только доказывающих эффективность ДВ-МРТ тела, но и впрямую сопоставляющих ДВ-МР тела и ПЭТ. Так, Yoshiharu Ohno и соавт. (2008) в своей работе показали, что точность МР-диффузии всего тела в сочетании с МРТ всего тела в выявлении метастазов сопоставима с показателями ПЭТ (87,7% против 88,2%), чувствительность МР-диффузии всего тела даже выше, чем показатели ПЭТ (70,0% и 62,5%), а по специфичности методика приближается к ПЭТ (92,0% против 94,5%) [6].
Материалы и методы
В обозначенный период было выполнено исследование 120 пациентов (возраст от 38 до 84 лет), которых условно можно разделить на 3 группы:
Распределение пациентов в зависимости от локализации первичного опухолевого процесса представлено на рисунке 1. В первой группе у 21 из 39 человек были выявлены отдаленные метастазы и/или нерегионарная лимфаденопатия, о наличии которых не было известно до выполнения исследования, что в ряде наблюдений послужило причиной отмены запланированного хирургического лечения.
Рис. 1. Распределение пациентов в зависимости от локализации первичной опухоли.
Во второй группе у 27 из 68 человек был выявлен рецидив или прогрессирование заболевания, в том числе появление новых очагов метастазирования в ранее непораженном органе (печень, тазовая и абдоминальная брюшина, кости, головной мозг и др.). У 9 из 68 пациентов был пересмотрен характер изменений, ранее трактовавшихся как метастатические. В результате исследования были выявлены простые кисты, очаги фокальной нодулярной гиперплазии или гемангиомы печени, абсцессы вариабельной локализации и др.
В третьей группе у 4 пациентов были выявлены злокачественные опухоли, в том числе с отдаленными метастазами, у 3 причиной лимфаденопатии послужили воспалительные изменения (тазовые и абдоминальные абсцессы и др.), у 5 предполагаемые метастазы были трактованы как доброкачественные изменения с последующим подтверждением альтернативными методами исследования (КТ, МРТ с использованием традиционного протокола). У одного больного был заподозрен лимфопролиферативный процесс, и пациент в настоящее время проходит обследование в гематологическом стационаре.
В результате исследования в сумме был выявлен 371 очаг, подозрительный на неоплазию, из них 206 (55,5%) составляли метастазы, о наличии которых было известно до исследования, 92 очага (25%) были выявлены впервые по результатам МР-диффузии всего тела и интерпретированы как метастатические, в 73 очагах (19,5%) – злокачественность процесса была снята (рис. 2). В 27% наблюдений ДВИ тела повлекло за собой смену тактики ведения пациента (отказ от хирургического лечения в пользу химиотерапии, изменение объема планируемого вмешательства и др.).
Рис. 2. МР-томограммы пациентки с аденокарциномой толстой кишки и метастазами в позвонках грудного и поясничного отделов позвоночника (стрелки) с распространением в эпидуральное пространство. MIP реформат ДВИ тела во фронтальной плоскости (а); ДВИ в аксиальной плоскости (b-фактор 900 с/мм 2 ) (б, в); STIR в аксиальной (г) и сагиттальной (д) плоскостях.
Отдельного внимания требует высокая чувствительность данной методики к выявлению метастатического поражения костей даже на фоне реконверсии костного мозга, в том числе на этапе до деструкции костных трабекул, что определяет преимущество ДВИ перед КТ (рис. 3).
Рис. 3. МР-томограммы пациентки с раком левой молочной железы. Состояние после хирургического лечения и химиотерапии: рецидив в рубце, метастазы в аксиллярных лимфатических узлах и печени (стрелки). MIP реформат ДВИ тела во фронтальной плоскости (а, б); ДВИ в аксиальной плоскости (b-фактор 900 с/мм 2 ) (в, г, д).
Одним из потенциальных приложений МР-диффузии всего тела представляется скрининг вторичного поражения костей при опухолях с высоким риском такого метастазирования (рак молочной и предстательной железы), а также оценка эффективности проводимой терапии при метастазах в костях.
Основным источником как ложно-положительных, так и ложно-отрицательных результатов в исследованной нами группе пациентов являлись небольшие очаги в легочной паренхиме, в особенности прикорневой локализации, так как данная область является сложной для МР-визуализации по причине пульсационных артефактов от крупных сосудов, и выявляемые изменения требуют дополнительного проведения КТ.
Опыт применения ДВ-МРТ всего тела на базе наших учреждений показал, что данная методика высокоинформативна в выявлении новообразований и их дифференциальной диагностике; у каждого четвертого пациента (27%), прошедшего исследование, полученные результаты оказали существенное влияние на тактику лечения.
Несмотря на большое количество исследований, посвященных ДВИ всего тела, в доступной литературе пока нет единой точки зрения относительно места данной методики в алгоритме обследования онкологических пациентов. На основании первичного опыта внедрения данной методики в рутинную практику нам представляется обоснованным ее использование для М-стадирования опухолей с высоким риском метастазирования вне возможности применения ПЭТ, в особенности при опухолях с высоким риском вторичного поражения костей. Отдельное место данная методика может найти в исследовании онкологических пациентов, у которых необходимо избежать лучевой нагрузки (в том числе у детей), а также у пациентов с противопоказаниями к введению йод-содержащих контрастных препаратов (непереносимость йода, почечная недостаточность и др.).
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.