динамико и динамико лонг в чем разница
Динамико Лонг (Dynamico Long) инструкция по применению
Владелец регистрационного удостоверения:
Контакты для обращений:
Лекарственные формы
Форма выпуска, упаковка и состав препарата Динамико Лонг
Таблетки, покрытые пленочной оболочкой от светло-желтого до желтого с коричневатым оттенком цвета, круглые, двояковыпуклые, с гравировкой «2.5» на одной из сторон.
| 1 таб. | |
| тадалафил | 2.5 мг |
Таблетки, покрытые пленочной оболочкой от светло-желтого до желтого с коричневатым оттенком цвета, овальные, двояковыпуклые, с гравировкой «5» на одной из сторон.
| 1 таб. | |
| тадалафил | 5 мг |
Таблетки, покрытые пленочной оболочкой от светло-желтого до желтого с коричневатым оттенком цвета, овальные, двояковыпуклые, с риской и гравировкой «1» слева от риски и «0» справа от риски на одной из сторон.
| 1 таб. | |
| тадалафил | 10 мг |
Таблетки, покрытые пленочной оболочкой от светло-желтого до желтого с коричневатым оттенком цвета, овальные, двояковыпуклые, с риской и гравировкой «2» слева от риски и «0» справа от риски на одной из сторон.
| 1 таб. | |
| тадалафил | 20 мг |
Фармакологическое действие
Тадалафил является обратимым селективным ингибитором специфической фосфодиэстеразы 5 типа (ФДЭ5) циклического гуанозинмонофосфата (цГМФ). Когда сексуальное возбуждение вызывает местное высвобождение оксида азота, ингибирование ФДЭ5 тадалафилом ведет к повышению концентрации цГМФ в пещеристом теле полового члена. Следствием этого является расслабление гладких мышц артерий и приток крови к тканям полового члена, что и вызывает эрекцию. Тадалафил не оказывает эффекта в отсутствии сексуального возбуждения.
Исследования in vitro показали, что тадалафил является селективным ингибитором ФДЭ5. ФДЭ5 является ферментом, обнаруженным в гладких мышцах пещеристого тела, гладких мышцах сосудов внутренних органов, скелетных мышцах, тромбоцитах, почках, легких и мозжечке. Действие тадалафила более выражено в отношении ФДЭ5, чем в отношении других фосфодиэстераз. Тадалафил в 10 000 раз активнее блокирует ФДЭ5, чем ФДЭ1, ФДЭ2, ФДЭ4 и ФДЭ7, которые обнаруживаются в сердце, головном мозге, кровеносных сосудах, печени, лейкоцитах, скелетных мышцах и в других органах. Тадалафил в 10 000 раз активнее блокирует ФДЭ5, чем ФДЭ3, который обнаруживается в сердце и кровеносных сосудах. Эта селективность в отношении ФДЭ5 по сравнению с ФДЭ3 имеет важное значение, поскольку ФДЭ3 является ферментом, принимающим участие в сокращении сердечной мышцы. Кроме того, тадалафил примерно в 700 раз активнее блокирует ФДЭ5, чем фермент ФДЭ6, который обнаруживается в сетчатке глаза и отвечает за фотопередачу. Тадалафил в 9000 раз активнее блокирует ФДЭ5, чем ферменты ФДЭ8, ФДЭ9 и ФДЭ10, и в 14 раз активнее блокирует ФДЭ5, чем ФДЭ11. Распределение в тканях и физиологические эффекты ингибирования ФДЭ8 и ФДЭ11 до настоящего времени не изучены.
Тадалафил улучшает эрекцию и повышает возможность проведения успешного полового акта.
Тадалафил у здоровых добровольцев не вызывает достоверного изменения систолического и диастолического АД в сравнении с плацебо в положении лежа (среднее максимальное снижение составляет 1.6/0.8 мм рт.ст. соответственно) и в положении стоя (среднее максимальное снижение составляет 0.2/4.6 мм рт.ст. соответственно). Тадалафил не вызывает достоверного изменения ЧСС.
Тадалафил не вызывает изменений распознавания цветов (голубой/зеленый), что объясняется низким сродством его к ФДЭ6. Кроме того, не наблюдается влияния тадалафила на остроту зрения, электроретинограмму, внутриглазное давление и размер зрачка.
С целью оценки влияния ежедневного приема тадалафила на сперматогенез было проведено несколько исследований. Ни в одном из исследований не наблюдалось нежелательного влияния на морфологию сперматозоидов и их подвижность. В одном из исследований было выявлено снижение средней концентрации сперматозоидов по сравнению с плацебо. Снижение концентрации сперматозоидов было связано с более высокой частотой эякуляции. Кроме того, не наблюдалось нежелательного влияния на среднюю концентрацию половых гормонов, тестостерона, ЛГ и ФСГ при приеме тадалафила по сравнению с плацебо. Эффективность и безопасность тадалафила (в дозах 2.5 мг, 5 мг) изучалась в ходе клинических исследований. Было отмечено улучшение эрекции у пациентов с эректильной дисфункцией всех степеней тяжести при приеме тадалафила 1 раз/сут. В исследованиях первичной эффективности применения 5 мг тадалафила, 62% и 69% попыток полового акта были успешными по сравнению с 34% и 39% пациентов, принимавших плацебо. Прием тадалафила в дозе 5 мг значительно улучшал эректильную функцию в течение 24 ч между дозами.
Механизм действия у пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ)
Ингибирование ФДЭ5 тадалафилом, приводящее к повышению концентрации цГМФ в пещеристом теле полового члена, также наблюдается в гладкой мускулатуре предстательной железы, мочевого пузыря и сосудах, которые их кровоснабжают. Расслабление гладких мышц сосудов приводит к увеличению перфузии крови в этих органах, и, как следствие, к снижению выраженности симптомов ДГПЖ. Релаксация гладкой мускулатуры предстательной железы и мочевого пузыря может дополнительно усиливать сосудистые эффекты.
Фармакокинетика
После приема внутрь тадалафил быстро всасывается. Средняя С max в плазме крови достигается в среднем через 2 ч после приема внутрь. Скорость и степень всасывания тадалафила не зависят от времени приема пищи, поэтому препарат ДИНАМИКО ЛОНГ можно применять вне зависимости от приема пищи. Время приема (утром или вечером) не оказывало клинически значимого влияния на скорость и степень всасывания.
Фармакокинетика тадалафила у здоровых добровольцев линейна в отношении времени и дозы. В диапазоне доз от 2.5 до 20 мг AUC увеличивается пропорционально дозе. C ss в плазме крови достигается в течение 5 дней при приеме препарата 1 раз/сут.
Фармакокинетика тадалафила у пациентов с нарушением эрекции аналогична фармакокинетике препарата у пациентов без нарушения эрекции.
Средний V d составляет около 63 л, что указывает на то, что тадалафил распределяется в тканях организма. В терапевтических концентрациях 94% тадалафила в плазме крови связывается с белками. Связывание с белками не изменяется при нарушенной функции почек.
У здоровых добровольцев менее 0.0005% введенной дозы обнаруживается в сперме.
Тадалафил в основном метаболизируется с участием изофермента CYP3A4 цитохрома Р450. Основным циркулирующим метаболитом является метилкатехолглюкуронид. Этот метаболит, по крайней мере, в 13 000 раз менее активен в отношении ФДЭ5, чем тадалафил. Следовательно, концентрация этого метаболита не является клинически значимой.
Фармакокинетика у особых групп пациентов
Здоровые добровольцы в возрасте 65 лет и старше имели более низкий клиренс тадалафила при приеме внутрь, что выражалось в увеличении AUC на 25% по сравнению со здоровыми добровольцами в возрасте от 19 до 45 лет. Это различие не является клинически значимым и не требует подбора дозы.
У пациентов с почечной недостаточностью легкой степени тяжести (КК от 51 до 80 мл/мин) и умеренной степени тяжести (КК от 31 до 50 мл/мин), а также у пациентов с терминальной стадией почечной недостаточности, находящихся на гемодиализе, экспозиция тадалафила (AUC) приблизительно удваивалась. У пациентов, находящихся на гемодиализе, С max была на 41% выше по сравнению со здоровыми добровольцами. Выведение тадалафила с помощью гемодиализа является незначительным.
Фармакокинетика тадалафила у пациентов с легкой и умеренной степенью печеночной недостаточности (класс А и В по классификации Чайлд-Пью) сравнима с таковой у здоровых добровольцев. В отношении пациентов с тяжелой печеночной недостаточностью (класс С по классификации Чайлд-Пью) данных недостаточно. При назначении препарата ДИНАМИКО ЛОНГ пациентам с тяжелой печеночной недостаточностью необходимо предварительно провести оценку риска и пользы применения препарата.
У пациентов с сахарным диабетом на фоне применения тадалафила AUC была меньше примерно на 19% по сравнению со здоровыми добровольцами. Это различие не требует подбора дозы.
Динамико и динамико лонг в чем разница
А.А. Камалов (1, 2), Л.Г. Спивак (3), Д.А. Охоботов (1, 2)
1 Медицинский научно-образовательный центр МГУ им. М.В. Ломоносова, Москва; 2 Кафедра урологии и андрологии факультета фундаментальной медицины МГУ, Москва; 3 Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет), Москва
Введение
Эректильная дисфункция (ЭД) определяется как неспособность достигать и/или поддерживать эрекцию, достаточную для сексуальной активности. По разным оценкам, распространенность ЭД составляет от 16,2–20,7 до 31% [4, 5], при этом риск ее развития увеличивается с возрастом: чем старше пациент, тем больше шансов выявить у него тяжелую степень нарушений из-за наличия хронических васкулогенных и нейрогенных нарушений, а также возрастных гормональных, психогенных или смешанных причин, в т.ч. индуцированных постоянным приемом лекарственных средств [6]. ЭД негативно влияет на качество жизни, самооценку, взаимоотношения с сексуальным партнером [7, 8], может сопровождаться депрессией, хроническим стрессом, синдромом эмоционального выгорания [9].
Пациенты с ЭД часто требуют назначения терапии ингибиторами фосфодиэстеразы-5 типа (ФДЭ-5) на протяжении длительного времени. Учитывая полиэтиологичную природу ЭД, наличие психосоматического компонента и ряда других аспектов, появление новых препаратов для ее лечения заслуживает особого внимания. Необходимость запивать таблетку водой, проблемы, обусловленные продолжительностью действия и профилем безопасности препаратов, определяют поиск не только новых лекарственных средств для лечения ЭД, но и лекарственных форм, позволяющих маскировать эффект приема препарата, тем самым повышая качество жизни пациентов. На сегодняшний день ингибиторы ФДЭ-5 производятся в виде оральных диспергируемых таблеток, пленок, диспергируемых в полости рта, назальных спреев, дезодорантов и в некоторых других формах. Предполагается, что чем меньше качество интимной жизни пациента зависит от факта приема таблетки, тем выше возможный комплаенс пациента назначенной терапии и, соответственно, результат лечения.
С момента появления на российском рынке препаратов силденафила, т.е. в течение почти 20 лет, накоплен достаточный опыт его использования пациентами с ЭД. Препарат оказывает известный, прогнозируемый и управляемый клинический эффект, а также ряд хорошо изученных побочных эффектов. Клиническая эффективность и безопасность силденафила подтверждены значительным количеством многоцентровых контролируемых клинических исследований [10, 11], причем его эффективность показана в различных возрастных популяциях [12], а также на фоне лечения хронических заболеваний, провоцирующих развитие ЭД, например сахарного диабета [13].
Использование лекарственной формы в виде пленок заслуживает отдельного внимания, т.к. препарат растворяется в полости рта и представляет собой свободное основание силденафила, которое не имеет горького вкуса в отличие от его цитрата – действующего вещества таблетированных форм [14]. В более ранних исследованиях была показана биоэквивалентность препаратов силденафила в виде пленок таблетированной форме. Результаты этих исследований показали их сходную биодоступность [1, 2]. Поскольку фармакодинамическая кривая у таблетированной и оральной диспергируемой форм практически не отличаются, можно предположить, что количество транзитных потерь практически будет у них идентичным, причем для пленок не требуется дополнительного использования жидкости для попадания лекарственного препарата в организм.
Таким образом, Динамико Форвард (силденафил в виде пленок, диспергируемых в полости рта) является альтернативным препаратом по отношению к таблетированным формам силденафила. Динамико Форвард (Тева) зарегистрирован в ряде стран, в т.ч. и в Российской Федерации (РФ), для лечения ЭД, при этом данных в отношении его сравнительной с таблетированными препаратами терапевтической эффективности в российской популяции до настоящего момента получено не было, что и послужило причиной проведения нашего исследования.
Целью данного открытого многоцентрового рандомизированного исследования стала оценка эффективности и безопасности препарата Динамико Форвард в виде пленок, диспергируемых в полости рта, по сравнению с препаратами Виагра и Динамико в виде таблеток, покрытых пленочной оболочкой, при лечении пациентов с ЭД.
В качестве первичных конечных точек проведена оценка доли пациентов, у которых к концу лечения (12-я неделя) показатель индекса МИЭФ в первом домене составил ≥26 баллов или было отмечено увеличение этого показателя по сравнению с аналогичным показателем на визите скрининга на ≥50%.
Материал и методы
Дизайн исследования
В исследование были включены 120 амбулаторных пациентов мужского пола с ЭД в возрасте от 20 до 70 лет, из которых 114 завершили исследование в соответствии с протоколом. Пациенты были рандомизированы в 3 группы по 40 человек. Пациенты первой группы получали Динамико Форвард (силденафил, пленки, диспергируемые в полости рта, 100 мг, Тева), второй – Виагру (силденафил, таблетки, покрытые пленочной оболочкой, 100 мг, Пфайзер), третьей – Динамико (силденафил, таблетки, покрытые пленочной оболочкой, 100 мг, Тева) в режиме по требованию, 1 раз в сутки, рекомендуемая частота приема – 2–3 раза в неделю на протяжении 12 недель с последующим динамическим наблюдением за остаточными явлениями после приема препаратов в течение 2 недель. Пациентам 1-й группы было рекомендовано помещение препарата на язык до полного растворения с последующим проглатыванием, у пациентов остальных групп таблетированные препараты принимались стандартно. Исследование проведено в 6 клинических центрах РФ.
Для оценки клинической эффективности препаратов использовалось физикальное обследование, осмотр уролога; собирался сексуальный анамнез (в виде заполнения Опросника о качестве сексуальной жизни [ОКСЖ-М] и анкеты МИЭФ). В качестве параметров безопасности терапии оценивались жизненно важные показатели, лабораторные и инструментальные показатели, а также частота и тяжесть нежелательных явлений (НЯ), в т. ч. серьезных (СНЯ).
Сбор данных о пациентах на каждый из визитов
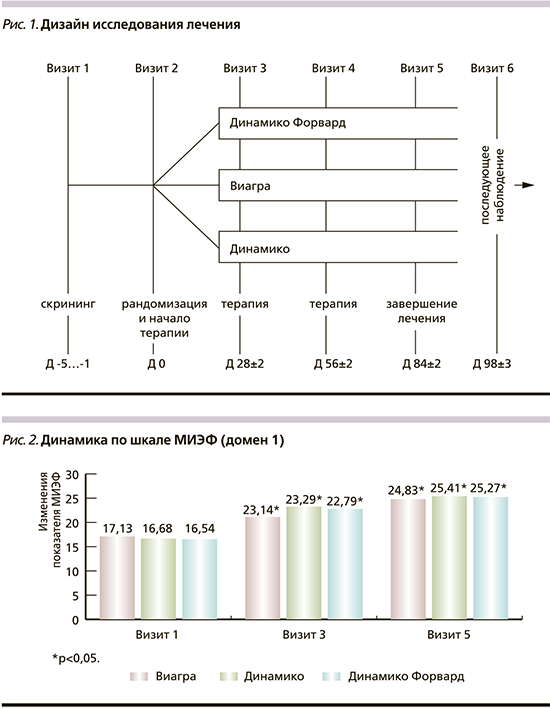
Исследование состояло из 3 этапов: периода скрининга, периода лечения и периода последующего наблюдения. За это время пациенты выполнили 6 визитов, период лечения составил 12 недель, период последующего наблюдения – 14 дней, максимальная продолжительность исследования – 15 недель (рис. 1).
После подписания информированного согласия проведены скрининговые мероприятия и оценка критериев включения, которыми являлись наличие документированного диагноза ЭД, поставленного не менее чем за 3 месяца до скрининга, и оценка в домене «эректильная функция» опросника МИЭФ от 11 до 25 баллов включительно (из 30 возможных) на момент скрининга. В рамках скрининговых мероприятий также проводились физикальный осмотр пациента, осмотр уролога, собирался сексуальный анамнез. После рандомизации пациентам назначалась соответствующая терапия ЭД.
С целью оценки безопасности терапии на визитах осуществлялся общий и биохимический анализы крови, общий анализ мочи, а также проводилось ЭКГ-исследование, регистрировалась сопутствующая терапия, оценивалась приверженность лечению, проводился учет исследуемых препаратов. На визитах 3 и 5 пациенты дополнительно заполняли опросники МИЭФ и ОКСЖ-М. Визит 6 проводился для контроля состояния пациентов и оценки безопасности терапии, после чего исследование для пациента считалось завершенным.
Статистика
Уровни статистической значимости различий и доверительные интервалы в исследовании рассчитывались как двусторонние с уровнем значимости 0,025 для доверительных интервалов соотношения терапевтического эффекта и 0,05 для остальных сравнений (если не указано дополнительно).
Этическая экспертиза
Исследование (номер протокола CS-DYN01-13) проведено с соблюдением принципов, заложенных в Хельсинкской декларации Всемирной медицинской ассоциации (1964 г. с последующими дополнениями), в соответствии с требованиями ГОСТ Р 52379–2005 «Надлежащая клиническая практика», правилами ICH GCP и действующими нормативными требованиями. Исследование было одобрено Советом по этике при Министерстве здравоохранения РФ.
Результаты
Исходные характеристики пациентов в трех группах значимо не различались (табл. 1).
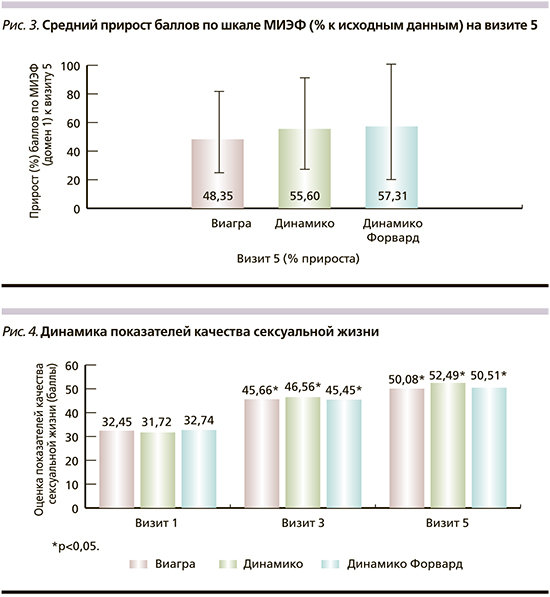
Показатели индекса МИЭФ на момент включения в исследование в группе Виагры составили 17,13±2,88, Динамико – 16,68±2,75 и Динамико Форвард – 16,54±3,26. К моменту окончания исследования частота «положительных» ответов на терапию в исследуемых группах составила 55% (95% доверительный интервал [ДИ] – 39,82–69,30) в группе Виагры, 75% (95% ДИ – 62,30–85,54) в группе Динамико и 70% (95% ДИ – 54,47–82,03) в группе Динамико Форвард без достоверных различий между группами (p>0,05).
При сопоставлении эффективности Динамико Форвард и Виагры статистическая гипотеза «неменьшей эффективности» Динамико Форвард была подтверждена. При сопоставлении эффективности Динамико Форвард и Динамико были достигнуты сходные показатели клинической эффективности, однако вследствие недостаточной выборки пациентов опровергнуть нулевую гипотезу не удалось.
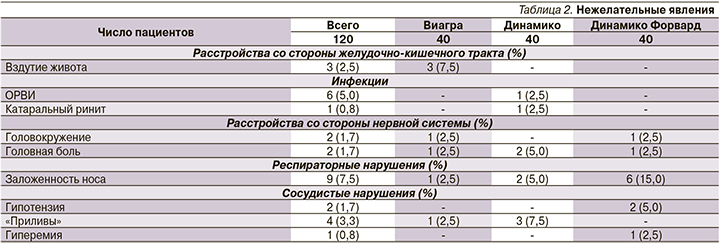
На рис. 2 показана динамика показателей по шкале МИЭФ. Статистически значимое увеличение этого показателя по сравнению со скрининговым было зафиксировано уже на визите 3 и сохранялось на визите 5 во всех группах пациентов. На рис. 3 представлен средний прирост баллов МИЭФ по сравнению с исходными показателями.
Динамика вторичных критериев эффективности также не имела достоверных различий между группами. Статистически значимый рост показателей определялся во всех трех группах на визите 3 (во всех доменах) и сохранялся до конца исследования.
Рост показателей качества сексуальной жизни также фиксировался на визите 3 и сохранялся до окончания исследования во всех трех группах без существенных межгрупповых различий (рис. 4).
Приверженность терапии оценивалась по количеству возвращенных упаковок препарата. Если пациент принимал ≥4 таблеток/пленок препарата, данный показатель расценивался как 100%-ный комплаенс. У одного пациента комплаенс составил 69%, у всех остальных он достиг 100%.
Вне зависимости от приема исследуемого препарата в исследовании было зарегистрировано 30 НЯ у 19 пациентов (табл. 2): 6 на фоне приема Виагры – у 4 пациентов, 9 на фоне приема Динамико – у 7 пациентов и 15 на фоне приема Динамико Форвард – у 8 пациентов. У одного пациента зарегистрировано одно СНЯ. Все случаи НЯ разрешились без последствий.
Желудочно-кишечных нарушений на фоне приема препарата Виагра, НЯ инфекционной природы на фоне приема Динамико и Динамико Форвард, а также гипотензии на фоне приема Динамико Форвард были расценены как непредвиденные. По выраженности все НЯ были отнесены исследователями к легкой степени тяжести и не требовали дополнительной медикаментозной коррекции, за исключением одного пациента в группе Динамико Форвард с ОРВИ средней степени тяжести. У одного пациента с развившейся на фоне приема Динамико Форвард артериальной гипотензией последующие дозировки исследуемого препарата были снижены на 50%, один пациент отозвал свое информированное согласие из-за выраженной заложенности носа, в связи с чем прием препарата был отменен. В остальных случаях доза исследуемых препаратов не менялась. В исследовании было зарегистрировано одно СНЯ – острый пансинусит, развившийся у пациента, принимавшего препарат Виагра. Заболевание потребовало госпитализации в ЛОР-стационар и разрешилось выздоровлением (было отнесено к СНЯ в связи с госпитализацией пациента). Данное СНЯ было расценено как средней тяжести, непредвиденное и не связанное с приемом препарата. Статистически значимых различий в НЯ между группами выявлено не было.
Обсуждение
Настоящее исследование представляет собой одно из первых исследований терапевтической эффективности генерической формы силденафила по сравнению с оригинальным препаратом.
В исследовании была подтверждена гипотеза «неменьшей эффективности» в отношении препаратов Динамико Форвард и Виагры; та же гипотеза по отношению ко второй паре препаратов, Динамико Форвард и Динамико, подтверждена не была. При этом схожие показатели терапевтической эффективности были продемонстрированы во всех группах наблюдения. Причиной того, что в рамках данного исследования нулевая гипотеза в отношении второй пары препаратов не была подтверждена, может быть недостаточная величина выборки пациентов. При анализе данных по окончанию исследования было рассчитано, что для доказательства первичной гипотезы в условиях выбора наиболее консервативной поправки Бонферрони понадобилось бы включение в каждую из групп не менее 74 пациентов.
Дополнительным объяснением является значительная вариабельность показателей первичной конечной точки, зафиксированная в данном исследовании. Практическим объяснением значительной вариабельности количества баллов по шкале МИЭФ может являться различная трактовка вопросов шкалы МИЭФ пациентами и как следствие – значительная вариабельность ответов.
Статистически значимых различий по влиянию на абсолютный показатель индекса МИЭФ в домене 1 между исследуемыми препаратами выявлено не было. Очевидно, что и с практической точки зрения минимальные абсолютные различия в показателях МИЭФ между группами не отражают клинически значимых эффектов.
Результаты этого исследования дополняют данные исследований биоэквивалентности, посвященных сравнению препаратов в таблетированной форме с препаратами в виде диспергируемых в ротовой полости пленок [1, 2]. В недавнем исследовании Е. Dadey было показано, что препараты в виде диспергируемых в ротовой полости пленок обеспечивают сходные показатели концентрации силденафила в плазме по сравнению с таблетированной формой [2].
Таким образом, в настоящее время имеются данные о биоэквивалентности указанных лекарственных форм, а результаты представленного нами исследования демонстрируют их схожую эффективность и безопасность. С учетом преимуществ силденафила в виде пленок (речь идет прежде всего об отсутствии необходимости запивать препарат водой), эти данные позволяют считать их возможной альтернативой таблетированной форме при терапии ряда пациентов с ЭД.
У пациентов всех трех групп установлены сходные, приемлемые показатели переносимости терапии. Количество НЯ в группах статистически значимо не различалось. Также не было выявлено влияния исследуемых препаратов на лабораторные показатели, основные жизненные функции организма и параметры электрокардиограммы. Данные, полученные в ходе исследования, соотносятся с аналогичными показателями переносимости терапии в более ранних работах [1, 2].
В исследовании М. Radicioni et al. было показано, что НЯ регистрировались с одинаковой частотой в группах пациентов, принимавших силденафил-препарат в виде пленок или таблеток [1]. Таким образом, полученные результаты подтверждают взаимозаменяемость исследуемых препаратов как в рамках показателей безопасности и переносимости, так и в отношении эффективности.
Пленки, диспергируемые в полости рта, – Динамико Форвард (Тева, Израиль), обладающие эквивалентными классическим таблеткам силденафила фармакокинетическими и фармакодинамическими свойствами, имеют перед ними ряд преимуществ. Их прием менее заметен для партнерши пациента, может быть «замаскирован» в виде приема «пастилки» для полости рта, не требует дополнительного приема жидкости, оказывая сравнимый с таблеткой клинический эффект.
При длительной терапии ингибиторами ФДЭ-5 незаметность приема препарата приобретает для пациента решающее значение. Прием препарата в режиме «по требованию» подразумевает некоторую свободу в выборе лекарственного средства для обеспечения адекватной эректильной функции. Если пациент имеет готовое решение в терапии ЭД, то после 30–40 приемов ингибиторов ФДЭ-5 в максимально удобном для него режиме «по требованию» он, как правило, перестает воспринимать ЭД как значительную проблему, зная, что может с ней успешно справиться.
Таким образом, пленки, диспергируемые в полости рта, – Динамико Форвард (Тева, Израиль) – обладают рядом преимуществ по сравнению с классической таблетированной формой силденафила при сравнимом клиническом эффекте и могут быть рекомендованы пациентам с эректильными расстройствами для приема в течение длительного времени.
Заключение
Применение препаратов Динамико Форвард и Динамико сопоставимо по терапевтической эффективности с препаратом Виагра. Исследование показало неменьшую терапевтическую эффективность препарата Динамико Форвард по сравнению с препаратом Виагра и сходную терапевтическую эффективность по сравнению с препаратом Динамико. Все три препарата продемонстрировали удовлетворительную переносимость и безопасность применения.
Литература
1. Radicioni M., Castiglioni C., Giori A., et al. Bioequivalence study of a new sildenafil 100 mg orodispersible film compared to the conventional film-coated 100 mg tablet administered to healthy male volunteers. Drug Des. Devel. Ther. 2017;11:1183–92.
2. Dadey E. Bioequivalence of 2 Formulations of Sildenafil Oral Soluble Film 100 mg and Sildenafil Citrate (Viagra) 100 mg Oral Tablets in Healthy Male Volunteers. Am. J. Ther. 2017;24:e373–80.
3. Bala R., Pawar P., Khanna S., Arora S. Orally dissolving strips: A new approach to oral drug delivery system. Int. J. Pharm. Investig. 2013;3:67–76.
4. Selvin E., Burnett A.L., Platz, E.A. Prevalence and Risk Factors for Erectile Dysfunction in the US. Am. J. Med. 2007;120:151–57.
5. Laumann E.O., Paik A., Rosen R.C. Sexual dysfunction in the United States: prevalence and predictors. JAMA. 1999;281:537–44.
6. Hatzimouratidis K., Amar E., Eardley I., et al.; European Association of Urology. Guidelines on male sexual dysfunction: erectile dysfunction and premature ejaculation. Eur. Urol. 2010;58:804–14.
7. Feldman H.A., Goldstein I., Hatzichristou D.G., et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Aging Study. J. Urol. 1994;151:54–61.
8. Ludwig W., Phillips M. Organic Causes of Erectile Dysfunction in Men Under 40. Urol. Int. 2014;92:1–6.
9. Grant P., Jackson G., Baig I., Quin J. Erectile dysfunction in general medicine. Clin. Med. 2013;13:136–40.
10. McMurray J.G., Feldman R.A., Auerbach S.M., et al.; Multicenter Study Group. Long-term safety and effectiveness of sildenafil citrate in men with erectile dysfunction. Ther. Clin. Risk Manag. 2007;3:975–81.
11. Giuliano F., Jackson G., Montorsi F., Martin-Morales A., Raillard P. Safety of sildenafil citrate: review of 67 double-blind placebo-controlled trials and the postmarketing safety database. Int. J. Clin. Pract. 2010;64: 240–55.