для чего гепариновый протокол
Практический опыт ведения пациентов с новой коронавирусной инфекцией COVID-19 в стационаре (предварительные итоги и рекомендации)
Публикация посвящена рекомендациям, основанным на личном опыте авторов, по диагностике и лечению новой коронавирусной инфекции COVID-19 и ее осложнений. Наиболее важные рекомендации касаются вопросов правильного понимания поражений легких при COVID-19 c т
Abstract. The publication is dedicated to the guidelines based on the authors’ personal experience on diagnostics and treatment of the novel coronavirus infection COVID-19, and its complications. The most important recommendations are related to the issues of correct understanding of lung lesions under COVID-19 from the perspective of practicing physicians, and challenging questions of using antibacterial therapy were analyzed. It is very important to analyze if it is necessary to define two biomarkers of inflammatory response – S-reactive protein and procalcitonin. Internal data on the result of using systemic gluco-corticosteroids under COVID-19 were presented, and the recommendations on their use were given. It is highlighted that, in respect of defining lung lesion under COVID-19, it is worth noticing that, in our opinion, the term of pneumonia absolutely does not reflect morphology and clinical-radiological signs of the pathological process which is observed in viral lung lesion under COVID-19. The term viral lung lesion (viral pneumonitis or interstitiopathy) is more correct, which should be reflected in the diagnosis. This fact has high practical importance, as the term “pneumonia” often makes doctors erroneously prescribe antibacterial therapy when there are no objective signs of bacterial infection addition. On the contrary, the above terms (viral lung lesion, viral pneumonitis or interstitiopathy) will encourage a practicing physician to assess the situation correctly, including prescription, if there are indications, of anti-inflammatory therapy.
Резюме. Публикация посвящена рекомендациям, основанным на личном опыте авторов, по диагностике и лечению новой коронавирусной инфекции COVID-19 и ее осложнений. Наиболее важные рекомендации касаются вопросов правильного понимания поражений легких при COVID-19 c с точки зрения практических специалистов, разобраны непростые вопросы применения антибактериальной терапии. Важное значение уделено анализу необходимости определения двух биомаркеров воспалительного ответа – С-реактивный белок и прокальцитонин. Представлены собственные данные о результатах применения системных глюкортикостероидов при COVID-19 и сделаны рекомендации по их применению.
Отмечено, что в отношении определения поражения легких при COVID-19, стоит отметить, что, на наш взгляд термин «пневмония» совершенно не отражает морфологию, клинико-рентгенологические признаки патологического процесса, наблюдающегося при вирусном поражении легких COVID-19. Более правильным является термин – вирусное поражение легких (вирусный пневмонит или интерстициопатия), что и должно быть отражено в диагнозе. Данный факт имеет важное практическое значение, так как термин «пневмония» нередко заставляет врачей ошибочно назначать антимикробную терапию при отсутствии объективных признаков присоединения бактериальной инфекции. Напротив, вышеозначенные термины (вирусное поражение легких, вирусный пневмонит или интерстициопатия) сподвигнут практического врача к правильной оценке ситуации, в том числе к назначению, при наличии показаний, противовоспалительной терапии.
Вспышка новой коронавирусной инфекции COVID-19 началась в середине декабря 2019 г. в Китае, в городе Ухань, и распространилась на многие города Китая, Юго-Восточной Азии, а также по всему миру [1–4]. В настоящее время количество заболевших в мире достигло более 5 млн человек, а число умерших превысило 300 тыс.
Основным источником коронавирусной инфекции является больной человек, в том числе находящийся в инкубационном периоде заболевания [1–4]. Пути передачи инфекции: воздушно-капельный (при кашле, чихании, разговоре), воздушно-пылевой и контактный. Факторы передачи: воздух, пищевые продукты и предметы обихода, контаминированные COVID-19. Инкубационный период — от 2 до 14 суток.
Из клинических проявлений наиболее часто регистрируются потеря обоняния (более 50%), кашель (50%), головные боли (8%), кровохарканье (5%), диарея (3%), тошнота, рвота, сердцебиение [5–7]. Данные симптомы в дебюте инфекции могут наблюдаться при отсутствии повышенной температуры тела. Одышка, как правило, бывает на 6–8 сутки от момента заражения. Гипоксемия (снижение SpO2 менее 88%) возникает более чем у 30% пациентов. Средний возраст больных в провинции Ухань составлял около 41 года, наиболее тяжелые формы развивались у пациентов пожилого возраста (60 и более лет) и страдающих коморбидной патологией [5]. В России подавляющее число заболевших — лица младше 65 лет. Наиболее часто у больных COVID-19 были отмечены следующие сопутствующие заболевания: сахарный диабет — 20%, артериальная гипертензия — 15% и другие сердечно-сосудистые заболевания — 15%. Легкое течение COVID-19 наблюдается у 80% больных, среднетяжелое течение — у 15% (поражение респираторных отделов легких). Крайне тяжелое течение — у 5% (острый респираторный дистресс-синдром (ОРДС), острая дыхательная недостаточность (ОДН), септический шок, синдром полиорганной недостаточности) [1–3, 5–8].
Наиболее тяжело коронавирусная инфекция протекает у пациентов с ожирением, сахарным диабетом, артериальной гипертензией.
В нашем предварительном ретроспективном анализе, включавшем 103 пациента с COVID-19, больные с ожирением (индекс массы тела более 30) составили 49,5%, сахарным диабетом — 11,65%, артериальной гипертензией — 31%.
Относительно определения поражения легких при COVID-19 стоит отметить, что, на наш взгляд, термин «пневмония» совершенно не отражает морфологию и клинико-рентгенологические признаки патологического процесса, наблюдающегося при вирусном поражении легких COVID-19. Более правильным считаем термин «вирусное поражение легких» (вирусный пневмонит, или интерстициопатия), что и должно быть отражено в диагнозе. Данный факт имеет важное практическое значение, так как термин «пневмония» нередко заставляет врачей ошибочно назначать антимикробную терапию при отсутствии объективных признаков присоединения бактериальной инфекции. Напротив, вышеозначенные термины (вирусное поражение легких, вирусный пневмонит или интерстициопатия) сподвигнут практического врача к правильной оценке ситуации, в том числе к назначению (при наличии показаний) противовоспалительной терапии (глюкокортикостероиды (ГКС) и др.) [9].
В числе биологических маркеров COVID-19 фигурирует лейкопения — 33,7%, лимфопения — 82,1%, тромбоцитопения — 36,2%, повышение лактатдегидрогеназы (ЛДГ) более 250 U/л — 41,5%, высокие концентрации D-димера, ферритина [6–7].
Вне всякого сомнения С-реактивный белок (СРБ) является основным лабораторным маркером активности процесса — системного воспаления, инициированного коронавирусной инфекцией. Его повышение коррелирует с тяжестью течения заболевания и, по нашим предварительным данным, с высоким уровнем D-димера.
Повышение уровня СРБ наряду с другими критериями служит основанием для привлечения противовоспалительной терапии (тоцилизумаб, ГКС), но не является критерием для назначения антимикробной терапии.
Напротив, прокальцитонин (ПКТ) при коронавирусной инфекции с поражением респираторных отделов легких находится в пределах референсных значений [7]. Повышение ПКТ свидетельствует о присоединении бактериальной инфекции и коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при бактериальных осложнениях.
По нашим предварительным данным, включавшим 103 пациента с новой коронавирусной инфекцией COVID-19, уровень СРБ при поступлении в стационар составил в среднем 84,7 ± 51,1 мг/л, причем наблюдалась корреляционная зависимость с высоким уровнем D-димера. При этом уровень ПКТ у всех поступивших в стационар c поражением легких COVID-19 вне зависимости от объема поражения легочной ткани (от 25% и более 75%) на первоначальном этапе составил менее 0,5 нг/мл. Таким образом, у всех пациентов, поступивших в стационар, отсутствовали объективные критерии для назначения антимикробной терапии.
Поэтому при ведении пациента с COVID-19 крайне важно мониторировать оба показателя — СРБ и ПКТ.
Лечение пациентов с COVID-19
В настоящее время этиотропного лечения с доказанной клинической эффективностью при коронавирусной инфекции COVID-19 не существует.
На основании анализа литературных данных в ряде документов рекомендованы к применению несколько препаратов. К ним относятся хлорохин, гидроксихлорохин, лопинавир + ритонавир, азитромицин (в комбинации с гидроксихлорохином), препараты интерферонов [1–3, 8]. Отмечается, что наиболее перспективна для лечения COVID-19 группа противомалярийных средств — хлорохин, гидроксихлорохин, мефлохин [1]. Считается, что их механизм действия на COVID-19 связан с препятствием проникновению вируса в клетку и его репликации [2–3, 8, 10]. На наш взгляд, клинический эффект гидроксихлорохина, который отмечался в ряде исследований [11], в том числе отмеченный нами в собственных клинических наблюдениях, связан не с «противовирусным» действием препарата, а с его противовоспалительными и иммуносупрессивными свойствами.
В этой связи рекомендуемые нами показания к использованию гидроксихлорохина следующие:
1) поражение легких на уровне КТ-1–2 (без признаков дыхательной недостаточности (ДН)) при продолжающейся лихорадке выше 38,0 °С в течение 3–5 дней курсом 4–5 суток (табл. 1);
2) среднетяжелое течение COVID-19 (объем поражения по данным КТ-2–3 без ДН) у пациентов старших возрастных групп и больных с сопутствующей патологией при отсутствии немедленных показаний к проведению противовоспалительной терапии.
Целесообразность назначения других препаратов (лопинавир + ритонавир), на наш взгляд, минимальная, в том числе учитывая нежелательные явления, развивающиеся при их приеме. Возможность их назначения может быть рассмотрена в крайне тяжелых случаях при неэффективности иных средств лечения, включая противовоспалительную терапию тоцилизумабом и ГКС.
Назначение низкомолекулярных гепаринов (НМГ) показано всем госпитализированным пациентам с поражением легких. При недоступности НМГ можно использовать нефракционированный гепарин.
Нами проведен ретроспективный анализ историй болезни 57 пациентов с новой коронавирусной инфекцией, получавших пульс-терапию метилпреднизолоном по 500 мг в сутки в/в в течение 2 последовательных дней (на курс 1 г метилпреднизолона в/в). Из них 63,2% больных с признаками поражения легких более 50% (КТ-3), 33,3% — с поражением легочной ткани на уровне 25–50% (КТ-2) и 3,5% (2 пациента) — с объемом поражения легких более 75% (КТ-4). Уровень СРБ у больных, получавших пульс-терапию метилпреднизолоном, составил 95,6 ± 55,9 мг/л. Уровень ПКТ у всех пациентов составлял менее 0,5 нг/мл (в среднем — 0,085 ± 0,09 нг/мл). У всех больных наблюдалась длительная лихорадка до фебрильных значений, признаки ДН — эпизоды десатурации до 90% и ниже при дыхании атмосферным воздухом.
На фоне проведенной терапии в первые сутки наблюдения у подавляющего числа пациентов (80,7%) нормализовалась температура тела, которая и в дальнейшем оставалась в пределах нормы (в среднем ее нормализация наблюдалась через 1,3 ± 0,5 суток). Уровень СРБ по окончании курса составил в среднем 13,7 ± 16,1 мг/л. Уровень ПКТ у всех больных после курса лечения метилпреднизолоном находился в пределах менее 0,5 нг/мл (0,08 ± 0,06 нг/мл). В обследуемой группе привлечение более высоких уровней респираторной поддержки (перевод в отделение реанимации и интенсивной терапии (ОРИТ)) не потребовалось ни в одном случае. У одного больного (1,75%) с ожирением 3-й ст. в связи с сохраняющейся ДН, требовавшей высокопоточной кислородотерапии, потребовалось дополнительное введение тоцилизумаба на 2-е сутки после терапии метилпреднизолоном. Интересно, что по данным компьютерной томографии, проведенной через 5–7 суток после курса терапии, значимого улучшения у подавляющего числа больных не наблюдалось, кроме того, у ряда пациентов отмечалась отрицательная динамика при значимом улучшении клинического состояния в виде нормализации температуры тела, повышении уровня SpO2 и толерантности к физической нагрузке. Побочных явлений при проведении терапии метилпреднизолоном не было.
Таким образом, наш опыт показывает, что своевременное использование ГКС в режиме пульс-терапии метилпреднизолоном в дозе 500 мг в сутки в течение 2 дней позволяет остановить процесс, «удержать» пациента на самом важном этапе — когда достаточным уровнем респираторной поддержки является оксигенотерапия с потоком 5–10 л/мин. На фоне применения ГКС нормализуется температура тела, снижается уровень СРБ, улучшаются показатели газообмена.
Данный вопрос является весьма важным, так как в большинстве публикаций вопрос о ГКС является дискутабельным. Стоит отметить, что в настоящее время в ряде рекомендаций рассматривается возможность привлечения ГКС к терапии пациентов с коронавирусной инфекцией, однако рекомендуемые дозы составляют 0,5 мг/кг [2]. Также известны рекомендации итальянских врачей, использующих небольшие дозы ГКС в лечении интерстициопатии при COVID-19. Метилпреднизолон присутствует в протоколе Медицинского института Восточной Вирджинии, рекомендовано его применение у пациентов в ОРИТ, используя нагрузочную дозу 40 мг каждые 12 часов в течение не менее 7 дней или до окончания реанимационного периода, а у пациентов с недостаточным ответом — увеличение до 80 мг каждые 12 часов [12]. В последнее время увидели свет китайские рекомендации, где отмечена возможность применения ГКС коротким курсом 3–5 дней в дозе 1–2 мг/кг в сутки [13].
В нашем же ретроспективном исследовании, включавшем 57 пациентов с COVID-19, впервые хороший эффект был получен именно при применении пульс-терапии метилпреднизолоном 500 мг в сутки в/в в течение двух последовательных дней.
С учетом полученных данных, на наш взгляд, целесообразно расширить показания к привлечению упреждающей противовоспалительной терапии.
Возможность противовоспалительной терапии должна быть рассмотрена при сохраняющейся лихорадке выше 38–39 °С в течение 5–7 дней при наличии, как минимум, одного из следующих критериев:
1) появление признаков ДН (падение SpO2 ниже 92% при дыхании атмосферным воздухом и др.);
2) прогрессирующее поражение легких по результатам компьютерной томографии (КТ);
3) повышение уровня СРБ выше 50 мг/л.
Пациентам с длительной лихорадкой и прогрессирующими изменениями в легких на уровне КТ 1–2 без ДН рекомендованы средние дозы ГКС: преднизолон — 90–120 мг и выше или дексаметазон — 12 мг в сутки в течение трех дней.
У больных с длительной лихорадкой и прогрессирующим поражением легких на уровне КТ-3–4 с признаками ДН, уровнем СРБ более 70 мг/л рекомендовано использование более высоких доз ГКС — пульс-терапия метилпреднизолоном по 250–500 мг в сутки в течение 2–3 дней или применение моноклональных антител — тоцилизумаба, сарилумаба (табл. 2).
У пациентов с сохраняющимися массивными изменениями по данным КТ (участки консолидации, ретикулярные изменения) с ДН (эпизоды десатурации ниже 93% при физической нагрузке), требующей длительной оксигенотерапии, возможно применение метилпреднизолона
per os в дозе 0,5 мг/кг в течение 2–3 недель с последующим снижением до полной отмены. По нашим клиническим наблюдениям данный подход также демонстрирует улучшение показателей газообмена, повышение толерантности к физической нагрузке.
Антибактериальная терапия назначается только при наличии убедительных признаков присоединения бактериальной инфекции (повышение ПКТ более 0,5 нг/мл, появление гнойной мокроты) — табл. 3.
В качестве симптоматической терапии использовались жаропонижающие средства по показаниям — парацетамол, у 68,9% больных, по данным нашего исследования, отмечался, как правило, непродуктивный кашель, купировавшийся при использовании противокашлевых препаратов (преноксдиазин, Ренгалин, бутамират). В данном контексте стоит отметить, что в ряде случаев при коронавирусной инфекции кашель может быть причиной жизнеугрожающих осложнений, в двух наблюдениях у пациентов с надсадным кашлем развился спонтанный пневмоторакс, потребовавший дренирования плевральной полости.
Алгоритм действий врача при приеме пациента с COVID-19:
При ведении больного необходимо обращать внимание на выраженность гастроинтестинального синдрома (диарея, рвота), проводить мониторинг электролитов и принимать меры по коррекции водно-электролитных нарушений (Регидрон и др.).
При прогрессировании заболевания (см. критерии) важно начать упреждающую терапию блокаторами ИЛ-6 — тоцилизумаб, сарилумаб или ГКС.
Необходимость противовоспалительной терапии (ГКС) должна быть рассмотрена при сохраняющейся лихорадке выше 38–39 °С в течение 5–7 дней при наличии как минимум одного из следующих критериев:
1) появление признаков ДН (падение SpO2 ниже 92% при дыхании атмосферным воздухом и др.);
2) массивное (прогрессирующее) поражение легких по результатам КТ (поражение более 3 сегментов в каждом легком, субтотальное поражение одного легкого, значимое прогрессирование — более 50% объема легочной ткани);
3) повышение уровня СРБ выше 50 мг/л.
Противопоказания к назначению ингибиторов рецепторов ИЛ-6: сепсис, нейтропения менее 0,5 × 109 /л, тромбоцитопения (менее 50 тыс.), повышение АСТ, АЛТ более 5 норм, сопутствующие заболевания с прогнозируемым неблагоприятным исходом.
При неэффективности (повышение уровня ПКТ), развитии нозокомиальных осложнений выбор режима антимикробной терапии необходимо осуществлять на основании выявления факторов риска, резистентных возбудителей, анализа предшествующей терапии, результатов микробиологической диагностики (пиперациллин/тазобактам, цефепим/сульбактам, меропенем, дорипенем, имипенем/циластатин, цефтолозан/тазобактам, цефтазидим/авибактам, тигециклин, азтреонам, амикацин и др.).
Литература/References
* ФГБУ ГВКГ им. Н. Н. Бурденко, Москва
** НМИЦ ССХ им. А. Н. Бакулева, Москва
Практический опыт ведения пациентов с новой коронавирусной инфекцией COVID-19 в стационаре (предварительные итоги и рекомендации)/ А. А. Зайцев, С. А. Чернов, Е. В. Крюков, Е. З. Голухова, М. М. Рыбка
Для цитирования: Лечащий врач № 6/2020; Номера страниц в выпуске: 74-79
Теги: коронавирус, поражение легких, интерстициопатия, воспаление
Основы антикоагулянтного лечения острого венозного тромбоэмболизма
Ежегодно в мире у 0,1% населения регистрируется венозный тромбоэмболизм (ВТЭ). С практической точки зрения, по современным представлениям, ВТЭ объединяет венозный тромбоз (ВТр) — тромбообразование в венозном русле кровообращения и венозную эмболию — пер
Ежегодно в мире у 0,1% населения регистрируется венозный тромбоэмболизм (ВТЭ). С практической точки зрения, по современным представлениям, ВТЭ объединяет венозный тромбоз (ВТр) — тромбообразование в венозном русле кровообращения и венозную эмболию — перенос части тромба в вены, дистальнее кровотока. Наиболее часто ВТЭ оказывается представлен тромбозом глубоких вен голени (ТГВ) и тромбоэмболией легочной артерии (ТЭЛА).
ТЭЛА — это одно из самых катастрофических осложнений, которое внезапно обрывает жизнь многих больных, унося каждый год только в США 150–200 тыс. жизней [1]. Существенное влияние на снижение риска фатального исхода ТЭЛА оказывают своевременно начатые диагностика и лечение. Неадекватная антикоагулянтная терапия может послужить причиной развития посттромбофлебитического синдрома, рецидивирующего тромбоэмболизма и тромбоэмболической легочной гипертензии. Без антикоагулянтной терапии в 11–26% случаев ВТЭ может осложниться ТЭЛА со смертельным исходом [2]. Поэтому после постановки диагноза ВТЭ целью лечения являются устранение симптомов болезни, предупреждение увеличения размеров тромба, эмболизации и ретромбозов.
Стандартная практика лечения больных с ТГВ и ТЭЛА принципиально не различается, так как наличие самой эмболии иногда служит единственным признаком того, что у больного имеется латентно протекающий эмбологенный тромбоз.
Стартовая терапия
Терапия ВТЭ начинается с 4–7-дневного введения гепаринов (нефракционированного или низкомолекулярного).
В таблице 1 представлены варианты выбора гепаринотерапии для стартового лечения.
Нефракционированный гепарин (НФГ). Гепарин — непрямой ингибитор тромбина, для осуществления антикоагулянтного действия которого необходим ко-фак-тор — антитромбин III. Комплекс гепарин-антитромбин III инактивирует несколько факторов свертывания: тромбин (II), Xa, XIIa, XIa, IXa. Среди них наибольшей чувствительностью к инактивации отличаются факторы Xa и IIa (тромбин). Кроме антикоагулянтного эффекта, НФГ, соединяясь с остеобластами, активирует остеокласты, ускоряя потерю костной ткани [3].
Определить концентрацию НФГ в крови невозможно, так как в свободном состоянии в циркуляции он отсутствует, поэтому дозу препарата необходимо подбирать, ориентируясь на оценку гипокоагуляции, вызываемой им. Наиболее приемлемым является тест определения активированного частичного тромбопластинового времени (АЧТВ). Рекомендованное терапевтическое удлинение АЧТВ основано на экспериментальных данных, показавших, что клинический эффект достигается при таком терапевтическом уровне НФГ, который удлиняет АЧТВ в 1,5–2,5 раза.
НФГ не обладает специфическим связыванием с определенными плазменными или клеточными белками, что предопределяет его различное гипокоагулянтное воздействие на пациентов. У 25% больных с ВТЭ, несмотря на получаемые ими дозы НФГ — более 35 000 ЕД в сутки, удлинение АЧТВ не достигает терапевтических значений. Данный феномен связан с так называемой резистентностью к НФГ [4]. Большинство из «резистентных» пациентов имеют достаточный уровень НФГ в крови, но повышенную концентрацию прокоагулянтов [5]. Не так часто встречаются случаи, когда у пациентов не удлиняется АЧТВ и не поддерживается достаточная концентрация НФГ, несмотря на вводимые высокие дозы препарата. Данный эффект является следствием нейтрализации гепарина белками плазмы крови, эндотелиальными клетками и повышенным клиренсом гепарина. Редко резистентность к НФГ вызвана низким уровнем антитромбина III. Основными причинами дефицита антитромбина являются гепатит, цирроз печени, нефротический синдром, беременность, прием оральных контрацептивов, синдром диссеминированного внутрисосудистого свертывания, острое воспаление и др. С практической точки зрения в данных клинических случаях определяющим фактором эффективности лечения НФГ является доза препарата, а не показатели АЧТВ [6].
При назначении НФГ с лечебной целью следует отдавать предпочтение внутривенному непрерывному способу его введения, который позволяет поддерживать оптимальные значения АЧТВ на протяжении суток. Для стартового лечения ВТЭ НФГ вводится путем внутривенной постоянной инфузии (1200–1300 ЕД/ч или 18 ЕД/кг/ч) после болюсной дозы 5000 ЕД или 80 ЕД/кг [5].
Для подбора дозы гепарина в зависимости от показателей АЧТВ используются алгоритмы, предложенные Американской ассоциацией сердца [7]. Алгоритм, представленный в таблице 2, следует задействовать в тех случаях, когда используются одинаковые реактивы АЧТВ и контрольное АЧТВ находится в одинаковых пределах. Первая доза одинакова для всех больных, дальнейшая скорость инфузии (32 000 ЕД/24 ч) относится только к первым 6 ч лечения, по прошествии этого времени необходимо корригировать дозу в соответствии с номограммой, исходя из значений АЧТВ.
В других случаях может быть применена номограмма, приведенная в таблице 3, в которой использованы не абсолютные величины АЧТВ, а его изменения по отношению к контрольному АЧТВ, определенному конкретной лабораторией.
Большие кровотечения при данном терапевтическом подходе составляют 2% и зависят от дозы препарата, возраста пациента, функционального состояния почек и печени, недавно перенесенных операций, травм и инвазивных процедур, злоупотребления алкоголем, сопутствующей терапии — тромболитических препаратов, антагонистов тромбоцитарных гликопротеинов IIb/IIIa, ацетилсалициловой кислоты [5].
Метаанализ результатов клинических исследований показал, что подкожное применение НФГ для лечения венозных тромбозов сопоставимо по эффективности и безопасности с внутривенным путем введения при условии подбора адекватных доз и надлежащего лабораторного контроля. Поскольку биодоступность НФГ при подкожном пути введения ниже (30%), чем при внутривенном, начальные дозы НФГ должны быть больше. Обычный режим для подкожного метода лечения НФГ включает начальный внутривенный болюс 5000 ЕД, далее подкожно дважды в сутки с последующим подкожным введением 17 500 ЕД и коррекцией дозы на основании АЧТВ [4, 8]. Для подбора дозы в зависимости от веса пациента и величины АЧТВ используют алгоритм, приведенный в таблице 4, при этом контроль АЧТВ проводится через 6 ч и далее по указанному протоколу.
Имеются результаты единичных исследований, в ходе которых изучалась эффективность подкожного введения НФГ для лечения ТЭЛА. Однако с достаточной уверенностью рекомендовать данный метод терапии не представляется возможным из-за небольшого количества достоверных клинических данных [10].
Гепарины низкого молекулярного веса (ГНМВ).
ГНМВ различаются по физико-химическим, биологическим, фармакологическим свойствам и нейтрализующей активности в отношении активного фактора Х (Ха) и тромбина (IIа), т. е. соотношения анти-Ха/анти-IIа-активности. Указанная гетерогенность имеет практическое значение: одинаковые дозы различных препаратов ГНМВ оказывают неодинаковое действие на фактор Ха и, как следствие, вызывают различный антикоагулянтный эффект. В связи с этим невозможно экстраполировать эффективность лечебного действия одного из ГНМВ на другие. Практически это разные препараты. Для контроля над эффективностью и безопасностью лечебного действия ГНМВ метод АЧТВ не применим, так как он не отражает антикоагулянтную активность используемых препаратов.
С этой целью применяется оценка инактивации активного фактора Х [5]. Доза низкомолекулярных гепаринов выражается в условных единицах (ЕД/кг массы тела), отражающих антифактор Ха-активность препаратов, определенную фирмой-производителем. В рутинной клинической практике лабораторный контроль за эффективностью ГНМВ не производится. Следует помнить, что подобранные по весу дозы ГНМВ адекватны для больных, чей вес не превышает 150 кг. Данной категории больных, а также беременным и пациентам с нарушенной функцией почек целесообразно определять анти-фактор Ха-активность вводимого препарата.
Анализ результатов исследований по оценке эффективности и безопасности подкожного применения фиксированных доз ГНМВ для лечения больных с ВТЭ в сравнении с НФГ, вводимым внутривенно в дозах, подобранных по АЧТВ, показал, что ГНМВ столь же эффективны в лечении и предупреждении рецидивов ТГВ/ТЭЛА как и НФГ, но реже вызывают геморрагические осложнения [11]. Это открыло путь к успешному изучению лечения неосложненных ТГВ и субмассивной ТЭЛА в амбулаторных условиях. Подтверждено превосходство ГНМВ над НФГ (доказана эффективность для надропарина кальция (фраксипарина) и эноксапарина натрия (клексана), что улучшает качество жизни больных и снижает стоимость лечения [12]. Однако у лиц с массивной ТЭЛА и высоким риском кровотечений (пожилой возраст, недавнее хирургическое вмешательство, кровотечения в анамнезе, заболевания почек и печени) данный вариант терапии не приемлем [5].
При использовании гепаринов более 5–7 сут возможно развитие гепарининдуцированной тромбоцитопении, которая обычно развивается между 3-м и 15-м днями после начала лечения, с частотой в среднем 2,4% при терапевтическом применении гепарина и 0,3% при назначении его с профилактической целью.
Необходимо подозревать гепарининдуцированную тромбоцитопению всякий раз, когда у пациента развиваются необычные изменения в клинико-лабораторных показателях в течение или вскоре после терапии гепарином. К таковым относятся: уменьшение количества тромбоцитов менее 100 000 в 1 мкл либо на 50% и более от исходного уровня на 5–10-е сутки от начала введения гепарина.
Оральные антикоагулянты-антивитамины К (ОАК–АВК). Для предотвращения дальнейшего увеличения размеров тромба и вторичных тромбоэмболических осложнений применяются ОАК–АВК. В зависимости от химической структуры молекулы антикоагулянта различают производные монокумарина и дикумарина, циклокумарины и индандионы.
Наиболее широко в мире применяются производные монокумарина — варфарин (кумадин) и аценокумарол (синтром, никумадин, синкулар), что обусловлено их оптимальной продолжительностью действия и хорошей переносимостью. Варфарин является препаратом выбора, так как время его нахождения в организме больного обеспечивает более стабильное воздействие на процесс свертывания крови, чем во время терапии аценокумаролом. Назначение весьма популярных в России фенилина и пелентана ограничивается токсичностью первого и неустойчивым антикоагулянтным эффектом второго (табл. 5).
При использовании ОАК для предупреждения рецидива ВТЭ его дозу рекомендуется подбирать таким образом, чтобы поддерживать значение Международного нормализованного отношения (МНО) на уровне 2,0–3,0 [13]. Терапия варфарином в период ее проведения редуцирует риск ретромбозов на 90–95% [14]. ОАК обычно назначается пациентам с ВТЭ одновременно с гепаринами непосредственно после эпизода тромбообразования. При достижении уровня МНО более 2,0 гепарин можно отменить.
Терапию ОАК рекомендуется начинать с поддерживающих доз: 2,5–5 мг для варфарина, 0,75–3 мг для маркумара, 1–4 мг для синкумара. Более низкие стартовые дозы показаны лицам старше 60 лет, уроженцам Азии, в особенности лицам китайского происхождения, пациентам с нарушением функции почек и печени, артериальной гипертензией, застойной сердечной недостаточностью, а также при сопутствующей терапии препаратами, усиливающими антикоагулянтный эффект ОАК.
Перед приемом препарата необходимо оценить общий анализ крови, протромбиновое время, АЧТВ, общий анализ мочи, определить функциональное состояние печени и почек. При рецидивирующем венозном тромбозе целесообразно провести скрининг на предмет тромбофилий. Среди наследственных факторов наиболее распространенными являются: генетическая мутация фактора V свертывания крови (фактор V Лейдена), мутация 20210А гена протромбина, а также мутация гена метилентетрагидрофолатредуктазы, приводящая к развитию гипергомоцистеинемии. Препарат принимается 1 раз в день в фиксированное время после еды. Контроль МНО проводится через 10–12 ч после приема препарата. На протяжении первой недели определение МНО рекомендуется производить ежедневно, затем 1 раз в неделю. Следует подчеркнуть, что расчет МНО производится в плазме, т. е. в венозной крови.
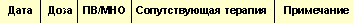 |
| Таблица 6. Дневник приема ОАК |
Перед началом терапии больному необходимо разъяснить особенности антикоагулянтной терапии ОАК. Пациент должен вести дневник по приведенному образцу (табл. 6), в котором отмечаются значения МНО, доза принимаемого препарата, сопутствующая терапия. Пациент должен сообщать врачу о любых заболеваниях, возникших во время лечения ОАК–АВК. Врачу рекомендуется вести специальную форму, в которой целесообразно записывать показания, по которым производится прием ОАК–АВК, планируемые значения МНО, предполагаемая продолжительность терапии, факторы риска кровотечения.
В таблице 7 приведен алгоритм подбора дозы в начале лечения варфарином [15]. Тактика лечения иными ОАК должна быть аналогичной под контролем МНО.
 |
| Таблица 7. Алгоритм стартового лечения варфарином |
После достижения необходимого уровня МНО алгоритм дальнейшего наблюдения должен быть следующим: первое определение МНО — через 5–10 дней, второе — через 2 нед, третье — через 3 нед, четвертое и все последующие — через 4 нед.
После диагностики тромбоза при определении длительности применения ОАК должны учитываться причины и выраженность тромбофилического состояния. Согласно существующим рекомендациям, терапия ОАК должна составлять не менее 3 мес у больных с симптоматическим тромбозом на фоне очевидных «обратимых» факторов, провоцирующих гиперкоагуляцию (травмы, операции и др.). Пациенткам с венозными тромбозами, возникшими на фоне гормональной заместительной терапии, лицам с «синдромом экономического класса» терапия продлевается до полугода. Не менее 1 года должны получать превентивное лечение ОАК пациенты со спонтанным венозным тромбозом [17, 18]. Больные с рецидивирующими венозными тромбозами, рецидивирующими тромбозами на фоне выявленных генетических тромбофилий нуждаются в постоянном приеме ОАК. Пациентам без эпизодов ВТЭ в прошлом, но с подтвержденным гетерозиготным дефицитом протеинов С и S, антитромбина III, с мутацией факторов V Лейден или протромбина G20210A некоторые специалисты [19] рекомендуют профилактическое назначение антикоагулянтов только при наличии выраженных приобретенных факторов риска тромбообразования, например при подготовке к оперативным вмешательствам. Такое лечение, по сообщениям этих авторов, предупреждает половину возможных тромбозов.
Применение ОАК при инвазивных процедурах. У пациентов группы низкого риска тромбоэмболий (венозный тромбоз более чем 3 мес назад, неосложненная системными тромбоэмболиями мерцательная аритмия) терапия ОАК прекращается за 3–4 дня до операции до достижения значений МНО менее 1,5. Если операция сопровождается риском тромбозов, кратковременно показаны профилактические дозы гепаринов, затем возобновление терапии ОАК.
У пациентов группы среднего риска тромбоэмболий ОАК отменяются за 4 дня до операции до достижения МНО 1,5. За 2 дня до операции назначаются либо низкие дозы НФГ (5000 ЕД подкожно) либо профилактические дозы ГНМВ. После операции — низкие дозы НФГ (или ГНМВ) и затем ОАК.
У пациентов группы высокого риска тромбоэмболий (венозный тромбоз менее 3 мес назад, рецидивы венозного тромбоза в анамнезе, протезы клапанов сердца в митральной позиции) ОАК отменяются за 4 дня до операции до достижения МНО 1,5. За 2 дня до операции назначаются терапевтические дозы гепаринов. Гепарины отменяются за 12–24 ч до операции.
Пациентам, у которых возникает необходимость удаления зуба, перед процедурой необходимо определить значения МНО. Если показатели остаются в пределах терапевтических значений, то процедуру можно проводить без коррекции терапии. Если значения МНО превышают 3,5, нужно пропустить один-два приема препарата. Следующие стоматологические процедуры не требуют коррекции дозы ОАК: пломбировка, установка коронки, мостов, чистка канала, снятие зубного камня [20].
Литература
Т. В. Козлова, доктор медицинских наук, доцент
Т. В. Таратута, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
_575x.gif)
_575x.gif)
_575x.gif)