для чего используется оксид азота
Оксид азота

Оксид азота или окись азота, а также известный как монооксид азота представляет собой молекулу с химической формулой NO. Это свободные радикалы, которые является важным промежуточным продуктом химических реакций.
В организмах млекопитающих и человека оксид азота является важной составляющей клеточных сигнальных молекул, участвующих во многих физиологических и патологических процессах. Это мощный вазодилататор с коротким, в несколько секунд, периодом полураспада в крови.
В конце 80-х годов было доказано, что особые ферментные системы организмов способны синтезировать газ оксида азота. Это происходит в результате окисления гуанидиновой группы аминокислоты L-аргинина с одновременным синтезом цитруллина.
Получение оксида азота
В лабораторных условиях получение оксида азота возможно путем проведения реакции разбавленной азотной кислоты с медью или восстановлением азотистой кислоты в виде нитрита натрия или нитрита калия.
Основным природным источником оксида азота являются электрические разряды молний в грозу. Оксид азота является побочным продуктом, возникающим при сгорании веществ в автомобильных двигателях и топлива на электростанциях.
Также получение оксида азота возможно из свободных элементов, для этого необходимо при температуре 1200-1300°C провести соединение азота с кислородом.
Применение оксида азота
Оксид азота используется в медицине для расширения кровеносных сосудов при ишемической болезни сердца путем уменьшения нагрузки на сердце.
Оксид азота используется при неотложной помощи для содействия капиллярному расширению легких для лечения первичной легочной гипертензии у новорожденных, связанной с врожденными дефектами. Терапия оксидом азота значительно повышает качество жизни и, в некоторых случаях, спасает жизнь детей с риском развития заболевания сосудов легких.
Оксид азота также вводится в виде спасительной терапии у больных с острой правожелудочковой недостаточностью, которая является вторичной по отношению к легочной эмболии.
В пищевой промышленности оксид азота известен под названием пищевая добавка Е942 и используется в качестве пропеллента и упаковочного газа.
Свойства оксида азота
Польза оксида азота

Вред оксида азота
Применение оксида азота у большинства людей не вызывает побочных эффектов, однако, в случаях передозировки он приводит к диарее, слабости, тошноте, головной боли, учащению пульса и сердцебиения, задержкам воды, усталости, раздражениям на коже и сухости во рту.
Также побочными эффектами применения оксида азота являются проблемы с дыханием, сильная аллергия или сыпь, крапивница, зуд, одышка, опасные для жизни осложнения астмы, внезапный озноб, потливость, тремор, рвота и обмороки. В некоторых случаях применение оксида азота приводит к вспышкам герпеса, расширению сосудов и кровотечениям.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Оксиды азота. Азотная кислота
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):

Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
В избытке кислорода образуется только нитрат натрия:
Ниже 22 0 С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0 С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:

Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0 С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
Кислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
Как и все кислоты, она реагирует:
в) с солями более слабых кислот:
Окислительно – восстановительные свойства

Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:

Получение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
В промышленности получение азотной кислоты идет в три стадии:
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
*на изображении записи кристаллы нитрата меди (II)
Оксид азота: полное руководство
Наши кровеносные сосуды — это маленькие каналы, которые переносят кислород и питательные вещества к мышцам и выводят отходы. Если бы вы могли каким-то образом открыть шлюзы, через них могло бы пройти больше крови, и больше топлива было бы доставлено вашим мышцам, в то время как больше мусора вымывалось.
Эта теория и лежит в основе добавок оксида азота (NO). Они расширяют кровеносные сосуды, чтобы обеспечить больший кровоток и улучшить питание работающих мышц, тем самым способствуя работоспособности, восстановлению и общему улучшению здоровья.
Что такое оксид азота?
NO (иногда обозначаемый как NO2) — это встречающееся в природе соединение, которое действует как сосудорасширяющее средство. То есть он расслабляет кровеносные сосуды, заставляя их расширяться и обеспечивать больший кровоток.
Организм сам вырабатывает оксид азота, чтобы сохранить здоровье кровеносных сосудов. Уровень NO поддерживается различными питательными веществами в продуктах, которые мы едим.
Добавки оксида азота были популярной категорией спортивного питания почти 20 лет. Однако технически они содержат не оксид азота, а соединения, которые способствуют выработке оксида азота в организме.
NO образуется из аминокислоты L-аргинина. Когда L-аргинин превращается в оксид азота, в качестве побочного продукта образуется аминокислота L-цитруллин. Затем организм может повторно использовать L-цитруллин, чтобы снова создать L-аргинин и обеспечить больше NO, поэтому добавление обоих аминокислот может помочь поддерживать уровень NO в организме.
Между прочим, цитруллин малат — другая форма цитруллина — имеет тот же эффект, что и L-цитруллин, поэтому оба соединения содержатся в добавках NO.
Преимущества оксида азота
Расширяя кровеносные сосуды и увеличивая кровоток, оксид азота помогает получить больше питания и кислорода в мышцы, ускоряя удаление метаболических отходов. Было доказано, что добавки, поддерживающие уровень оксида азота в организме, имеют следующие преимущества.
1. Увеличивают работоспособность
Исследование, опубликованное в Журнале прикладной физиологии, показало, что бегуны, которые принимали добавки с L-аргинином, увеличивали время до изнеможения во время упражнений более чем на две минуты. В 2017 году Европейский журнал клинического питания сообщил, что футболисты, принимающие L-аргинин, значительно улучшили свои аэробные показатели по сравнению с плацебо.
Исследование, опубликованное в European Journal of Nutrition, пришло к выводу, что цитруллин малат улучшил показатели силовых тренировок у женщин: объем жима ногами у испытуемых увеличился на 12 повторений за одну тренировку.
2. Ускоряют восстановление
Расширенные кровеносные сосуды позволяют кровотоку уносить побочные продукты метаболизма, которые быстрее вызывают послетренировочную мышечную болезненность. Вероятно, поэтому исследователи обнаружили, что 41 атлет-мужчина, принимавшие цитруллин малат перед тренировкой, болели на 40% меньше через 24 и 48 часов после тренировки.
3. Повышают эффективность тренировок
При нагрузке L-аргинин и L-цитруллин помогают облегчить тяжелые тренировки, поэтому вы сможете выполнять их с максимальной интенсивностью и энтузиазмом.
Исследование 2019 года показало, что комбинация обоих ингредиентов помогла значительно повысить мощность футболистов, выступающих на велоэргометре. Несмотря на то, что они приложили больше усилий, испытуемые сказали, что после этого они не чувствовали сильную болезненность в ногах и что крутить педали стало легче.
Аналогичные результаты были получены в исследовании 2016 года. L-цитруллин не только помог улучшить результаты при езде на велосипеде, но и по сообщениям велосипедистов, они чувствовали себя значительно менее утомляемленными после тренировки.
4. Поддерживают здоровое кровяное давление
Разумеется, расширенные кровеносные сосуды могут привести к снижению артериального давления, и именно это показал метаанализ 15 различных исследований L-цитруллина 2018 года. Прием добавки в течение шести или более недель значительно способствовал снижению артериального давления — как систолического, так и диастолического.
Британский журнал спортивной медицины сообщил о сопоставимых результатах для L-аргинина. Велосипедисты-мужчины, которые ежедневно принимали добавки, улучшили свои показатели, снизив потребление кислорода мышцами, и показали снижение кровяного давления.
5. Помогают нарастить мышцы
Глутатион — это соединение, которое поддерживает здоровье клеток. Он доступен как отдельная добавка, но считается, что потребление сывороточного протеина повышает уровень глутатиона в организме. Ученые считают, что глутатион может помочь замедлить расщепление NO в организме.
В исследовании 2018 года изучалось влияние сочетания глутатиона с L-цитруллином. Две группы испытуемых тренировались с отягощениями, и через четыре недели прирост мышц был значительно больше в группе глутатион плюс L-цитруллин, чем в группе плацебо.
Кроме того, исследование 2016 года показало, что цитруллин малат помог повысить взрывную силу и силу хвата у теннисисток.
Когда следует принимать добавку с оксидом азота?
В отличие от кофеина или сывороточного протеина, исследования не показывают оптимального времени для приема L-аргинина или цитруллина. Однако в большинстве исследований, которые показывают, что эти соединения улучшают производительность во время теста с физической нагрузкой, испытуемые принимали свою дозу в течение часа в ходе теста.
«На мой взгляд, прием любых добавок, которые предназначены для увеличения уровня оксида азота, следует принимать до тренировки, — говорит Шеннон Эрхардт, доктор медицинских наук, CSSD, диетолог EXOS Performance, — поскольку большинство ингредиентов, содержащихся в этих типах продуктов (например, аргинин и цитруллин) имеют короткий период полураспада, при котором эффекты могут больше не играть роли. Период полураспада аргинина составляет от полутора до двух часов, а у цитруллина — около часа».
Поэтому, если вы хотите, чтобы они работали с максимальным эффектом, вам лучше потренироваться вскоре после их приема. Причем то, что вы принимаете наряду вместе с оксидом азота, может в большей степени повлиять на его эффективность.
Два недавних исследования в Planta Medica показывают, что порошок плодов манго может помочь улучшить кровообращение, поэтому его может быть полезно принимать вместе с L-аргинином и цитруллином. Как упоминалось выше, глутатион тоже может помочь.
Какие продукты содержат оксид азота?
Нитраты — это соединения, которые содержатся во многих овощах, и они могут превращаться в оксид азота в организме. Это одна из причин, по которой употребление овощей связано со здоровым кровяным давлением: нитраты накапливают оксид азота в вашей системе, который расслабляет кровеносные сосуды и способствует здоровому кровотоку.
Многие исследования показали, что нитраты из свеклы могут положительно влиять на физическую работоспособность. Они также содержатся в рукколе, сельдерее и шпинате.
Однако оксид азота нестабилен и в результате быстро разрушается в кровотоке. Чтобы поддерживать его уровень на достаточно высоком уровне, необходимо часто пополнять или снижать скорость его распада, и именно поэтому так важны добавки.
Продукты, богатые антиоксидантами, например, те, которые являются хорошими источниками витамина С, помогают нейтрализовать свободные радикалы, уменьшающие оксид азота. По этой причине цитрусовые, такие как апельсины, являются хорошим выбором для поддержания высокого уровня оксида азота.
Мясо животных травяного откорма и дикие морепродукты содержат составной кофермент Q10 (CoQ10), который помогает поддерживать здоровье клеток. Считается, что CoQ10 поддерживает уровень оксида азота. Мясные субпродукты, такие как печень, особенно богаты CoQ10.
Поскольку L-аргинин является аминокислотой, его можно найти в большинстве белковых продуктов, но грецкие орехи являются особенно хорошим источником. L-цитруллин содержится в мясе, бобовых и арбузе.
Заключение
Оксид азота (NO) — это природное соединение, которое действует как сосудорасширяющее средство. То есть он расслабляет кровеносные сосуды, заставляя их расширяться и обеспечивать больший кровоток. Спортивные добавки с оксидом азота технически не содержат сам оксид азота, а только соединения, помогающие вырабатывать NO: L-аргинин и L-цитруллин.
Преимущества добавок, поддерживающих уровень оксида азота:
По мнению экспертов, для большего эффекта добавки, увеличивающие NO, следует принимать непосредственно перед тренировкой.
Кроме добавок, накапливать оксид азота в организме могут овощи, особенно свекла, руккола, сельдерей, шпинат. Поддерживать уровень NO помогают цитрусовые, белковые продукты.
Окись азота
Окись азота
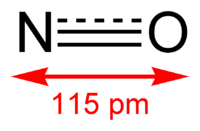
| Оксид азота(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(II) |
| Химическая формула | NO |
| Отн. молек. масса | 30.0061 а. е. м. |
| Молярная масса | 30.0061 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00134 (газ) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151.7 °C |
| Энтальпия (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| номер CAS | [10102-43-9] |
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Содержание
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
Применение
Полезное
Смотреть что такое «Окись азота» в других словарях:
ОКИСЬ АЗОТА — ОКИСЬ АЗОТА, см. монооксид АЗОТА … Научно-технический энциклопедический словарь
окись азота — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN nitric oxide … Справочник технического переводчика
окись азота — azoto oksidas statusas T sritis ekologija ir aplinkotyra apibrėžtis Azoto junginys su deguonimi: N₂O, NO, NO₂, N₂O₃, N₂O₄, N₂O₅. atitikmenys: angl. nitric oxide; nitrogen monoxide vok. Stickoxid, n; Stickstoffmonoxid, n rus. окись азота, f … Ekologijos terminų aiškinamasis žodynas
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
азота окись — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
азота(II) оксид — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
Окись этилена — Окись этилена … Википедия
Окись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окись углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона