для чего используют фосфорную кислоту
Ортофосфорная кислота – применение
Ортофосфорная кислота – универсальное вещество, которое применяется во многих сферах деятельности. Чаще всего ее используют для удаления ржавчины с металлических поверхностей.
Что такое ортофосфорная кислота
Что же такое ортофосфорная (фосфорная) кислота? Она относится к неорганическим веществам. При комнатной температуре она приобретает вид ромбических кристаллов. Имеет консистенцию сиропа и представляет собой 85-процентный раствор. Ее кристаллы хорошо растворимы в воде и этиловом спирте.
Это вещество относится к группе антиоксидантов (антиокислителей) и используется как регулятор кислотности. В качестве добавки ей присвоен код Е338.
Описание препарата, характеристики, вредные свойства
Химическая формула вещества – H3PO4. При нагревании вещества до температуры более 213°C оно меняет свой состав и превращается в пирофосфорную кислоту (H4P2O7).
Основным свойством этого химического компонента выступает отсутствие выраженного запаха и цвета. Она обладает хорошей растворимостью в воде и других жидкостях. Образуется она при химическом воздействии на фосфат или же во время применения гидролиза. Ее преимуществом выступает низкая себестоимость (в отличие от лимонной кислоты). В связи с этим ее часто используют в производстве напитков и продуктов питания.
Это вещество негативно влияет на здоровье, повышая кислотность желудочного сока. Людям, страдающим гастритом с повышенной кислотностью, необходимо свести к минимуму или исключить из рациона продукты, содержащие в своем составе такое вещество.
Помимо всего прочего, она способствует выведению из организма кальция, что может негативно сказаться на состоянии зубов и костей. Передозировка этого вещества может спровоцировать нарушения в работе ЖКТ, вызвать тошноту и рвоту.
Получение кислоты
Многие задаются вопросом, как получить кислоту в лабораторных условиях? Существуют различные способы получения ортофосфорной кислоты, наиболее распространенными среди которых являются следующие:
P2O5 + 3H2O = 2H3PO4
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Сфера применения
Ортофосфорную кислоту применяют в таких сферах деятельности, как нефтяная промышленность, стоматология, животноводство. Ее также используют при производстве:
Правила работы с кислотой
Работа с ортофосфорной кислотой должна происходить в помещении с хорошей вентиляцией. Следует обязательно надеть респиратор для предотвращения попадания едких паров в дыхательные пути и очки для защиты глаз. Если нет под рукой этих защитных средств, то следует воспользоваться маской. Обязательно следует надевать перчатки и защищать открытую поверхность кожи от попадания на нее вещества, т. к. это может привести к ожогам. При попадании ее на кожные покровы следует тщательно промыть их под проточной водой, после чего обратиться за медицинской помощью.
Перевозка реагента должна осуществляться в специальном транспорте, оборудованном железными цистернами, не поддающимися ее разрушительному влиянию. Ее можно перевозить и при помощи других транспортных средств, как сухопутных, так и водных. Но при этом должны быть соблюдены все правила техники безопасности.
Хранить ее следует в месте, защищенном от прямого попадания солнечных лучей. Срок хранения при таких условиях составляет не больше 1 года.
Использование кислоты
Применение фосфорной кислоты достаточно широкое. Стоит рассмотреть наиболее популярные методы ее использования.
В медицине
Ее применяют в стоматологии во время пломбирования зубов для протравливания эмали непосредственно перед началом процесса. Эта процедура имеет свои негативные стороны, т. к. контролировать глубину и стадию расщепления эмали невозможно, как и их полное удаление перед пломбированием. Оставшееся после такой процедуры вещество может уменьшить прочность защиты и привести к образованию кислотных остатков на эмали зуба. Эта кислота добавляется в малых дозах в зубные отбеливатели.
Удаление ржавчины с поверхности металла погружным методом и поверхностным нанесением. Преобразователь ржавчины
Преимущество удаления ржавчины ортофосфорной кислотой состоит в том, что она убирает коррозию с металла и создает тонкую пленку на них, защищая от разных внешних воздействий. После покрытия этим веществом металлической поверхности начинается активный процесс разъедания и поглощения оксида железа. Затем на плоскости металла образуется серая пленка маслянистой консистенции.
Существуют различные методы удаления окислов, среди которых можно выделить следующие:
Преобразователь коррозии – это кислотный раствор с различными добавками. Существуют такие виды растворов, в зависимости от используемых в их составе добавок:
К 1 типу относится грунтовка ЭВА-0112, состоящая из основного компонента и 85% раствора вещества. Она выступает основой под покраску.
В состав преобразователя «Цинкарь» входит кислота и соли марганца и цинка. При его применении ржавчина трансформируется в плотный защитный слой. Происходит процесс легирования.
Ортофосфорная кислота для металла
Для очистки или для пайки металлических элементов необходимо проделать следующие операции. Перед полным погружением металлического элемента в ортофосфорный состав, его вначале зачищают от разных видов налета на поверхности, в частности от жиров. Для этого следует промыть деталь с использованием чистящего средства. После этого необходимо растворить 150 мл вещества в 1 л воды и опустить в этот раствор металлический элемент на 1 час, время от времени размешивая жидкость для большей эффективности.
Затем необходимо смыть смесь раствором, который состоит из 50% воды, 2% нашатырного спирта и 48% этанола. После этого элемент нужно ополоснуть под струей водой и хорошо высушить.
Перед тем как нанести распылитель на поверхность валиком или кистью, следует предварительно зачистить поверхность от ржавчины. После нанесения следует немного подождать, а затем смыть смесь нейтрализующим раствором и высушить деталь.
Такие процедуры можно проводить с разными металлами, в т. ч. и алюминием.
Применение в сельском хозяйстве
В сельском хозяйстве используют фосфорную кислоту, добытую из руды, в качестве удобрения. При попадании в грунт, а затем в растения, она помогает им перенести засуху и морозы. При этом почва становится более плодородной и благоприятной для выращивания овощных культур и зелени.
Применение кислоты в быту и пищевой промышленности
Применение кислоты в быту подразумевает ее использование для удаления коррозии с различных поверхностей (за исключением акриловых). Он подходит для обработки эмалированных и фаянсовых поверхностей. Перед нанесением раствора ортофосфорной кислоты металлическую поверхность необходимо обработать моющим средством. Для приготовления раствора следует смешать 1 л воды и 200 г действующего вещества, а затем нанести смесь на обрабатываемую плоскость на 1-12 часов. По прошествии времени смесь необходимо погасить содовым раствором и смыть.
В пищевом производстве применяется как регулятор кислотности.
Техника безопасности при работе с кислотой
При попадании жидкости на слизистые оболочки и кожные покровы может возникнуть головокружение, кашель, рвота, химический ожог. В таком случае следует вызвать врача, промыть пораженный участок, сделать свободную повязку и осуществить нейтрализацию фосфорной кислоты щелочью.
Как правильно хранить и перевозить кислоту
При хранении и транспортировке кислоты следует соблюдать необходимые условия. Хранить ее разрешено только в специальных емкостях:
Фосфорная кислота – агрессивное вещество, в связи с чем порошок следует содержать в изолированной таре. В кислоту не должно попадать инородных веществ. Тара для перевозки и хранения должна быть сухой и чистой.
Чтобы раствор имел нужные свойства, следует соблюдать все условия. При некачественном составе возможно выделение токсичных паров. Помимо всего прочего, такой раствор не сможет защитить поверхность металла от негативного влияния окружающих факторов.
Наиболее подходящее для хранения место – сухое и теплое. Не подойдут для этой цели сырые места, в которых образуется большое количество конденсата. Нежелательно пересыпать порошкообразное средство в другие емкости. Лучше всего хранить его в первоначальной упаковке.
Т. к. это вещество принадлежит к разряду опасных, то при его перевозке на дальние расстояния требуется заполнение сопроводительной документации.
Срок хранения фосфорной кислоты составляет 1 год с момента изготовления.
Температура замерзания 85% раствора составляет – 21°С. Температура плавления + 42°С.
Читайте также:
Как чистят семечки на производстве, зависит от того, какие семена требуется избавить от несъедобной части.…
Характер фосфорной кислоты: химические и физические свойства
Фосфорная кислота H 3 P O 4
В степени окисления +5 фосфор способен образовывать определенные кислоты:
Ортофосфорная кислота (фосфорная кислота) является неорганической трехосновной кислотой средней силы. Чистое вещество представляет собой прозрачные гигроскопические кристаллы.
Химическая формула фосфорной кислоты:
Во многих случаях в химии фосфорной кислотой называют ее водный раствор с концентрацией 85%. Такая жидкость напоминает сироп и не обладает запахом. Соединение характеризуется высокой степенью растворимости в этаноле и других растворителях. Строение фосфорной кислоты выражает структурная формула:
При стандартных условиях, то есть температуре 25 °C и давлении 1 атм, фосфорная кислота характеризуется классом опасности Н290, Н314.
Фосфорная кислота не обладает специфическим токсическим эффектом. Показатели системной токсичности вещества достаточно невысокие. Раствор фосфорной кислоты оказывает раздражающее воздействие на органы зрения и дыхания, слизистые оболочки. Если концентрация соединения превышает 10%, смесь характеризуется раздражающим эффектом, а при 25% содержания вещества раствор вызывает коррозию.
Диссоциация фосфорной кислоты в водных растворах протекает ступенчато:
С каждой новой ступенью диссоциация ослабевает. Полного распада на ионы у фосфорной кислоты не наблюдается. Вещество характеризуется меньшей активностью в процессе химического взаимодействия, по сравнению с серной, азотной, соляной кислотами.
Химические и физические свойства
Физические свойства фосфорной кислоты:
В твердом состоянии вещество гигроскопично и способно расплываться в воздушной среде. Фосфорная кислота смешивается с водой в любых соотношениях. Наиболее распространены следующие концентрации раствора:
Молекулы фосфорной кислоты, находящейся в твердом состоянии или в виде концентрированного раствора, соединены водородными связями.
Фосфорная кислота является трехосновной кислотой средней силы. В водных растворах соединение диссоциирует по трем ступеням c константами диссоциации:
Сопровождается выделением теплоты только диссоциация по первой ступени (экзотермическая). По второй и третьей ступени теплота поглощается, то есть процесс является эндотермическим:
В результате фосфорная кислота может образовывать как средние соли (фосфаты), так и кислые (гидрофосфаты и дигидрофосфаты).
Соединение проявляет свойства кислоты, не являющейся окислителем, при вступлении в реакции с такими веществами, как:
Нагрев фосфорной кислоты сопровождается отщеплением воды. В результате образуются пирофосфорная кислота и метафосфорная кислота:
2 H 3 P O 4 → H 2 O + H 4 P 2 O 7 ;
Ортофосфорная кислота отличается от других фосфорных кислот взаимодействием с нитратом серебра. В результате этой реакции можно наблюдать выпадение осадка с желтой окраской. Если в реакции участвуют другие фосфорные кислоты, то цвет осадка будет белым:
Качественная реакция на ион H 2 Р О 4 представляет собой процесс формирования молибденофосфата аммония в виде осадка с ярко-желтой окраской:
H 3 P O 4 + 12 [ N H 4 ] 2 M o O 4 + 21 H N O 3 → [ N H 4 ] 3 P M o 12 O 40 · 6 H 2 O ↓ + 21 N H 4 N O 3 + 6 H 2 O
Основные способы получения
Первым фосфорную кислоту синтезировал Роберт Бойль в 1694 году, используя в реакции оксид фосфора(V).
В лабораторных условиях соединение получают в процессе окисления фосфора с помощью азотной кислоты:
Основные промышленные методы синтеза фосфорной кислоты:
Технология производства фосфорной кислоты, основанная на термическом методе, предполагает сжигание фосфора до оксида фосфора(V), который затем взаимодействует с водой:
4 P + 5 O 2 → 2 P 2 O 5 ;
На практике используют разные способы для реализации данного химического взаимодействия.
IG-процесс (по названию компании IG) предполагает проведение этих реакций в одной реакционной колонне. В нее с помощью сжатого воздуха или пара под давлением 1,5 МПа сквозь сопло перекачивают фосфор, температура сгорания которого составляет больше 2000 °C.
Полученный в результате процесса оксид фосфора(V) поглощается фосфорной кислотой, стекающей с верхней части по стенкам колонны. Таким образом, стенки колонны полностью покрываются кислотой. Вещество выполняет сразу несколько функций:
Образованная фосфорная кислота концентрируется в отсеке в нижней части колонны. Соединение транспортируется по теплообменнику, поступает в верхнюю часть колонны и вновь стекает по стенкам.
Оборудование, используемое в химической промышленности для синтеза фосфорной кислоты, изготовлено из нержавеющей низкоуглеродной стали. Этот материал стабилен и не вступает в реакции с концентрированной фосфорной кислотой при температуре, не превышающей 100 °C.
Полученную кислоту очищают от примесного мышьяка, для которого характерно присутствие в небольших концентрациях даже в очень чистом фосфоре. Такая очистка производится с помощью воздействия сероводорода (его получают путем добавления сульфида натрия в фосфорную кислоту) и фильтрования после выпадения в осадок сульфида мышьяка.
Данные химические реакции лежат и в основе TVA-процесса (от Tennessee Valley Authority). Отличие от предыдущей технологии заключается в том, что сжигание фосфора и поглощение оксида фосфора(V) реализуются по отдельности.
Фосфор и воздух подают в стальную камеру сгорания, которая дополнена внешним охлаждением. Затем продукты сгорания транспортируют через верхнюю часть камеры в отсек поглощения для дальнейшего образования фосфорной кислоты.
В Хехст-процессе (по названию компании Hoechst) реакции сгорания и поглощения разделены. Отличие данной технологии синтеза фосфорной кислоты от других методов заключается в использовании теплоты, которая выделяется в процессе сгорания фосфора, для генерирования пара.
При реализации экстракционного метода синтеза фосфорной кислоты природные фосфаты обрабатывают с помощью неорганических кислот. В распространенных случаях с этой целью используют хибинский апатитовый концентрат и фосфориты Каратау.
Обработка фосфатов активно применялась в промышленности еще в середине 1880-х годов. Данное направление начало развиваться после Второй мировой войны, что объяснялось высоким спросом на минеральные удобрения в сельском хозяйстве.
Процесс экстракционного получения фосфорной кислоты. Уравнение схемы разложения сырья, где параметр x может быть равен от 0,1 до 2,2:
Существует также ангидритный метод, который предполагает выпадение в осадок безводного сульфата кальция. Технология не применяется в промышленном производстве фосфорной кислоты, что объясняется возникновением серьезных коррозийных проблем.
Классическая технология синтеза фосфорной кислоты — дигидратный процесс. Достоинство данного метода заключается в относительно низкой температуре, что исключает образование коррозии. При реализации технологии допустимо использовать разное фосфатное сырье и осуществлять его переработку в больших объемах.
Гемигидратный процесс был разработан с целью исключить необходимость концентрировать образованную фосфорную кислоту. Отличием этого метода синтеза является более высокая температура, которая достигает 80–100 °С. При этом создаются условия для более стабильной формы продукта, образующегося в виде гемигидрата сульфата кальция. Концентрация полученной фосфорной кислоты составляет в результате 40–48 %.
Гемигидратно-дигидратный процесс является разработкой японских ученых. С помощью данной технологи удается получить почти чистый гипс, залежи которого в Японии отсутствуют. Сырье обрабатывают при высокотемпературном воздействии. В результате формируется гемигидрат сульфата кальция, который в дальнейшем перекристаллизовывают в дигидрат.
Процесс концентрирования фосфорной кислоты, которую получают по дигидратной технологии, заключается в вакуумном испарении. На устаревших производствах применяют погружное горение. В некоторых случаях в определенной последовательности применяют несколько испарителей. В результате пары с одного испарителя используются, чтобы нагревать раствор в следующем испарителе.
Способы удаления разных неорганических примесей:
В осадке остаются примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты) и некоторые другие металлы.
Процесс экстракции основан на переходе фосфорной кислоты в органическую фазу. Далее вещество промывают водой. В результате происходит удаление катионных и анионных примесей. Отделение фосфорной кислоты от растворителя достигается перегонкой.
Основным поставщиком (и потребителем) экстракционной фосфорной кислоты являются США. В данном случае доля от общего объема производства соединения равна 90 %. В 1980-е годы отмечено снижение запасов производимой фосфорной кислоты в результате отказа от фосфорсодержащих детергентов и минеральных удобрений. Данное решение объясняется загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоемов.
Экстракционная технология синтеза фосфорной кислоты предполагает формирование отвалов сульфата кальция: на 1000 килограмм P 2 O 5 получают 4,5—5,5 тонны загрязненного сульфата кальция, который нуждается в утилизации. По состоянию на 2008 год существовало несколько способов:
В процессе погружения в водоемы растворение сульфата кальция протекает активно. Показатели растворимости вещества в морской воде составляют 3,5 г/л, а природное содержание равно 1,6 г/л. Примеси оксида кремния и оксида алюминия не растворяются.
Где используется, области применения
Фосфорную кислоту используют в качестве флюса в процессе пайки (по окисленной меди, по черному металлу, по нержавеющей стали).
Соединение применяют для проведения научных экспериментов в лабораторной практике.
С помощью вещества удаляют ржавчину с металлических поверхностей. В результате такой обработки образуется защитная пленка, которая служит барьером для коррозионных процессов.
Фосфорную кислоту используют в составе фреонов, в промышленных морозильных установках в качестве сильного связующего компонента.
В авиации ортофосфорная кислота входит в состав гидрожидкости НГЖ-5У и ее иностранных аналогов.
В пищевой промышленности вещество используют, как пищевую добавку E338. Ортофосфорная кислота регулирует уровень кислотности в газированных напитках таких, как Кока-Кола. На вкус слабый водный раствор ортофосфорной кислоты с небольшим содержанием сахара похож на крыжовник.
В области звероводства, в частности, на фермах, где разводят норок, путем подкормки раствором ортофосфорной кислоты предотвращают повышение кислотности в желудке и развитие мочекаменной болезни.
Вещество при использовании в гидропонных системах позволяет контролировать уровень pH питательного раствора.
Ортофосфорная кислота нашла широкое применение в стоматологии. С помощью этого вещества протравливают эмаль и дентин, то есть снимают смазанный слой, перед наложением пломбы на зубы.
Применение ортофосфорной кислоты
Нередко металл и изделия из него подвергаются характерной «болезни», которая проявляется в виде рыжего налета, разъедающего металл. Речь идет о ржавчине. Ее образование происходит благодаря воздействию на поверхность металлического изделия углекислого газа, кислорода и воды. Безусловно, для того чтобы продлить срок службы изделия из металла необходимо как можно скорее начать борьбу с коррозией. Помочь в этом может обработка ортофосфорной кислотой.
Характеристики ортофосфорной кислоты
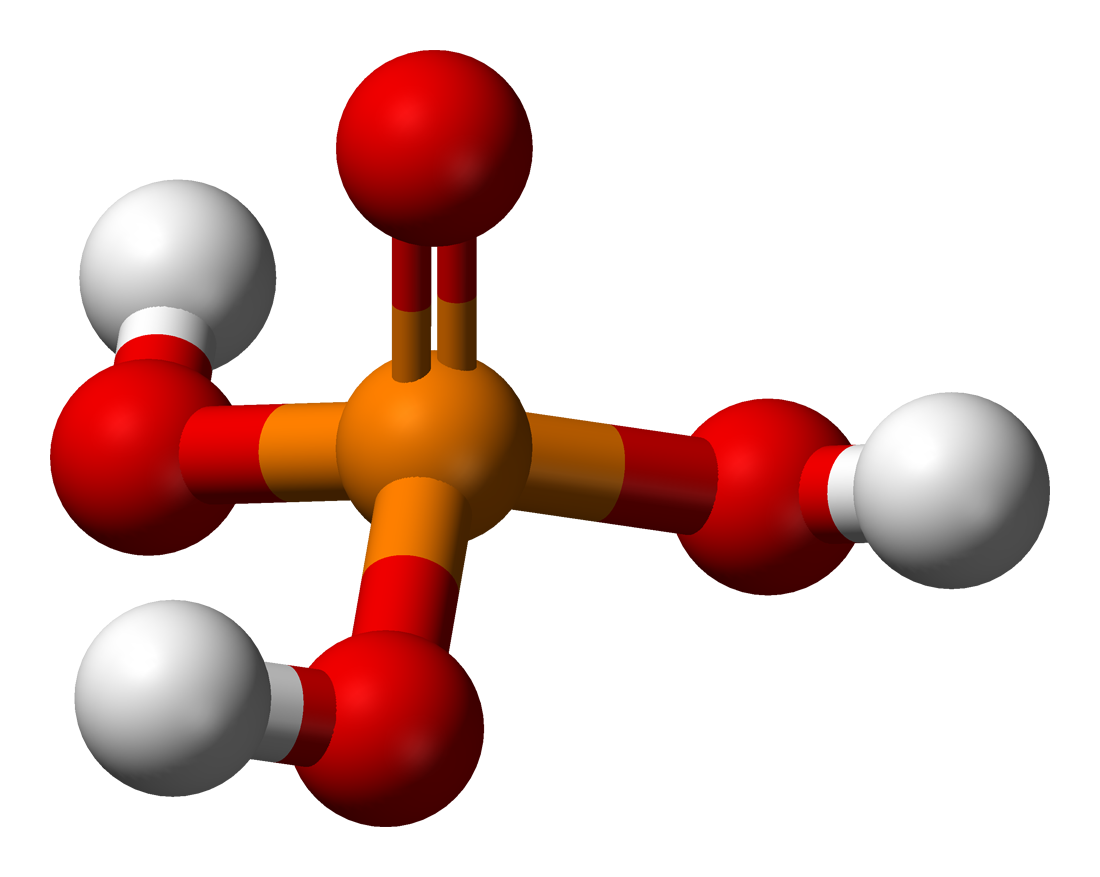
Ортофосфорная или попросту фосфорная кислота представляется в виде продукта, имеющего неорганическое происхождение. В условиях нормальной комнатной температуры ортофосфорная кислота имеет вид небольших ромбовидных кристалликов.
Чаще всего же ортофосфорная кислота имеет вид сиропообразного 85%-процентного раствора, не имеющего характерного запаха. Кристаллики ортофосфорной кислоты довольно хорошо растворяются в воде или этаноле.
Уравнение ортофосфорной кислоты
Применяется ортофосфорная кислота в следующих отраслях человеческой деятельности:
Если температура окружающей среды, например, в условиях лабораторных исследований превышает показатели в 213 градусов Цельсия, ортофосфорная кислота преобразуется в пирофосфорную кислоту. Состав ортофосфорной кислоты и ее химическая формула, соответственно, изменяется.
Таблица 1. Физико-химические показатели ортофосфорной кислоты согласно ГОСТ 10678-76.
| Наименование показателя | Норма | ||
|---|---|---|---|
| Марка А | Марка Б | ||
| 1-й сорт | 2-й сорт | ||
| 1. Внешний вид | Бесцветная жидкость прозрачная в слое 15-20 мм при рассмотрении на белом фоне | Бесцветная или со слабо-желтым оттенком жидкость в слое 15-20 мм при рассмотрении на белом фоне | Бесцветная или окрашенная жидкость с оттенком от слабо-желтого до коричневого, не прозрачная в слое 15-20 мм при рассмотрении на белом фоне |
| 2. Массовая доля ортофосфорной кислоты (H3PO4), %, не менее | 73 | 73 | 73 |
| 3. Массовая доля хлоридов, %, не более | 0,005 | 0,01 | 0,02 |
| 4. Массовая доля сульфатов, %, не более | 0,010 | 0,015 | 0,020 |
| 5. Массовая доля нитратов, %, не более | 0,0003 | 0,0005 | 0,0010 |
| 6. Массовая доля железа, %, не более | 0,005 | 0,010 | 0,015 |
| 7. Массовая доля тяжелых металлов сероводородной группы, %, не более | 0,0005 | 0,002 | 0,005 |
| 8. Массовая доля мышьяка, %, не более | 0,0001 | 0,006 | 0,008 |
| 9. Массовая доля восстанавливающих веществ, %, не более | 0,1 | 0,2 | Не нормируется |
| 10. Наличие метафосфорной кислоты | Выдерживает испытание | ||
| 11. Массовая доля взвешенных частиц, %, не более | Выдерживает испытание | 0,3 | |
| 12. Наличие желтого фосфора | Выдерживает испытание | Не нормируется | |









 Современная наука довольно часто позволяет использовать одно и то же химическое вещество или один и тот же химический состав в совершенно различных целях. То же самое можно сказать и о вариантах применения ортофосфорной кислоты.
Современная наука довольно часто позволяет использовать одно и то же химическое вещество или один и тот же химический состав в совершенно различных целях. То же самое можно сказать и о вариантах применения ортофосфорной кислоты. Как и любая другая кислота, ортофосфорная требует от человека предельной внимательности, аккуратности и выполнения всех правил безопасности при работе с кислотами.
Как и любая другая кислота, ортофосфорная требует от человека предельной внимательности, аккуратности и выполнения всех правил безопасности при работе с кислотами. Ортофосфорная кислота, влияние которой на ржавчину широко известно, может применяться как в промышленных масштабах, так и для удаления коррозии металла в домашних условиях. Разумеется, что подобные действия должны проводиться с учетом описанных выше правил безопасности.
Ортофосфорная кислота, влияние которой на ржавчину широко известно, может применяться как в промышленных масштабах, так и для удаления коррозии металла в домашних условиях. Разумеется, что подобные действия должны проводиться с учетом описанных выше правил безопасности. Учитывая, что существует несколько вариантов очищения металла с применением ортофосфорного соединения, следует рассмотреть каждый из них подробнее.
Учитывая, что существует несколько вариантов очищения металла с применением ортофосфорного соединения, следует рассмотреть каждый из них подробнее.

