для чего используют кобальт
Кобальт (Co, Cobaltum)
История кобальта
С историей открытия кобальта связано немало легенд и преданий, в средние века люди были уверены, что здесь не обошлось без вмешательства нечистой силы. Ведь недаром название кобальт происходит от немецкого Kobolt – зловредный карлик, маленький гном, который строил всяческие козни, мешая рудокопам Саксонии заниматься добычей руды и выплавкой металла. Некоторые руды, добытые в Саксонии, имели серебристый цвет и поначалу считались серебром. Но металл, получаемый из этих руд, давал ядовитые пары, которыми неоднократно были отравлены рудокопы (calorizator). В 1735 году химик из Швеции Георг Брандт выделил из «руды нечистой силы» металл серебристо-розоватого оттенка, который был назван кобольд. Впоследствии название преобразовалось в известное и привычное нам.
Общая характеристика кобальта
Кобальт является элементом IX группы IV периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 27 и атомной массой 58,9332. Признанное обозначение кобальта – Co (от латинского Cobaltum).
Нахождение в природе
Кобальт не сильно распространённый металл, скорее его можно отнести к редким, в земной коре присутствует в минимальных количествах. Насчитывается не более 30-ти минералов, в составе которых находится кобальт. Самое большое месторождение кобальта находится в Демократической Республике Конго, имеются залежи в США, Франции, Канаде и России.
Физические и химические свойства
Кобальт является твёрдым металлом серебристо-белого цвета, со слегка розоватым (реже – синим) отливом. При взаимодействии с воздухом окисление происходит при высоких температурах (300˚С и выше).
Суточная потребность в кобальте
Суточная потребность в кобальте очень невелика, обычно составляет 0,1 – 0,8 мг для здорового взрослого человека. Обычно дневную норму кобальта человек получает из пищи.
Продукты питания богатые кобальтом
Основные источники кобальта:
Признаки нехватки кобальта
Признаками нехватки в организме человека кобальта являются участившиеся заболевания системы кровообращения и эндокринной. Причиной недостатка кобальта обычной служат хронические заболевания органов пищеварения (гастрит, язва двенадцатиперстной кишки).
Применение кобальта в жизни
Кобальт нашёл широкое применение в виде сплавов – в металлургической промышленности для повышения жаропрочности стали, в производстве магнитов, как состав красителей – в изготовлении стекла и керамики.
Полезные свойства кобальта и его влияние на организм
Кобальт – один из жизненно важных микроэлементов, присутствие его в организме человека обязательно. Кобальт входит в состав витамина В12, принимает участие в синтезе ДНК и аминокислот, в расщеплении белков, жиров и углеводов. Активно влияет на обменные процессы организма, особую роль играет в кроветворении – стимулирует рост и развитие эритроцитов. Кобальт поддерживает нормальную деятельность поджелудочной железы и регуляцию активности адреналина.
Кобальт – чем интересен и где используется металл
Название этого элемента восходит к немецким сказкам. Его свойства оценили производители особо прочных сталей и декораторы.
Что представляет собой
Кобальт – это сверкающий сизовато-серый металл. Покрывается оксидной пленкой на воздухе, становясь желтоватым. Плотный, твердый, вязкий.
По классификации его относят к металлам «тяжелой» группы.
Международное обозначение – Co.
Как был открыт
У химического элемента и термина «кобальт» интересная, даже мистическая, аура.

Наука
Официальная история открытия начинается со Швеции первой трети 18 века. Ученый Георг Брандт вычленил из руды серый с розоватостью металл, окрестив его кобольдом (кобальтом).
Заодно убедился, что синий цвет стекломассы – заслуга именно этого элемента.
Древний мир
Хотя о таком свойстве металла кобальт знали еще жители Древнего Египта, Месопотамии и Вавилона. Они наловчились окрашивать минералы: изготовление «бирюзы», «сапфиров» процветало.
Кобальтовое стекло найдено в гробницах египетских фараонов и ассирийской знати.
Почти промышленного уровня достигла эта технология в Китае. С 7 века здесь совершенствуется декорирование фарфора такими красками.
Европейский фольклор
Происхождение названия металла имеет немецкие корни. Кобольдами называют персонажей немецкого фольклора – жителей подземелий, коварных карликов-гномов. Они якобы постоянно строили козни саксонским рудокопам.
Руда, принимаемая за серебряную, не всегда оказывалась таковой после выплавки. К тому же процесс получения сопровождался выбросом ядовитых паров, которыми травились люди. Всю вину перекладывали на гномов.
Такую руду, «серебряную обманку», именовали кобольдом.
Минералоги предполагают, что в виду имелись кобальтовые минералы с мышьяком в составе либо сульфиды металла.
Первые в Европе кобальтовые красители изготовили в 1800 году.
Нахождение в природе
Самородный металл кобальт на планете не встречается. Форма нахождения в природе – руда либо минералы.
Их три десятка: каролит, кобальтин, смальтит, сферокобальтит, другие.
Массовое содержание металла кобальт в земной коре – 4х10-3%. Морская вода беднее на семь порядков (в 10 миллионов раз).
Физико-химические характеристики
Важные для человека физические свойства металла – высокая температура плавления, кипения, плотность, твердость, препятствование размагничиванию.
| Свойства атома | |
|---|---|
| Название, символ, номер | Кобальт / Cobaltum (Co), 27 |
| Атомная масса (молярная масса) | 58,933194(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d7 4s2 |
| Радиус атома | 125 пм |
| Химические свойства | |
| Ковалентный радиус | 116 пм |
| Радиус иона | (+3e) 63 (+2e) 72 пм |
| Электроотрицательность | 1,88 (шкала Полинга) |
| Электродный потенциал | E0(Co2+/Co) = −0,277 В |
| Степени окисления | 3, 2, 0 |
| Энергия ионизации (первый электрон) | 758,1 (7,86) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,9 г/см³ |
| Температура плавления | 1768 K |
| Температура кипения | 3143 K |
| Уд. теплота плавления | 15,48 кДж/моль |
| Уд. теплота испарения | 389,1 кДж/моль |
| Молярная теплоёмкость | 24,8 Дж/(K·моль) |
| Молярный объём | 6,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,505 c=4,089 Å |
| Отношение c/a | 1,632 |
| Температура Дебая | 385 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 100 Вт/(м·К) |
| Номер CAS | 7440-48-4 |
Благодаря им изделия из металлического кобальта отличают достоинства:
Такие характеристики сохраняются в условиях повышенных температур и перегрузок.
При обычной температуре на воздухе химические свойства металла не проявляются.
Для окисления требуется более 300°C, для разложения до оксида – значение втрое больше. При высоких температурах взаимодействует почти со всеми группами химических элементов.
Месторождения, добыча
Количество месторождений руд на планете исчисляется единицами.
Три пятых мировых запасов сырья (6 млн. тонн) приходится на одну страну мира – Конго. Государство располагается в Центральной Африке.
Другие страны с богатыми резервами (тыс. тонн):
Беднее залежи у Франции, Казахстана, США.
Добыча ведется карьерным способом.
Технология получения
Металл извлекают из руды, преимущественно никелевой. На нее воздействуют растворенным аммиаком либо серной кислотой.
Применяется электролиз и дополнительное рафинирование (для получения более чистого продукта).
Номенклатура марок металла
Металлургическая промышленность выпускает два вида продуктов из сырья – катодный металлический кобальт и порошок. Из них получают разные марки кобальта (стали).
Кобальт металлический
Идет на марки стали К0, К1, К1А, К1Ау. Из сырья выплавляют слитки, прокатывают листы для нужд химической, электротехнической промышленности.

Содержание Co колеблется от 99,98% (для К0) до 98,3% для К2.
Кобальт порошковый
Исходник для стали марки ПК-1у. Металлический продукт содержит как минимум 99,35% Co. Это порошковая масса, сформированная методом электролиза. Из нее делают аккумуляторы, гальванопокрытия, катализаторы, присадки.

Основные производители продукции из кобальта в России – «Норильский никель» и «Кольская ГМК».
Как используется
Применение кобальта незаменимо в суровых условиях: запредельные механические нагрузки, аномально высокие температуры, угроза размагничивания.
Почти весь продукт забирает промышленный комплекс. Слитки, пластины, проволока, порошок выпускаются из чистого металла, сплавов и соединений.
Сплавы
Металл добавляют к сплавам, чтобы сделать тверже. Для этого металлический порошок кобальта спекают с карбидами титана либо вольфрама.
Ассортимент из сплавов широк:
Новейшие направления использования кобальта – электроника и радиотехника. Из металла и сплавов получают компоненты печатных плат для квантовых генераторов и усилителей.
Металл
Металлический порошок кобальта добавляют к сталям для повышения жаропрочности, твердости, других кондиций.
Соединения
Соединения металла обеспечивают премиальные характеристики продукции из них:
Самое красивое применение Co-соединений – бытовой стеклянный ассортимент. Мелкая пластика, вазы, конфетницы, фужеры, фруктовницы великолепны.
Синий цвет, создаваемый добавкой порошка металла к расплавленной стекломассе, так и назвали – кобальтовым.
Другие формы
Изотоп металла искусственного происхождения кобальт-60 востребован как источник γ-излучения (гамма-нож, гамма-дефектоскопия, стерилизация).
Значение для человека
Металл кобальт – один из критически важных для человека микроэлементов.
Жизненные процессы
Он задействован в ряде процессов организма:
Им регулируется уровень адреналина.
Кобальт поддерживает метаболизм, процесс кроветворения.
Питание
Источник поступления микроэлемента в организм – продукты питания.
Входит в состав цианокобаламина (витамина B12).
Симптомы дефицита
Человеку средней комплекции необходимо 0,39 – 0,76 мг вещества ежесуточно.
О дефиците сигнализируют следующие факторы:
Усваивать кобальт мешают хронические заболевания ЖКТ (гастрит, язва двенадцатиперстной кишки).
Предостережение
О том, что кобальт и его соединения токсичны, рудокопы Саксонии знали еще пятьсот лет назад.
Наука это подтвердила, уточнив список. Канцерогенами и мутагенами признаны сульфаты металла.
Тем не менее, полвека назад некоторые пивовары использовали соли металла, чтобы плотная пена подольше «украшала» поверхность напитка в кружке. Фанаты пива получали проблемы с сердцем, иногда умирали. Подобные случаи фиксировались в Бельгии, США, Канаде. С тех пор применение таких ингредиентов официально запрещено. Другой вопрос – выполняется ли запрет.
Предельно допустимое содержание кобальта в питьевой воде – 0,01 мг на литр, пыли в воздухе – 0,51 мг на кубометр.
Смертельная доза, проверенная на крысах, – 50 мг.
Особо токсичны пары октакарбонила.
Единственный недостаток металла – дороговизна. Цену определяет ситуация на мировых рынках плюс обстановка в центре Африканского континента.
В 1970-х годах, когда в Африке было неспокойно, стоимость металла за пару лет взлетала в 20 раз.
Кобальт. Свойства кобальта. Применение кобальта
Кобольд – злой дух из скандинавской мифологии. Жители Севера верили, что демон живет в горах и строит козни их посетителям, в частности, горнякам. Кобольд не только наносил увечья, но и губил. Особенно часто помирали плавильщики серебряных руд. Позже, ученые выяснили истинную причину смертей.
Вместе с рудами серебра в скалах Норвегии хранятся кобальтосодержащие минералы. В их состав входит мышьяк. Его летучий оксид выделяется при обжиге. Вещество токсично. Вот истинный убийца. Однако, у мышьяка уже было свое имя. Поэтому в честь Кобольда назвали связанный с ним металл. О нем и поговорим.
Химические и физические свойства кобальта
По температуре плавления близок к никелю. Элемент размягчается при 1494-х градусах. Кристаллическая решетка кобальта начинает меняться при нагреве до 427-ми по шкале Цельсия. Гексагональная структура преобразуется в кубическую. До 300-от градусов металл не окисляется, будь воздух сухим или влажным.
Не вступает элемент в реакции и со щелочами, разбавленными кислотами, не взаимодействует с водой. После 300-ой отметки на шкале Цельсия кобальт начинает окисляться, покрываясь желтоватой пленкой.
От температуры зависят и ферримагнитные свойства кобальта. До 1000 градусов он способен намагничиваться произвольно. Если нагрев продолжается, металл теряет это свойство. Стоит довести температуру до 3185-ти градусов, кобальт закипит. В тонкораздробленном виде элемент способен самовоспламеняться.
Достаточно лишь контакта с воздухом. Явление называется пирофорией. В каком виде на нее способен кобальт? Цвет порошка должен быть черным. Более крупные гранулы светлее и не загораются.
Основная характеристика кобальта – тягучесть. Она превышает показатели других металлов. Тягучесть сочетается с относительной хрупкостью, уступающей, к примеру, стали. Поэтому, металл с трудом куется. Ограничивает ли это применение элемента?
Применение кобальта
В чистом виде пригождается лишь радиоактивный изотоп элемента 60 Со. Он служит источником излучения в дефектоскопах. Это приборы, просвечивающие металлические изделия на предмет трещин и иных недочетов в них.
Медики тоже используют радиоактивный кобальт. Сплав методов ультразвуковой диагностики, терапии тоже зиждется на инструментах, в которые добавлен 27-ой элемент таблицы Менделеева.
Дуэт железо-кобальт фигурирует в некоторых марках нержавеющей стали. Они – конструктивный материал для атомных реакторов. Чтобы сталь стала подходящей для их производства, достаточно всего 0,05% 27-го элемента.
Больше кобальта примешивают к железу при изготовлении постоянных магнитов. В качестве лигатуры в сплавы добавляют никель, медь, лантан и титан. Наилучшие магнитные свойства имеют кобальтоплатиновые соединения, но они дорогостоящи.
Кобальт купить металлурги стремятся и для производства сплавов, устойчивых к воздействию кислот. Они нужны, к примеру, для нерастворимых анодов. В них 75% 27-го элемента, 13% кремния, 7% хрома и 5% марганца. По стойкости к соляной и азотной кислотам этот сплав превосходит даже платину.
Оксид кобальта, так же, активно используют в лакокрасочной сфере, производстве стекла и керамики. Сплавляясь с эмалью, закись металла образует силикаты и алюмосиликаты синих тонов. Наиболее известна смальта.
Это двойной силикат калия и кобальта. Фото одного из кувшинов, найденных в гробнице Тутанхамона, интересно археологам именно, как доказательство использования солей и оксидов 27-го элемента древними египтянами. Ваза расписана узорами синего цвета. Анализ показал, что в качестве красителя использован кобальт.
Добыча кобальта
Разведанных залежей кобальта должно хватить человечеству на 100 лет. С учетом океанических ресурсов, можно не испытывать дефицит элемента 2-3 столетия. На кобальт цены устанавливает Африка. В ее недрах сосредоточены 52% мировых запасов металла.
Еще 24% сокрыты в Тихоокеанском регионе. На Америку приходятся 17, а на Азию 7%. В последние годы разведаны крупные месторождения в России и Австралии. Это несколько изменило картину поставок 27-го элемента на мировой рынок.
Цена кобальта
Лондонская биржа цветных металлов. Вот где устанавливают мировые цены на кобальт. Отзывы о торгах и официальные сводки свидетельствуют, что за фунт просят около 26 000 рублей. Фунт – английская мера веса, равная 453-ем граммам. Рост стоимости 27-го элемента непрерывен начиная с 2004-го года.
С 2010-го года на Лондонской бирже начали торговать лотами по 1-ой тонне. Металл поставляется в стальных бочках по 100-500 килограммов. Весовое отклонение партии не должно превышать 2%, а содержание кобальта требуется на уровне 99,3%.
Металл успешен не только сам по себе. В тренде и цвет 27-го элемента. Не зря выпущен, к примеру, Шевроле Кобальт. Как и самородный металл, машина окрашена в серебристо-синеватый. Благородный окрас подчеркивает европейский характер машины. В базовой комплектации за нее просят около 600 000 рублей.
В эту сумму входит подогрев передних сидений. Задние складываются. Салон тканевый, в строю стеклоподъемники. Аудиоподготовка штатная. Можно купить машину, а можно почти 27 фунтов настоящего кобальта, — кому что нужнее.
Кобальт — металл, востребованный в промышленности и необходимый организму
Кобальт, Co — металл, простой элемент таблицы Менделеева. Как и никель, назван 
Впервые кобальт был получен в 1735-м году, но с самим веществом человечество имело дело с давних пор. В Древнем Египте, Китае, Вавилоне, Ассирии умели выплавлять стекло и эмаль ярко-синего «кобальтового» цвета, используя секретные ингредиенты из руд, как теперь известно, содержавших этот металл.
Кобальт встречается почти в тридцати различных минералах как сопутствующий элемент никеля, железа, меди, хрома, марганца. Месторождений, богатых Co, мало, и они почти все уже выработаны, поэтому добывают металл, чаще всего, из никелевых руд, в которых он присутствует как примесь.
Свойства
Тяжелый твердый металл серебристого цвета с оттенками розового, желтого, голубого цветов. Тверже железа, тягучий, но хрупкий. Существует в двух вариантах кристаллической решетки. Ферромагнетик. В виде мелкодисперсионного порошка самовоспламеняется на воздухе.

При нагревании кобальт вступает в реакции с водой, кислородом, галогенами, серой, мышьяком, фосфором, углеродом, азотом, кремнием, водородом, селеном.
Взаимодействие с неконцентрированными кислотами приводит к образованию водорастворимых солей: хлорида, нитрата, сульфата кобальта. Кобальт (III) образует устойчивые комплексные соединения, содержащие молекулы аммиака и некоторых других органических аминов.
Воздействие на организм
Относится к веществам, необходимым для нормального функционирования человеческого организма. Участвует в кроветворении, в работе печени, поджелудочной железы, нервной и иммунной системы, обменных процессов; входит в состав молекулы витамина В12; необходим для существования микрофлоры кишечника. Растениям он нужен для фиксации азота, добываемого из воздуха.
Человеку, животным и растениям кобальт требуется в микродозах. Обычно суточную норму человек получает с пищей. Недостаток и избыток кобальта вызывают заболевания.
Пары и пыль соединений кобальта, попавшие в органы дыхания человека, способны вызвать отравление. Его симптомами являются кровотечение, отек легких, повышенное давление, сбои в работе сердца и щитовидной железы. В этом случае требуется врачебная помощь. Для предотвращения отравлений на производствах следует следовать технике безопасности, применять средства защиты органов дыхания и кожи.
Применение
— В металлургии для получения термостойких, тугоплавких, особо твердых, 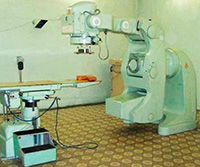
— Сплавы с магнитными свойствами идут на изготовление различных электротехнических и электронных приборов, головок для магнитной записи, постоянных магнитов.
— В химической промышленности хлорид кобальта используется как катализатор в органическом синтезе бензола, в производстве соды, азотной кислоты, сульфата аммония. В качестве катализатора применяют и порошковый реактив.
— В аналитической химии как индикатор некоторых соединений.
— Оксид и другие соединения Co востребованы в изготовлении стекол и керамики, эмалей, пигментов, красителей, лакокрасочной продукции.
— В сельском хозяйстве, ветеринарии и фармацевтике — элемент микроудобрений, кормовых добавок для скота, животных, пчел, некоторых лекарств для людей.
— Изотоп 60Со очень важен как источник гамма-излучения. Он применяется в дефектоскопах; в установках для лечения злокачественных опухолей; для стерилизации лекарств, продуктов питания, инструментов; для уничтожения вредителей в зерно- и овощехранилищах; как топливо в радиоизотопных батареях (например, для космических аппаратов). Короткоживущие изотопы 56Co, 57Со, 58Со применяются в медицинских исследованиях как изотопные метки.









