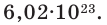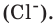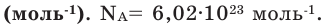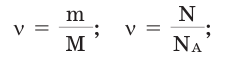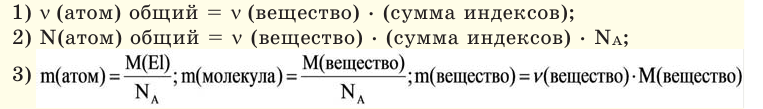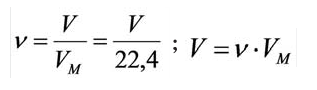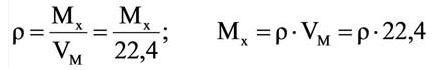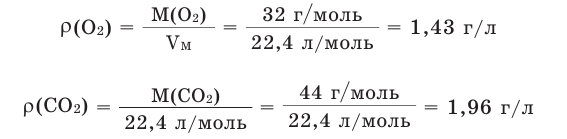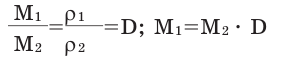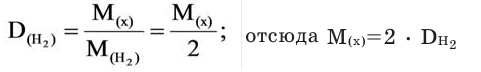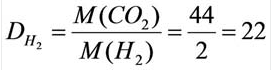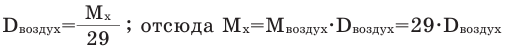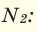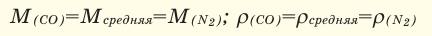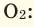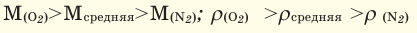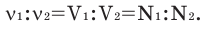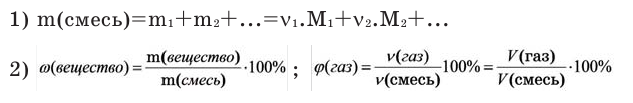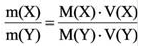для чего нужна молярная масса
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
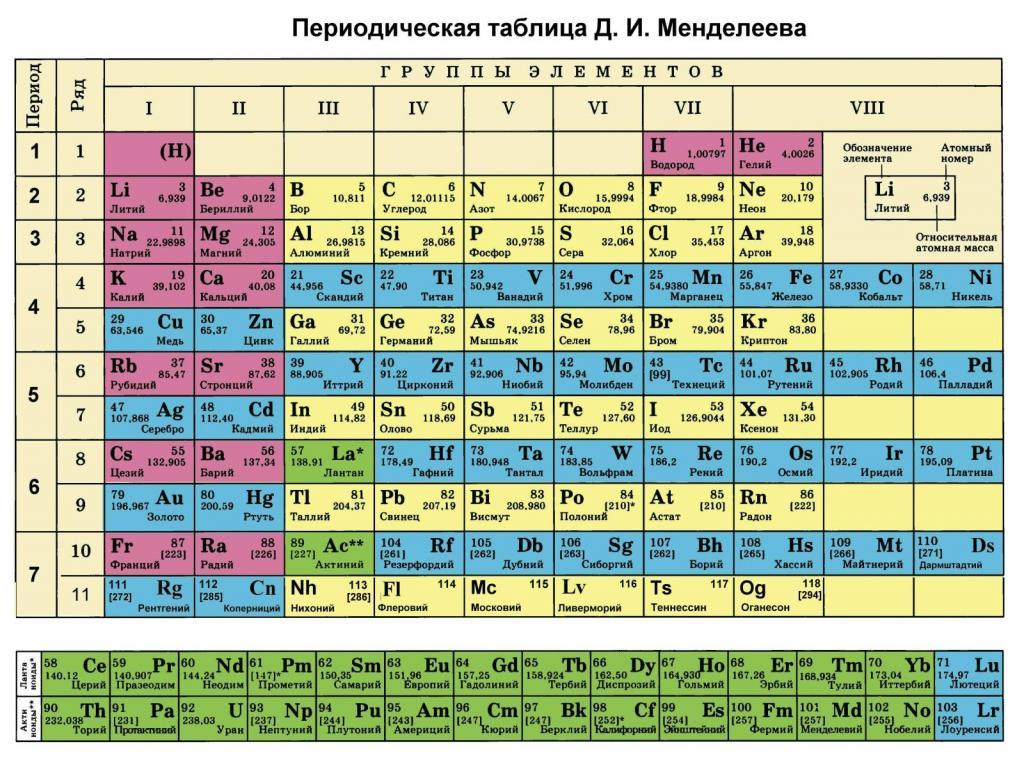
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
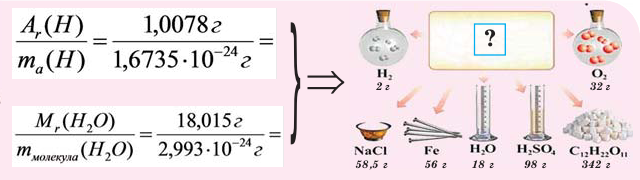
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Что такое молярная масса? Молярная масса в химии и физике газов
Каждый школьник, который внимательно изучал таблицу Менделеева, наверняка заметил, что, помимо номера химического элемента, в ней присутствует информация о весе его атома. В данной статье рассмотрим, что такое молярная масса и где она используется.
Что такое моль?
Прежде чем ответить на вопрос «что такое молярная масса», необходимо разобраться с такой важной величиной в химии, как моль.
В XIX веке Амедео Авогадро, внимательно изучая закон Гей-Люссака для идеальных газов при изохорном процессе, пришел к умозаключению, что в одинаковых объемах разных веществ при идентичных условиях (температура и давление) содержится равное число атомов или молекул. Идеи Авогадро противоречили теориям того времени о химическом строении и поведении газовых субстанций, поэтому они были приняты только спустя полвека.

В начале XX века с помощью более современных технологий удалось определить количество молекул водорода в 2 граммах этого газа. Это количество получило название «моль». Сам термин был введен Вильгельмом Оствальдом, с латыни он переводится как «куча», «скопление».
В 1971 году моль стал одной из 7 основных единиц измерения в системе СИ. В настоящее время под 1 молем понимают такое количество атомов кремния, которое содержится в идеальной сфере массой 0,028085 кг. Само число частиц, соответствующее 1 моль, называется числом Авогадро. Равно оно приблизительно 6,02*1023.
Что такое молярная масса?
Как было отмечено во введении статьи, каждый элемент в периодической таблице содержит информацию о его атомной массе. Она представляет собой вес в граммах на моль. Очевидно, чтобы получить молярную массу в кг/моль, следует табличное значение разделить на 1000. Например, для ниобия под номером 41 мы видим цифру 92,9, то есть 1 моль его атомов имеет вес 92,9 грамма.
Где используется величина M в химии?
Зная теперь, что такое молярная масса, рассмотрим, где ее применяют в химии.
Понятие количества вещества и молярного веса играет важную роль при составлении химических реакций, поскольку они идут только при строгом соотношении реагентов. Для примера ниже приведена реакция сгорания водорода с образованием молекулы воды:
Видно, что 2 моль водорода, которые имеют массу 4 грамма, реагируют без остатка с 1 моль кислорода весом 32 грамма. В результате образуется 2 моль молекул воды, с показателем в 36 граммов. Из этих цифр ясно, что в процессе химических превращений масса сохраняется. В действительности же вес реагентов и продуктов превращения немного отличается. Эта небольшая разница связана с тепловым эффектом реакции. Разницу в массах можно рассчитать, если использовать формулу Эйнштейна для связи веса и энергии.
В химии понятие молярной массы также тесно связано с одноименной концентрацией. Обычно твердые вещества, которые растворимы в жидкостях, характеризуют количеством молей в одном литре, то есть молярной концентрацией.
Газы и их молярный объем
Молярная масса также связана с физикой идеальных газов. В частности, ей пользуются во время определения объема газовой системы при конкретных внешних условиях, если известно количество вещества.
Идеальные газы описываются уравнением Клапейрона-Менделеева, которое имеет вид:
Объем газа можно определить, если известны его m, температура T и давление P, по следующей формуле:
Молярным объемом называется такой, который при 0 oC и давлении в одну атмосферу занимает 1 моль любого газа. Из формулы выше можно рассчитать эту величину, она составляет 22,4 литра.
Молекулярная физика. Моль. Постоянная Авогадро. Количество вещества.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12 С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NA:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в 1 моле вещества:

Количество вещества. Моль. Молярная Масса. Формула
Количество вещества применяться для измерения макроскопических количеств веществ во многих естественных науках таких как, физика, химия, при изучении электролиза, в термодинамика, описывающая состояние идеального газа. Так как молекулы взаимодействуют независимо от их массы в количествах, кратным целым числам, то при описании химических реакций, использовать количества вещества удобнее, чем массу. Для того, чтобы понять, что такое количества вещества в химии, отметим, что у величины есть своя единица измерения.
Определение, единицы измерения, обозначение
Число аналогичных структурных единиц, содержащих в веществе (атомов, электронов, молекул, ионов и других частиц) и есть физическая величина — количество вещества. По международной системе единиц (СИ) измеряется количество вещества в [моль], [кмоль], [ммоль], при использовании в расчетах, обозначается как n (эн).
Применение, значение
В химии при написании химических уравнений, после знакомства законом постоянства массы веществ, становится понятно как использовать величину количества вещества и понятно ее значение. Например, в реакции горения водорода, его требуется 2 к 1 значению кислорода. Зная массу водорода, можно получить количества вещества кислорода, участвующего в реакции горения.
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса, т.е отношение массы вещества к количеству к количеству молей этого вещества:
где m — масса вещества, M — молярная масса вещества.
Молярная масса измерятся в [ г/моль].
Также молярная масса может быть найдена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро.
Количество вещества газообразного определяют на основе его объема:
где где V — объём газа при нормальных условиях, а Vm — молярный объем газа при тех же условиях, равный 22,4 л/моль по закону Авогадро.
Подводя итоги всех расчетов, можно вывести общую формулу для количества вещества:
Вычисления
Чтобы точнее понять, что такое количество вещества, решим простейшие задачи: какое количество вещества содержится в алюминиевой отливке, массой m = 5,4 кг?
При решении это задачи следует помнить, что молярная масса численно равна относительной молекулярной массе, для нахождения которой понадобится таблица Менделеева, округляя значения: μ = 2,7 ⋅ 10-2 кг/моль.
Таким образом, количество вещества находим путем простых вычислений:
n = m/μ = 5,4 кг/ 2,7 ⋅ 10-2 кг/моль = 2⋅ 10-2 моль.
В физике также используется данная величина. Она нужна в молекулярной физике, где проводятся вычисления давления, объема газообразных веществ по уравнению Менделеева-Клапейрона:
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

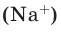

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
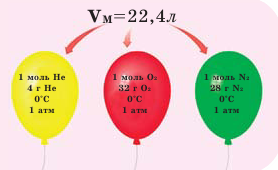
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 
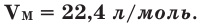
Здесь 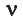
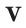
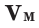
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 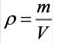
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 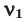
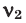
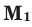
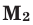

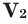
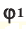
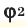
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 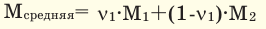
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 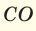
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 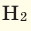
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
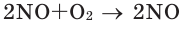
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.