для чего нужно проверять водород на чистоту
Для чего нужно проверять водород на чистоту?
Для чего и как проверяют водород на чистоту?
Каким пламенем горит водород?
Каким образом можно собрать кислород?
Кислород получают разложением перманганата калия или пероксида водорода. Собирают кислород вытеснением воздуха (он тяжелее воздуха, поэтому сосуд располагают вниз дном) или вытеснением воды (он малорастворим в воде).
Как проверить есть ли водород?
Так как водород самый легкий газ, его собирают в перевернутый вверх дном сосуд. Для распознавания водорода его поджигают и по характеру звука, с которым он сгорает, определяют наличие данного газа: к отверстию перевернутого вверх дном сосуда подносят зажженную лучину.
Почему водородом опасно наполнять воздушные шары и дирижабли?
Что называют Гремучим газом?
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. …
Что будет если поджечь водород?
Что образуется при сжигании водорода?
Вода получается при горении водорода — при соединении водорода с кислородом. В ходе реакции выделяется очень большое количество энергии. Значит, водород – топливо. … Теплоту реакции горения водорода используют для сварки и резки металлов, водород и ацетилен в этом смысле похожи.
Чем опасен водород?
Насколько опасен водород? Водород менее опасен, чем бытовой природный газ. Как и природный газ, водород может взорваться, если он скапливается в закрытых местах. … Тем не менее, мы настоятельно рекомендуем соблюдать правила хранения и транспортировки водорода, описанные в ГОСТ Р 51673-2000 от 01.01.2002.
Каким образом можно собрать водород?
Собирают двумя способами : вытеснением воды и вытеснением воздуха. Водород собирают в перевернутый вверх дном сосуд, т. … водород легче воздуха.
Каким образом можно собрать углекислый газ?
Углекислый газ собирают, основываясь на том, что он тяжелее воздуха. Таким образом, пользуются методом вытеснения. Если пропускать СО2 через трубку в стакан, то этот газ будет вытеснять воздух, оставаясь в своём сосуде, т.
Как можно получить кислород в домашних условиях?
Самым хороший способ получения кислорода в домашней лаборатории: нам послужит перманганат калия и перекись водорода (низкопроцентный водный раствор перекиси водорода есть то преимущество, что процесс выделения кислорода протекает бурно при доведении ее до температуры около 70°С.
Можно ли собрать водород способом вытеснения воды Почему?
водород нерастворим в воде, ведь он имеет неполярную ковалентную связь, поэтому собирают методом вытеснения воды.
Как проверить кислород на чистоту?
Ответ: Чистота кислорода определяется путем поглощения его и анализа непоглощенного остатка. Водород удаляют пропусканием газа через трубку с окисью меди, нагретую до 300 — 400 С.
Как проверить водород на чистоту?
Чтобы проверить полученный водород на чистоту (как проверить водород на чистоту), необходимо его поджечь с помощью тлеющей лучинки. Вы услышите хлопок. Чем звук хлопка тише, тем чище водород (меньше кислорода находится в пробирке).
Содержание
Требования к чистоте водорода для топливных элементов
В Европе Директива 2014/94 / EU о развертывании инфраструктуры альтернативных видов топлива гласит, что чистота водорода, подаваемого через точки заправки водородом, должна соответствовать техническим характеристикам, включенным в стандарт ISO 14687-2. ISO 14687-2 определяет максимальные уровни примесей для частиц и некоторых газообразных примесей. Для многих соединений предельные значения очень низкие, включая общую серу (4 нмоль / моль) или монооксид углерода (200 нмоль / моль). Наименее строгие ограничения установлены для гелия (300 мкмоль / моль) и общего азота / аргона (300 мкмоль / моль). Сумма примесей должна быть менее 300 мкмоль / моль (например, чистота H 2 составляет 99,97%).
Аналитические методы анализа чистоты водорода
Поскольку предельные значения для многих примесей очень низкие, это предъявляет строгие требования к чувствительности аналитических методов. Кроме того, высокая реакционная способность некоторых примесей требует использования должным образом пассивированных систем отбора проб и анализа. Комбинация различных инструментов (например, газовая хроматография, инфракрасная спектроскопия и масс-спектроскопия) теперь необходима для охвата всех компонентов, перечисленных в ISO 14687-2. В настоящее время ряд исследовательских усилий направлен на решение существующих проблем с упором на новые многокомпонентные аналитические методы, оценку рисков для ограничения количества анализируемых примесей (например, с использованием информации из процесса производства H 2 ) и закладку метрологической основы для Анализ чистоты H 2 (,).
Как проверить водород на чистоту
В промышленности технический водород производится согласно ГОСТ 3022-80, газообразный чистый — по ГОСТ Р 51673-2000, особо чистый по — ТУ 2114-016-78538315-2008. Для каждого из этих видов водорода и для каждой марки газа, предусмотренной указанными нормативными документами, установлены конкретные нормы на массовую долю водорода в выпускаемом газе и допустимые значения различных примесей.
Также в указанных ГОСТах и ТУ дается описание методик проведения анализа по определению объемной доли водорода и примесей в производимом продукте.
Объемная доля технического водорода в пересчете на сухой газ определяется в процентах по формуле:
X— объемная доля водорода в %;
X1— объемная доля кислорода в %;
X2— объемная доля азота в %.
Для чистого газообразного водорода объемную долю водорода определяют по формуле:
X— объемная доля водорода в %;
X1— суммарная объемная доля кислорода и аргона в %;
X2— объемная доля азота в %;
X3 — объемная доля метана в %.
Суммарная объемная доля кислорода и аргона, объемные доли азота и метана определяются хроматографическим методом, основанном на извлечении и концентрировании примесей из исследуемого газа посредством низкотемпературной адсорбции с их последующим газохроматографическим разделением и детектированием по теплопроводности. Анализируемый водород используется как газ носитель.
Объемная доля кислорода в водороде определяется колориметрическим методом, в основе которого лежит окисление кислородом, содержащимся в водороде, бесцветного медноаммиачного комплекса одновалентной меди, который при этом окрашивается в синий цвет.
Объемная доля водяных паров в водороде определяется конденсационным методом, заключающимся в измерении температуры насыщения водорода парами воды при появлении инея на холодной зеркальной поверхности.
Стандарты допускают применение других методик, при условии, что они метрологически аттестованы и суммарная погрешность результатов не превышает предусмотренных стандартом норм.
Чистота водорода, полученного методом электролиза, и наличие примеси кислорода в нем может быть определена с помощью стационарных газоанализаторов различных типов, если их погрешность не превышает допускаемую соответствующим стандартом.
В лабораторных условиях
Водород — горючий газ, а соединившись с воздухом или кислородом, образует взрывоопасную смесь. Поэтому работать с водородом нужно в маске или в очках.
Если заполненный водородом прибор требуется нагреть или же нужно поджечь выходящий из него водород, необходимо проверить водород на чистоту.

Если водород загорается с еле слышным хлопком, то он чистый. Если его загорание сопровождается резким «лающим» звуком, то газ содержит воздух и он опасен.Следует проводить пробу со второй пробиркой и т.д., пока проба не будет загораться почти без звука.
Важно! Нельзя пользоваться одной и той же пробиркой.
Класс: 8
Презентации к уроку
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
Планируемые результаты обучения:
Оборудование:
Методы и приемы:
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:
На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:
Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
Просмотр двух видеороликов.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы
1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
2. Приборы для получения и собирания водорода
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.

3. Обнаружение водорода – проверка его на чистоту
4. Свойство водорода – активный восстановитель
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Проверка водорода на чистоту
Очистка водорода
Если при получении водорода используется соляная кислота, то выделяющийся газ содержит две основные примеси – хлороводород и пары воды. От них избавляются, последовательно пропуская газ из аппарата Киппа через промывную склянку с водой (поглощает HCl) и с концентрированной серной кислотой (поглощает пары воды) (рис.29).
 |
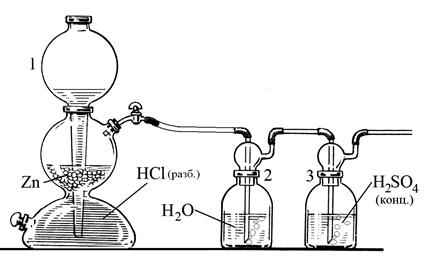 |
Смеси водорода с кислородом (2 : 1) или воздухом очень опасны. Они взрываются с большой силой при поджигании, при пропускании электрического разряда или при контакте с платиной. Поэтому водород, выделяющийся из аппарата Киппа, перед использованием всегда нужно очень тщательно проверять на чистоту следующим образом:
1. Зажечь спиртовку на расстоянии не ближе 1 м к аппарату Киппа.
2. Методом вытеснения воды заполнить пробирку выделяющимся газом и закрыть её под водой указательным пальцем.
3. Поднести закрытую пробирку отверстием вниз к пламени спиртовки, не переворачивая открыть и быстро внести в пламя. Чистый водород сгорает с лёгким, еле слышным хлопком вроде «п-па». Однако для обеспечения безопасности при работе с водородом всегда нужно окончательно убедиться в его чистоте. Водород можно использовать только после трёхкратной положительной пробы на чистоту. Если же при поджигании газа раздаётся резкий «лающий» звук, то выделяющийся газ содержит примесь воздуха и очень опасен. В этом случае нужно дождаться выделения чистого газа, периодически проводя пробу на чистоту. При этом нельзя использовать одну и ту же пробирку.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
















