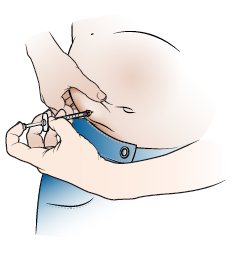
для чего после операции делают укол в живот
Как сделать подкожную инъекцию лекарства для разжижения крови с помощью предварительно заполненного шприца
Эта информация разъясняет, как подготовить и сделать подкожную инъекцию (укол) лекарства для разжижения крови с помощью предварительно заполненного шприца. Во всем этом материале мы используем слова “вы”, “ваш” и “себе” в отношении вас или вашего ребенка.
Вам нужно делать себе инъекции (уколы) лекарства для разжижения крови. Вы получите уже заполненные лекарством шприцы в вашей аптеке. Вы будете вводить лекарство в жировой слой под кожей с помощью маленькой, тонкой иглы.
Вы можете получить предварительно заполненный шприц с уже надетой на него иглой, или вам может понадобиться надеть ее самостоятельно. Если вы получили шприц без иглы, наденьте ее, выполнив инструкции из раздела “Подготовка инъекции”.
Вы потренируетесь готовить и делать себе инъекцию вместе с медсестрой/медбратом. Обращайтесь к этому материалу дома, когда будете делать себе инъекции первые несколько раз.
Информация о лекарстве
Лекарство: _______________________________________
Время введения лекарства: _________________________________
Доза и количество: ___________________________________
Подготовка инъекции
Надевание иглы:
Рисунок 1. Выбор места инъекции
Проведение инъекции
Рисунок 2. Введение инъекции
Рисунок 3. Введение иглы
Что делать, если что-либо коснулось иглы
Если вы используете шприц с предварительно надетой иглой, выбросьте его в контейнер для острых предметов. Начните процедуру заново с новым предварительно заполненным шприцем.
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.
Для чего после операции делают укол в живот
ВТЭ — венозные тромбоэмболии
МНО — международное нормализованное отношение
НМГ — низкомолекулярный гепарин
ТЭО — тромбоэмболические осложнения
ФП — фибрилляция предсердий
В США более 2,5 млн больных постоянно принимают антикоагулянты в связи с развитием у них венозных тромбоэмболий (ВТЭ), имплантацией в сердце механических клапанных протезов или фибрилляцией предсердий (ФП) [1]. Ежегодно примерно у 10% таких больных применение антикоагулянтной терапии временно прекращается в связи с выполнением инвазивных вмешательств. Для выбора приемлемой тактики ведения таких больных необходима оценка риска развития тромбоэмболий и тяжелых кровотечений в период выполнения вмешательства. Временное изменение антикоагулянтной терапии в период выполнения вмешательства в литературе на английском языке обычно обозначается термином «bridging therapy». Такое изменение терапии обычно включает парентеральное применение короткодействующих антикоагулянтов в период временного прекращения приема варфарина. Ниже представлен систематический подход к выбору тактики применения антикоагулянтной терапии в период выполнения инвазивных вмешательств.
Общепринятая тактика применения антикоагулянтной терапии в период выполнения инвазивного вмешательства у больных, длительно принимающих варфарин, отсутствует. Однако может быть полезен систематический подход к выбору такой тактики. При необходимости выполнения неотложного или экстренного вмешательства обычно нет времени для перевода больного на терапию другим антикоагулянтом на период выполнения вмешательства. Действие варфарина в таких случаях может быть устранено с помощью введения свежезамороженной плазмы и парентерального введения витамина К.
Если предполагаемое вмешательство относят к плановым, необходимо ответить на вопрос о необходимости прекращения приема антикоагулянта в период его выполнения. Следует отметить, что многие вмешательства можно безопасно выполнять без перерыва в применения антикоагулянтов. К ним, например, относят экстракцию зуба, биопсию костного мозга, эндоскопию (в том числе с биопсией слизистой оболочки), хирургические вмешательства по поводу катаракты, установку электрокардиостимулятора, венографию, дерматологические операции, а также аспирацию жидкости из полости суставов. Перед выполнением таких вмешательств интенсивность терапии варфарином обычно уменьшают для достижения более низкого терапевтического диапазона значений международного нормализованного отношения (МНО).
Если прием антикоагулянтов должен быть прекращен, следует оценить необходимость временного перехода на парентеральное введение антикоагулянта на период выполнения вмешательства. Такой переход не требуется у следующих больных: 1) с низким риском развития тромбоэмболических осложнений (ТЭО), включая больных с ФП и оценкой по шкале CHADS2 2 балла и менее в отсутствие ранее перенесенной тромбоэмболии и тромбов в полостях сердца; 2) при наличии имплантированного в аортальную позицию двустворчатого механического протеза в случае сохранения синусового ритма и в отсутствие ранее переносимых тромбоэмболий; 3) перенесших более 3 мес назад ВТЭ в отсутствие активных форм рака. У таких больных прием варфарина может быть прекращен за 4—5 дней до предполагаемого вмешательства. Утром в день выполнения вмешательства необходимо получить подтверждение того, что уровень МНО соответствует требуемому диапазону. Прием варфарина в таких случаях возобновляется в день выполнения вмешательства, как только будет достигнут гемостаз и больной сможет принимать препарат. Послеоперационные характеристики больного, которые следует учитывать при решении вопроса о возобновлении приема варфарина, включают необходимость выполнения дополнительного вмешательства и предполагаемое время его выполнения; применение препаратов, которые взаимодействуют с приемом варфарина, включая антибиотики; ограниченное потребление пищи. Следует учитывать необходимость более частого определения МНО. Кроме того, следует применять соответствующие механические и лекарственные методы профилактики ВТЭ до тех пор, пока в полном объеме не будет возобновлена антикоагулянтная терапия.
В ходе продолжающегося исследования Bridge Trial, которое финансируется Национальным институтом здоровья США, будет оцениваться безопасность и эффективность временного перевода больных с ФП на низкомолекулярный гепарин (НМГ) в период выполнения инвазивных вмешательств [2]. Предполагается, что в это исследование будут включены 3626 больных, и оно закончится в 2014 или 2015 г. Считается, что результаты этого исследования позволят ответить на вопрос о том, требуется ли в период выполнения инвазивного вмешательства временный перевод на НМГ больных с ФП и оценкой по шкале CHADS2 3 или 4 балл, у которых в анамнезе отсутствут инсульт или тромбоэмболия.
В тех случаях, когда риск развития тромбоэмболий расценивается как средний или высокий, считается обязательным временный перевод больного на парентеральный НМГ. По мнению экспертов, у больных, наблюдающихся амбулаторно, в таких случаях по возможности предпочтительно подкожное введение НМГ ввиду удобства дозирования, безопасности и невысокой стоимости такой терапии [3, 4]. При тяжелом нарушении функции почек (снижение клиренса креатинина до 15—30 мл/мин, что соответствует IV стадии хронической болезни почек) доза НМГ должна быть снижена; кроме того, в ходе терапии необходимо наблюдение за активностью анти-Xa [5]. У больных с хронической болезнью почек V стадии для таких целей следует применять внутривенные инфузии нефракционированного гепарина. После отмены варфарина суточную дозу НМГ начинают вводить сразу, как только МНО становится ниже терапевтического диапазона [6—8]. У больных с высоким риском развития ТЭО, у которых имплантированы механические клапанные протезы, в соответствии с клиническими рекомендациями НМГ вводится 2 раза в сутки [9, 10]. Во всех других случаях НМГ вводится однократно. Для того чтобы избежать остаточного действия НМГ в день выполнения хирургической операции, утром в день вмешательства, но до начала его выполнения, НМГ вводят в дозе, соответствующей 50% от рассчитанной суточной дозы [11]. После операции прием варфарина должен быть с осторожностью возобновлен при первой возможности. Гепарин можно вводить не ранее чем через 48 ч после завершения операции с целью снижения риска развития тяжелых кровотечений, причем следует учитывать возможность использования небольших доз гепарина [6—8, 12]. После хирургических операций, которые сопровождаются высоким риском развития тяжелых кровотечений, при возобновлении введения гепарина вначале следует ограничивать его использование профилактическими дозами, если вообще он может применяться в таких случаях. Внутривенное введение нефракционированного гепарина без болюсного введения имеет преимущества, которые состоят в быстром выведении препарата и возможности нивелирования его действия за счет введения протамина; в подобных случаях именно такой подход к терапии гепарином может быть предпочтительным. У больных с ВТЭ после операции приемлемо профилактическое применение НМГ. Причем варфарин и гепарин должны применяться одновременно в течение не менее 5 дней или до тех пор, пока МНО не будет соответствовать терапевтическому диапазону в зависимости. В зависимости от показаний и характера инвазивного вмешательства прием аспирина может быть прекращен за 1 нед до предполагаемого вмешательства.
У больных, ранее переносивших ВТЭ, в целом наблюдается общая тенденция к имплантации фильтра в нижнюю полую вену в качестве компонента тактики профилактики ТЭО в период выполнения инвазивного вмешательства [8]. У больных с остро или подостро развившейся ВТЭ плановое хирургическое вмешательство должно быть отложено до тех пор, пока продолжительность периода применения антикоагулянтов не достигнет 3 мес. Имплантация фильтра в нижнюю полую вену может быть рекомендована только больным, которым необходимо неотложное выполнение хирургического вмешательства в течение месяца после установления диагноза ВТЭ. Предпочтительной считается имплантация съемных фильтров, которые должны удаляться, как только исчезнет необходимость в их использовании.
При наличии в анамнезе тромбоцитопении, обусловленной применением гепарина, следует избегать введения любых препаратов гепарина. В качестве альтернативной терапии в таких случаях применяют такие короткодействующие прямые ингибиторы тромбина, как аргатробан, лепирудин или бивалирудин. Использование дезирудина представляется особенно привлекательным, поскольку его можно вводить подкожно, что позволяет наблюдать за больным в амбулаторных условиях. У больных с тромбоцитопенией, обусловленной применением гепарина, часто применяют фондапаринукс, но его применение в период выполнения инвазивных вмешательств представляется проблематичным ввиду большого периода полувыведения, который достигает 17—21 ч.
В целом риск развития кровотечений в период выполнения вмешательств в 2 раза превышает риск развития тромбозов. Относительно недавно была разработана шкала BleedMAP для оценки риска развития кровотечения в период выполнения инвазивного вмешательства [12]. При оценке с помощью этой шкалы 1 балл соответствует каждому из следующих факторов риска: кровотечение в анамнезе (Bleed), имплантированный в сердце механический клапанный протез (М), активная форма рака (А) и низкий уровень тромбоцитов в крови (P, от platelet; число тромбоцитов 150 000/мкл и менее). Несмотря на то что обоснованность применения такой шкалы пока не подвергалась оценке в ходе выполнения проспективного исследования, использование ее позволяет устанавливать риск развития кровотечения на основании клинических данных. Следует также отметить, что в настоящее время это единственная шкала, доступная для оценки риска развития кровотечения при использовании антикоагулянтов в период выполнения инвазивного вмешательства.
Отдельно рассматривают тактику антикоагулянтной терапии у больных, принимающих «новые» антикоагулянты. Дабигатрана этексилат (прадакса) пероральный прямой ингибитор тромбина, который был одобрен Администрацией США по контролю за качеством пищевых продуктов и лекарственных препаратов к применению с целью профилактики инсульта у больных с ФП неклапанной природы [13]. Период достижения максимального эффекта после приема дабигатрана составляет около 1 ч, период полувыведения препарата достигает примерно 15 ч, а выводится он преимущественно (около 80%) через почки. Ривароксабан (ксарелто) — пероральный прямой ингибитор Ха-фактора, который также был одобрен Администрацией США по контролю за качеством пищевых продуктов и лекарственных препаратов к применению с целью профилактики инсульта у больных с ФП неклапанной природы [14], а также для профилактики ВТЭ после протезирования крупных суставов. Ривароксабан метаболизируется в печени (33%) и выделяется через почки (66%). Период полувыведения составляет от 7 до 11 ч.
По мнению экспертов, тактика ведения больных, принимающих дабигатран или ривароксабан, более консервативна, чем рекомендации производителей этих антикоагулянтов, что обусловлено несколькими причинами [15]. Во-первых, частота развития тромбоэмболий в период выполнения инвазивных вмешательств низкая (1%). Во-вторых, после приема как дабигатрана, так и ривароксабана их действие начинается быстро (в течение 1—2 ч), причем период полувыведения обоих препаратов достаточно большой. В-третьих, для дабигатрана отсутствует антидот. Были получены данные о том, что применение концентрата протромбинового комплекса приводит к нивелированию действия ривароксабана у здоровых добровольцев [16].
Прежде всего следует оценить риск развития кровотечения, связанный с определенным типом хирургического вмешательства и определенным типом анестезии (например, спинномозговой). В любом случае оперирующий хирург и анестезиолог должны знать о том, что больной принимает «новый» антикоагулянт. Необходимо также повторно определить клиренс креатинина для того, чтобы убедиться в правильности применяемой дозы. Если вмешательство носит неотложный или экстренный характер, следует предполагать повышенный риск развития кровотечения, и такой риск должен быть сопоставлен с возможными последствиями отсрочки вмешательства. Механические вмешательства, направленные на остановку кровотечения, включают прошивание сосуда, его клипирование, сдавление области кровотечения, охлаждение, прижигание и местное применение тромбина. При массивных кровотечениях решение об использовании таких кровеостанавливающих средств, как концентрат протромбинового комплекса, антиингибиторный коагулянтный комплекс со стандартной активностью (Factor Eight Inhibitor Bypass Activity) или рекомбинантный фактор VIIa, должно приниматься с учетом риска развития тромботических осложнений [15, 16].
При плановых вмешательствах у больных, принимающих «новые» антикоагулянты, в первую очередь следует оценить клиренс креатинина. У больных с клиренсом креатинина 50 мл/мин и более до вмешательства рекомендуется прекращение приема антикоагулянта на период, соответствующий 4—5 периодам полувыведения препарата. У больных с клиренсом креатинина менее 50 мл/мин продолжительность периода прекращения приема препарата должна быть увеличена еще на 2 дня. Перед выполнением хирургических операций, которые сопровождаются высоким риском развития кровотечений, нормальное активированное частичное тромбопластиновое время или тромбиновое время свидетельствует о достаточной элиминации дабигатрана. В настоящее время нет доступных лабораторных анализов для подтверждения полной элиминации ривароксабана. В большинстве случаев перевод больного на применение гепарина в период выполнения инвазивного вмешательства обычно не показан. После операции необходимо вновь убедиться в достаточной функции почек. Возобновление приема дабигатрана и ровероксабана должно быть отложено на 48 ч, причем их применение возможно только при подтверждении полной остановки кровотечения. Следует отметить, что в течение 1—2 ч после возобновления приема дабигатрана и ривароксабана у больного будет достигнут полный антикоагулянтный эффект. Если у больного имеется высокий риск развития кровотечения или в ближайшее время предполагается выполнение дополнительных вмешательств, по мнению экспертов, целесообразно применение стандартной антикоагулянтной терапии, действие которой может быть при необходимости устранено.
В настоящее время исследователями предоставлены данные о 4591 больных с ФП неклапанной природы, которые в ходе выполнения исследования рандомизированно распределялись в группу приема дабигатрана (по 110 или 150 мг 2 раза в сутки) или группу применения варфарина [17]. Дабигатран и варфарин отменяли в среднем за 2 и 4 сут до вмешательства соотв. Время возобновления приема антикоагулянтов после вмешательства определял лечащий врач. Частота развития кровотечений в течение 30 дней статистически значимо не различалась между группами (в группе приема дабигатрана 110 мг 2 раза в сутки, в группе приема дабигатрана по 150 мг 2 раза в сутки и группе применения варфарина такая частота достигала 3,8, 5,1 и 46% соотв.), но в целом была в 2 раза выше, чем ранее сообщалось для терапии варфарином. Частота развития ТЭО была низкой и составляла примерно 1% в каждой группе. Несмотря на важность таких данных, следует отметить недостатки указанной статьи: вторичность выполненного анализа, изменение тактики лечения в ходе выполнения исследования, отсутствие стандартизованного подхода к антикоагулянтной терапии (особенно при решении вопроса о возобновлении ее после вмешательства) и отсутствие стандартного определения «большого» вмешательства. На самом деле менее 17% выполненных в ходе исследования вмешательств с точки зрения практикующих врачей могли быть отнесены к «большим». По мнению экспертов, до получения дополнительных данных о частоте развития кровотечений у больных, перенесших «большие» вмешательства, подход к определению тактики применения антикоагулянтов в период выполнения вмешательств должен оставаться консервативным.
Более того, в своей практике эксперты избегают использования дабигатрана и ривароксабана в случаях установки катетеров в канал спинного мозга и/или эпидурально либо в глубокое сплетение в связи с повышенным риском развития гематом. После удаления катетеров, установленных в канал спинного мозга либо глубокое сплетение и/или в периферические участки нервной системы, возобновление приема дабигатрана и ривароксабана должно быть отложено на 24 ч.
Следует также отметить, что у длительно принимающих антикоагулянты больных с активными формами рака имеется предрасположенность к развитию как тромбозов, так и кровотечений. Терапия антикоагулянтами в таких случаях усложняется в связи с применением химиотерапии, установлением центральных венозных катетеров, наличием цитопений, применением гормональных средств, лекарственными взаимодействиями, а также вариабельностью режима питания и рациона. Результаты недавно выполненного исследования [18] свидетельствуют о том, что в период выполнения инвазивных вмешательств в подгруппе больных с активными формами рака (n=493) по сравнению с подгруппой больных, у которых не было рака (n=1589), частота развития ВТЭ и тяжелых кровотечений была статистически значимо выше: ВТЭ развивались у 1,2 и 0,2% больных соотв., а тяжелые кровотечения — у 3,4 и 1,7% больных соотв. Это различие в основном было обусловлено данными о больных, которые применяли антикоагулянты по поводу ВТЭ, обусловленные раком. У таких больных в период выполнения инвазивных вмешательств эксперты рекомендуют более частый перевод на терапию НМГ в достаточных дозах. Последняя доза НМГ, вводимая за 24 ч до вмешательства, должна составлять 50% от общей суточной дозы препарата. После вмешательства применение НМГ должно ограничиваться введением профилактических доз до тех пор, пока не будет получено подтверждение полной остановки кровотечения. Использования терапевтических доз НМГ следует избегать в течение 48 ч после вмешательства с целью предотвращения тяжелых кровотечений. У многих больных с ВТЭ, обусловленными раком, длительно применяют НМГ.