для чего проводят созревание осадков
Созревание осадков- понятие и для каких осадков характерно
Процесс созревания осадка заключается в том, что более крупные кристаллики увеличиваются в размерах, а более мелкие постепенно уменьшаются и исчезают. Это объясняется тем, что растворимость мелких частичек данного вещества больше, чем крупных его частиц. Поэтому раствор, насыщенный в отношении мелких частиц, является пересыщенным по отношению к более крупным частицам вещества. В результате этого наблюдается рост крупных частиц осадка за счет мелких.
При нагревании раствора ( или при стоянии осадка в соприкосновении с маточным раствором) в процессе созревания осадка крупные кри сталлы растут за счет мелких. При этом происходит уменьшение общей удельной поверхности кристаллов, так как чем мельче частицы вещества, занимающего определенный объем, тем больше их суммарная поверх чость. [2]
Поэтому мелкие кристаллы растворяются быстрее, чем крупные, и крупные кристаллы растут за счет мелких. В процессе созревания осадка мелкие кристаллы растворяются, а более крупные растут. [4]
Поэтому мелкие кристаллы растворяются быстрее, чем крупные, и крупные кристаллы растут за счет мелких. В процессе созревания осадка мелкие кристаллы растворяются, а крупные растут. [5]
Поэтому мелкие кристаллы растворяются быстрее, чем крупные, и крупные кристаллы растут за счет мелких. Таким образом, в процессе созревания осадка мелкие кристаллы растворяются, а крупные увеличиваются в объеме. [6]
Поэтому оно происходит при обыкно венной температуре весьма медленно. Повы-шение температуры, увеличивая скорость движе-ния молекул, ускоряет и процесс созревания осадка. Следовательно, его выгодно вести, поме-щая стакан с осадком в теплое место.
Созревание осадков. Для каких осадков это характерно?
Созревание – это процесс укрупнения кристаллического осадка за счет растворения мелких кристаллов (старение). Время «созревания» осадка можно сократить, нагревая раствор с осадком.
«Созревание» по Оствальду заключается в растворении мелких кристаллов и упорядочении роста больших кристаллов. Термическое старение — упорядочение роста кристаллов под действием температуры. Химическое старение характерно для гидратов солей, например осадок оксалата кальция выпадает в виде смеси ди- и тригидрата, которые при повышении температуры переходят в моногидрат, при этом осадок самоочищается. В результате процесса старения образуется более чистый, крупнокристаллический, лучше фильтрующийся осадок с кристаллами более правильной формы.
Соосаждение и его виды
Образование осадка в растворе осложняется протеканием различных сопутствующих процессов, называемых соосаждением, т.е. совместным осаждением.
Под соосаждением понимают выпадение в осадок соединений, произведение растворимости которых еще не достигнуто, поэтому в отсутствие других осадков они не осаждаются.
По механизму захвата посторонних веществ различают несколько видов соосаждения: адсорбцию, окклюзию, образование твердого раствора (изоморфизм).
Адсорбцией называется взаимодействие вещества с поверхностью твердого тела (адсорбента).
Адсорбировнные частицы находятся в равновесии с частицами в растворе, т.е. процесс адсорбции обратим. Зависимость количества адсорбированного вещества от концентрации раствора при постоянной температуре называют изотермой адсорбции.
Адсорбция осадком ионов из раствора несколько отличается от адсорбции молекул. В соответствии с правилом Панета–Фаянса–Гана, осадок адсорбирует из раствора те ионы, которые образуют наименее растворимое или наименее диссоциированное соединение с одним из ионов осадка. В первую очередь на поверхности осадка адсорбируются ионы, входящие в состав осадка и имеющиеся в растворе в избытке.
Окклюзия – вид соосаждения, при котором происходит захват примесей из раствора внутрь кристалла.
Общее правило окклюзии: в осадке будут преобладать окклюдированные посторонние анионы, когда в растворе во время осаждения в избытке содержится осаждаемый катион, и в осадке будут преобладать окклюдированные посторонние катионы, когда в растворе при осаждении в избытке находится осаждаемый анион.
Для борьбы с окклюдированными примесями наиболее эффективным приемом является переосаждение. Осадок растворяют в подходящем растворителе и снова осаждают. Так как одной из причин окклюзии является захват посторонних веществ в процессе роста кристаллов, то ясно, что количество примесей в повторно осажденном осадке будет меньше.
Изоморфизм – свойство ионов замещать друг друга в кристалле с образованием фаз переменного состава: смешанных кристаллов или твердых растворов.
При образовании твердого раствора один из ионов замещается в кристаллической решетке другим ионом при условии, что заряд их одинаков, размеры близки (разница до 10-15 %), а строение кристаллической решетки обоих соединений одинаково. Типичным примером служит изоморфное соосаждение BaSO4 и RaSO4.
Изоморфное соосаждение подчиняется правилу Хлопина (его называют также законом Хлопина)
где D – коэффициент кристаллизации, не зависящий от концентрации, х – доля микрокомпонента, перешедшая в осадок, у – доля макрокомпонента, перешедшая в осадок.
Соосаждение, виды соосаждения.
Соосаждение – это явление, при котором осадок увлекает за собой посторонние вещества из раствора. Является одной из серьезных помех при выполнении гравиметрического определения.Можно выделить следующие виды соосаждений:
1) Окклюзия – процесс захвата примесей микрокомпонента внутрь растущих кристаллов осадка основного компонента.
2) Изоморфизм – процесс образования «смешанных кристаллов» ионами основного компонента и микрокомпонента, имеющих близкие радиусы.
3) Соосаждение с образованием химических соединений между осаждаемым веществом и присутствующими в растворе примесями.
Сорбция и десорбция – назначения и их различия.Сорбция (от лат. sorbeo — поглощаю) — поглощение твёрдым телом либо жидкостью различных веществ из окружающей среды. Поглощаемое вещество, находящееся в среде, называют сорбатом (сорбтивом), поглощающее твёрдое тело или жидкость — сорбентом.По характеру поглощения сорбата сорбционные явления делятся на два типа: адсорбцию — концентрирование сорбата на поверхности раздела фаз или его поглощение поверхностным слоем сорбента и абсорбцию — объёмное поглощение, при котором сорбат распределяется по всему объёму сорбента.
В свою очередь, различают два типа адсорбции — физическую адсорбцию, при которой повышение концентрации сорбата на поверхности раздела фаз обусловлено неспецифическими (то есть не зависящие от природы вещества) силами Ван-дер-Ваальса и химическую адсорбцию (хемосорбцию), обусловленную протеканием химических реакций сорбата с веществом поверхности сорбента. Физическая адсорбция слабоспецифична, обратима и её тепловой эффект невелик (единицы кДж/моль). Хемосорбция избирательна, обычно необратима и её теплота составляет от десятков до сотен (хемосорбция кислорода на металлах) кДж/моль.
Абсорбция
Абсорбция в химии — физический или химический феномен или процесс, при котором атомы, молекулы или ионы входят в какое-либо объёмное состояние — газ, жидкость или твёрдое тело. Это процесс, отличный от адсорбции, поскольку молекулы, подвергающиеся абсорбции, забираются по объёму, а не по поверхности (как происходит в случае с адсорбцией). Более общий термин — сорбция, который охватывает процессы абсорбции, адсорбции и ионного обмена. Абсорбция, в основном — это процесс, при котором что-то присоединяет другую субстанцию. [1]
Если абсорбция является физическим процессом, не сопровождаемым другими физическими или химическими процессами, она обычно подчиняется закону распределения Нернста:»при равновесии отношение концентраций третьего компонента в двух жидких состояниях является постоянной величиной.»;
Объём постоянной KN зависит от температуры и называется коэффициентом распределения. Это равенство верно при условии, что концентрации не слишком велики и если молекулы «х» не меняют свою форму в любом другом из двух состояний. Если такая молекула подвергается ассоциации или диссоциации, тогда это равенство всё так же описывает равновесие между «х» в обоих состояниях, но только для той же формы — концентрации всех оставшихся форм должны быть рассчитаны с учетом всех остальных равновесий. [1]
В случае газовой абсорбции можно рассчитать концентрацию используя например Закон идеального газа, c = p/RT. В качестве альтернативы можно использовать парциальное давление вместо концентраций.
Во многих технологически важных процессах, химическая абсорбция используется вместо физического процесса, например абсорбция углекислого газа гидроксидом натрия — такие процессы не следуют закону распределения Нернста.
Для некоторых примеров этого эффекта можно рассмотреть экстракцию, при которой можно извлечь компонент из одной жидкой фазы раствора и перенести в другую без химической реакции. Примеры таких растворов — благородные газы и оксид осмия
Для чего проводят созревание осадков
В гравиметрическом анализе к осадку предъявляется ряд требований.
1 Осадок должен быть практически нерастворим. Для уменьшения растворимости обычно применяют избыток осадителя (см. разд. 5.1.1). Осадки часто представляют собой соли слабых кислот, поэтому полнота их осаждения зависит от концентрации ионов водорода в растворе (см. разд. 5.1.3).
2 Гравиметрическая форма после высушивания или прокаливания должна соответствовать определенной формуле. Это требование связано с чистотой осадка, так как при его образовании из раствора могут быть захвачены посторонние вещества. Кроме того, некоторые осадки имеют переменный состав, например, фосфаты двухвалентных металлов: МеНРО4 и (Ме)3(РО4)2, что не позволяет использовать их в количественном анализе.
3 Осадок должен получаться в форме, удобной для отделения его от раствора фильтрованием. Это требование связано, главным образом, с размерами зерна осадка.
Образование осадков и их свойства
Создание оптимальных условий осаждения при количественных определениях имеет большое значение, так как потери вещества здесь недопустимы.
В процессе формирования осадка очень большое значение имеет пересыщение раствора. Его характеризуют так называемым относительным пересыщением:
где Q – концентрация осаждаемого вещества, S – его растворимость. Из приведенной формулы следует, что чем выше будет растворимость образующегося осадка и чем ниже концентрация осаждаемого вещества и осадителя, тем меньше будет относительное пересыщение, меньше число первичных кристаллов, и тем крупнее они будут.
Таким образом, можно сформулировать правила осаждения кристаллических осадков:
1 Вести осаждение из достаточно разбавленного раствора разбавленным раствором осадителя.
2 Прибавлять осадитель медленно, особенно в начале осаждения.
3 Непрерывно перемешивать раствор, чтобы избежать местных пересыщений при добавлении осадителя.
4 Вести осаждение из горячего раствора (иногда нагревают и раствор осадителя).
5 Прибавлять при осаждении вещества, повышающие растворимость осадка.
При образовании кристаллических осадков нередко достаточно полное выделение соответствующего вещества из раствора происходит не сразу, а через более или менее длительный промежуток времени. Поэтому в таких случаях после добавления осадителя реакционную смесь оставляют на несколько часов для созревания осадка. При этом происходит ряд процессов, приводящих к укрупнению кристаллов осадка и получению их в чистой, практически свободной от примесей форме.
Причиной укрупнения кристаллов является растворение мелких кристаллов и рост за их счет более крупных кристаллов. Это явление объясняется поверхностным натяжением, стремящимся возможно сильнее уменьшить поверхность соприкосновения раствора с осадком. В результате мелкие кристаллы растворяются, и происходит рост крупных кристаллов. Вследствие меньшей растворимости крупных кристаллов раствор, насыщенный относительно них, является ненасыщенным относительно мелких кристаллов, которые растворяются. При этом раствор становится пересыщенным относительно крупных кристаллов, и растворенное вещество отлагается на их поверхности. Течение указанных процессов связано с диффузией вещества в растворе от мелких кристаллов к крупным, которая протекает при комнатной температуре достаточно медленно. Повышение температуры ускоряет диффузию и увеличивает растворимость, поэтому ускоряет созревание осадка.
Важным процессом, происходящим при созревании осадка, является совершенствование формы кристаллов, и, как следствие, повышение чистоты осадка. Вследствие динамического равновесия между раствором и осадком одни ионы (обычно образующие дефекты на поверхности кристаллической решетки) переходят в раствор с поверхности твердой фазы, а другие осаждаются на ее поверхности. В результате такой перекристаллизации образуются кристаллы более правильной формы.
Другим фактором устойчивости коллоидных систем является сольватация (гидратация) коллоидных частиц, т.е. адсорбция ими молекул растворителя. В результате этого коллоидные частицы окружаются сольватными оболочками, препятствующими их соединению в более крупные агрегаты. Разрушение сольватных оболочек может быть достигнуто за счет добавления электролитов достаточно высокой концентрации. Ионы электролитов, сольватируясь, отнимают молекулы растворителя от коллоидных частиц, а также нейтрализуют заряды этих частиц, что способствует их коагуляции.
Коагуляции способствует повышение температуры раствора. Оно уменьшает адсорбцию ионов и способствует разрушению сольватных оболочек частиц.
Таким образом, правила осаждения аморфных осадков следующие:
· Проводить осаждение из концентрированного раствора концентрированным раствором осадителя.
· Проводить осаждение из горячего раствора.
· Проводить осаждение в присутствии подходящего электролита-коагулянта.
Аморфные осадки после осаждения сразу подвергают дальнейшим операциям: перенесению на фильтр и промыванию для предотвращения образования скрытокристаллической структуры при выдерживании под реакционным раствором.
«Оствальдовское созревание» осадка
Одним из процессов, происходящих с осадком, является растворение мелких и рост крупных частиц, т. е.

«оствальдовское созревание». Мелкие кристаллы имеют на своей поверхности больше активных мест (грани, углы), обладают высокой поверхностной энергией и, следовательно, они более растворимы, чем крупные кристаллы, и быстрее растворяются. В результате этого средний размер кристаллов с течением времени увеличивается (табл. VI-1) [13]. Следует отметить, что зависимость растворимости от размера частиц более четко выражена у осадков с высокой свободной поверхностной энергией (сульфат бария, хромат свинца и др.), чем у осадков с низкой поверхностной энергией (хлорид серебра).
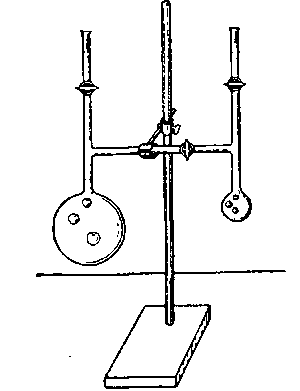
Рис. VI-4. Прибор для Уменьшение общей поверхности демонстрации остваль- можно продемонстрировать, исполь-довского созревания. зуя опыт Оствальда [14].
Аппаратура и реактивы
Двойная Т-образная трубка, сделанная из стеклянных трубок с кранами (рис. VI-4).
Раствор мыла. Растворяют 10 г олеиновой кислоты в растворе гидроокиси натрия; к полученному раствору добавляют хлористоводородную кислоту до появления мути, затем добавляют 25 г глицерина и разбавляют водой до 100 мл.
Выполнение опыта. Из нижнего отверстия каждой трубки выдуть по мыльному пузырю разного размера (соединительный кран при этом закрыт). Закрыть верхние краны. Открыть соединительный кран. При этом большой пузырь увеличивается в размере за счет меньшего.
Примечание. Если окрасить раствор эозином, то мыльный пузырь видно на далеком расстоянии.
Большая Энциклопедия Нефти и Газа
Процесс созревания осадка заключается в том, что более крупные кристаллики увеличиваются в размерах, а более мелкие постепенно уменьшаются и исчезают. Это объясняется тем, что растворимость мелких частичек данного вещества больше, чем крупных его частиц. Поэтому раствор, насыщенный в отношении мелких частиц, является пересыщенным по отношению к более крупным частицам вещества. В результате этого наблюдается рост крупных частиц осадка за счет мелких. [1]
При нагревании раствора ( или при стоянии осадка в соприкосновении с маточным раствором) в процессе созревания осадка крупные кри сталлы растут за счет мелких. При этом происходит уменьшение общей удельной поверхности кристаллов, так как чем мельче частицы вещества, занимающего определенный объем, тем больше их суммарная поверх чость. [2]
Поэтому мелкие кристаллы растворяются быстрее, чем крупные, и крупные кристаллы растут за счет мелких. В процессе созревания осадка мелкие кристаллы растворяются, а более крупные растут. [4]
Поэтому мелкие кристаллы растворяются быстрее, чем крупные, и крупные кристаллы растут за счет мелких. В процессе созревания осадка мелкие кристаллы растворяются, а крупные растут. [5]
Поэтому мелкие кристаллы растворяются быстрее, чем крупные, и крупные кристаллы растут за счет мелких. Таким образом, в процессе созревания осадка мелкие кристаллы растворяются, а крупные увеличиваются в объеме. [6]
В большинстве случаев осадки не следует оставлять для отфильтровывания и промывания на следующий день. Процесс созревания осадка является по существу процессом перекристаллизации. [10]
Скорость растворения осадка зависит от размера его частиц. Чем меньше частицы, тем лучше они растворяются. Это явление вполне очевидно, так как растворение происходит только с поверх ности кристалла ( или аморфной частицы), а суммарная поверхность мелких частиц гораздо больше, чем крупных. Поэтому мелкие кристаллы растворяются быстрее, чем крупные, и крупные кристаллы растут за счет мелких. В процессе созревания осадка мелкие кристаллы растворяются, а более крупные растут. [15]
Для чего проводят созревание осадков
Количественный анализ. Классификация методов. Гравиметрический анализ. Осажденная и гравиметрическая формы осадков. Расчеты в гравиметрическом анализе.
Количественный анализ предназначен для установления количественного состава компонентов в анализируемой пробе. Ему предшествует качественный анализ, устанавливающий, какие компоненты (элементы, ионы, молекулы) присутствуют в анализируемой пробе.
Количественный анализ бывает трех видов: полный, частичный, общий. При полном количественном анализе устанавливается полный количественный состав всех компонентов, присутствующих в анализируемой пробе. Например, для полного количественного анализа крови необходимо определить содержание 12 компонентов: натрия, калия, кальция, глюкозы, билирубина и т. д. Полный анализ требует больших затрат времени и труда.
При выполнении частичного анализа определяется содержание лишь за-
данных компонентов. Общий анализ устанавливает содержание каждого элемента в анализируемом образце независимо от того, в состав каких соединений они входят. Такой анализ обычно называют элементным.
КЛАССИФИКАЦИЯ МЕТОДОВ КОЛИЧЕСТВЕННОГО АНАЛИЗА
Методы количественного анализа можно разделить на три большие группы: химические, физические, физико-химические.
Химические методы основаны на использовании количественно протекающих, различных по типу химических реакций: обменных, осадительных, окислительно-восстановительных и реакций комплексообразования. К химическим относятся гравиметрический и титриметрический (объемный) методы анализа.
Гравиметрический метод анализа основан на измерении массы определяeмoгo компонента после его выделения в виде гравиметрической формы. Метод характеризуется высокой точностью, но длителен и трудоемок. В фармацевтическом анализе его применяют в основном для определения влажности и зольности лекарственных препаратов.
Химические методы анализа, хотя и являются в настоящее время основными в химических лабораториях, во многих случаях не отвечают возросшим требованиям к анализу, таким как высокая чувствительность, экспрессность, селективность, автоматизация и др. Этих недостатков лишены инструментальные методы анализа, которые можно разделить на три большие группы: оптические, электрохимические, хроматографические.
В гравиметрическом анализе используют методы осаждения, отгонки (прямой и косвенной), выделения, термогравиметрию, электрогравиметрию.
В методе осаждения определяемый компонент вступает в химическую реакцию с реагентом, образуя малорастворимое соединение. После проведения ряда аналитических операций (схема 1.1) твердый осадок известного состава взвешивают и проводят необходимые вычисления.
Последовательность аналитических операций в гравиметрическом методе осаждения
N этапа Содержание этапа анализа
1Расчет массы навески анализируемого вещества и ее взвешивание
2 Растворение навески
3 Создание условий осаждения
4 Осаждение (получение осажденной формы)
5Отделение осадка фильтрованием
6 Промывание осадка
7 Получение гравиметрической формы (высушивание, прокаливание до постоянной массы)
8 Взвешивание гравиметрической формы
9 Расчет результатов анализа
Электрогравиметрический анализ основан на электролитическом выделении металлов и взвешивании полученного на электроде осадка. Основным физическим условием электpoлитичecкoгo разделения металлов является определенное напряжение, при котором осаждаются одни и не выделяются другие металлы.
В аналитической практике наиболее широкое применение находит грави-
метрический метод осаждения, который и будет рассмотрен более подробно.
МЕХАНИЗМ ОБРАЗОВАНИЯ ОСАДКА И УСЛОВИЯ ОСАЖДЕНИЯ
Образование осадка происходит в том случае, когда произведение концентраций ионов, входящих в его состав, превышает величину произведения растворимости ПР (KA) малорастворимого электролита:
т. е. когда возникает местное (относительное) пересыщение раствора, которое рассчитывают по формуле:
Исходя из понятия относительного пересыщения раствора, следует, что чем ниже растворимость осадка S и чем выше концентрация реагирующих веществ Q, тем больше образуется зародышей и тем больше скорость агрегации. И наоборот: чем меньше разность (Q – S), то есть, чем выше растворимость осадка и ниже концентрация осаждаемого вещества, тем выше скорость ориентации. Следовательно, для получения крупных кристаллов, которые можно легко отфильтровать и промыть, необходимо проводить осаждение из разбавленных растворов медленным прибавлением осадителя и при нагревании (табл. 1.1).
Условия осаждения кристаллических и аморфных осадков
Характер осадка
Концентрация растворов вещества и осадителя
К разбавленному раствору исследуемого вещества прибавляют разбавленный раствор осадителя
К концентрированному раствору исследуемого вещества прибавляют концентрированный раствор осадителя
Скорость осаждения
Раствор осадителя прибавляют по каплям
Раствор осадителя прибавляют быстро
Осаждение производят при непрерывном перемешивании
Присутствие посторонних веществ
Добавляют вещества, повышающие растворимость (обычно сильные кислоты)
Добавляют электролиты-коагулянты
Длительно выдерживают осадок в маточном растворе для «созревания» («старения»)
Фильтруют сразу после осаждения
Чистота кристаллических осадков. Удельная поверхность кристаллических осадков (плошадь осадка, отнесенная к единице массы, см 2 /г) обычно мала, поэтому соосаждение за счет адсорбции незначительно. Однако другие виды соосаждения, связанные с загрязнением внутри кристалла, могут привести к ошибкам.
Известны два вида соосаждения в кристаллических осадках:
Эффективным способом уменьшения окклюзии является «старение» («созревание») осадка, в ходе которого происходит самопроизвольный рост более крупных кристаллов за счет растворения мелких частиц, совершенствуется кристаллическая структура осадка, сокращается его удельная поверхность, вследствие чего десорбируются и переходят в раствор примеси поглощенных ранее веществ. Время «созревания» осадка можно сократить, нагревая раствор с осадком.
Чистота аморфных осадков существенно уменьшается в результате процесса адсорбции, так как аморфный осадок состоит из частиц с неупорядоченной структурой, образующих рыхлую пористую массу с большой поверхностью. Наиболее эффективным способом уменьшения в результате процесса адсорбции является переосаждение. В этом случае отфильтрованный осадок растворяют и снова осаждают. Переосаждение существенно удлиняет анализ, но оно неизбежно для гидратированных железа ( III ) и алюминия оксидов, цинка и марганца гидроксидов и т. п. Процессом, обратным коагуляции аморфного осадка, является его пептизация – явление, в результате которого коагулированный коллоид возвращается в исходное дисперсное состояние. Пептизация часто наблюдается при промывании аморфных осадков дистиллированной водой. Эта ошибка устраняeтcя при правильном выборе промывной жидкости для аморфного осадка.
ОСАЖДЕННАЯ И ГРАВИМЕТРИЧЕСКАЯ ФОРМЫ.
ТРЕБОВАНИЯ К НИМ.
В гравиметрическом методе осаждения существуют понятия осажденной
определяемый осадитель осажденная гравиметрическая
определяемый осадитель осажденная гравиметрическая
Из приведенных примеров видно, что не всегда гравиметрическая форма совпадает с осажденной формой вещества. Различны и требования, предъявляемые к ним.
Осажденная форма должна быть:
· достаточно малорастворимой, чтобы обеспечить практически полное
выделение определяемого вещества из раствора. В случае осаждения
бинарных электролитов ( AgCl; BaS04; СаС2О4 и т. п.) достигается
практически полное осаждение, так как произведение растворимости этих
· полученный осадок должен быть чистым и легко фильтрующимся (что определяет преимущества кристаллических осадков);
· осажденная форма должна легко переходить в гравиметрическую форму.
После фильтрования и промывания осажденной формы ее высушивают или прокаливают до тех пор, пока масса осадка не станет постоянной, что подтверждает полноту превращения осажденной формы в гравиметрическую и указывает на полноту удаления летучих примесей. Осадки, полученные при осаждении определяемого компонента органическим реагентом (диацетилдиоксимом, 8-оксихинолином, α-нитрозо-β-нафтолом и т. д.), обычно высушивают. Осадки неорганических соединений, как правило, прокаливают
Основными требованиями к гравиметрической форме являются:
· точное соответствие ее состава определенной химической формуле;
· химическая устойчивость в достаточно широком интервале температур, отсутствие гигроскопичности;
· как можно большая молекулярная масса с наименьшим содержанием
в ней определяемого компонента для уменьшения влияния погрешностей
при взвешивании на результат анализа.
В ГРАВИМЕТРИЧЕСКОМ МЕТОДЕ АНАЛИЗА
Гравиметрический анализ включает два экспериментальных измерения: определение массы навески m н анализируемого вещества и массы продукта известного состава, полученного из этой навески, то есть массы гравиметрической формы m гр.ф анализируемого вещества.
На основании этих данных несложно вычислить массовую процентную долю w, % определяемого компонента в навеске:
Значение гравиметрических факторов, рассчитанное с высокой точностью, приводится в справочной литературе.
Р е ш е н и е. Необходимо допустить, что Fе3О4 количественно превращается в Fе2О3 и для этого имеется достаточное количество кислорода:
Из каждого моля Fе3О4 получается 3/2 моля Fе2О3. Таким образом, число молей Fе2О3 больше, чем число молей Fе3О4, в 3/2 раза, то есть:
Из формулы m(Fе2О3) = 3/2 (m(Fе3О4) ∙ М(Fе2О3)) / М(Fе3О4)
и подставляем в нее численные значения:
m(Fе2О3) = 1,63 ∙(3 ∙ 159,7) / (2 ∙ 231,5) = 1,687 ≈ 1,69 г.
Гравиметрический фактор F равен:
Следовательно, в общем случае гравиметрический фактор определяют по формуле:
Однако не во всех случаях эти расчеты применимы. При косвенном определении железа в Fе2(SО4)3, которое заключается в осаждении и взвешивании BaSО4 (гравиметрическая форма), при расчете аналитического фактора в числителе и знаменателе формулы нет общего элемента. Здесь необходим другой способ выражения химической эквивалентности между этими величинами:
Гравиметрический фактор для массовой процентной доли железа будет выражаться:
Пример 2. Раствор препарата Nа3РО4 ( m н = 0,7030 г) осадили в виде MgNН4РО4∙ 6Н2О. После фильтрования и промывания осадок прокалили при 1000 ˚С. Масса полученного осадка Mg2P2О7 составила 0.4320 г. Рассчитайте массовую процентную долю фосфора в навеске
w, %(Р) = 0,4320 ∙ 0,2782 ∙ 100 / 0,7030 = 17,10 %.
Пример 3. При прокаливании загрязненного препарата натрия оксалата m н = 1,3906 г получили остаток массой m гр.ф = 1,1436 г. Определите степень чистоты образца. t
Ре ш е н и е. Следует допустить, что разница между исходной и конечной массами соответствует потере углерода оксида при прокаливании. Анализ основан на измерении этой величины:
ВЫБОР МАССЫ НАВЕСКИ В ГРАВИМЕТРИИ
Как известно, точность анализа зависит как от массы навески, так и от массы гравиметрической формы, получаемой из нее. Если навеска будет взята с большой точностью, а полученная из нее гравиметрическая форма будет малой величиной, измеренной с большой погрешностью, то весь анализ будет выполнен с ошибкой, допущенной при взвешивании гравиметрической формы. Поэтому должна быть взята такая навеска, чтобы при ее взвешивании и при взвешивании полученной из нее гравиметрической формы ошибка не превышала ± 0,2 %. Для этого необходимо определить минимальную массу, которую еще можно взвесить с точностью ± 0,2 % на аналитических весах с абсолютной ошибкой взвешивания ± 0,0001 г, а минимальная ошибка, учитывая возможный разброс (±), в этом случае будет равной 2 ∙ (±0,000 1) = ±0,0002 г.
Следовательно, такой минимальной массой m min является 0,1 г. При величине, меньшей чем 0,1 г, ошибка превысит 0,2 %. При расчете массы навески в гравиметрическом анализе масса гравиметрической формы компонента приравнивается к минимальной массе вещества:
Если величина массы навески, рассчитанная по указанной формуле, окажется менее 0,1 г, то навеску следует увеличить до 0,1 г. Чаще всего массу исходной навески указывают в методике анализа или же для объемных аморфных осадков массу навески берут около 0,1, а для кристаллических от 0,1 до 0,5 г.
Расчет количества осадителя проводят с учетом возможного содержания определяемого компонента в анализируемой пробе. Для полноты выделения осадка применяют умеренный избыток осадителя. Если осадитель летуч (например, раствор хлороводородной кислоты), берут двух-, трехкратный избыток, который впоследствии удаляют при нагревании осадка. Если осадитель нелетуч (растворы бария хлорида, аммония оксалата, серебра нитрата и т. п.), достаточно его полуторакратного избытка.
АНАЛИТИЧЕСКИЕ ВЕСЫ. ПРАВИЛА ОБРАЩЕНИЯ С НИМИ
Правила обращения с аналитическими весами включают следующие основные требования:
1. Весы должны быть установлены на жестко закрепленной поверхности,
2. Недопустимы резкие колебания температуры, действие прямых солнечных лучей, а также воздействие на аналитические весы химических веществ.
3. Предельно допустимая нагрузка аналитических весов должна быть не более 200 г.
4. При взвешивании предметов на аналитических весах необходимо, чтобы они имели температуру весовой комнаты.
5. Взвешиваемое вещество помещают на левую чашку весов в специальной таре (бюксы, тигли, часовое стекло). Гири аналитического разновеса помещают на правую чашку весов.
6. Взвешиваемые предметы и гири вносят через боковые дверцы весов (шторки). Взвешивание производят только при закрытых дверцах весов.
7. Гири аналитического разновеса берут только специально предназначенным пинцетом. Все операции со сменой разновеса производят при полном арретировании весов.
8. До и после каждого взвешивания необходимо проверять нулевую точку весов.
9. Во избежание перекоса чашек весов гири и взвешиваемые предметы помещают в центр чашек.
10. Запись результатов взвешивания проводят по пустым гнездам аналитического разновеса и по данным барабанов с десятыми и сотыми долями грамма. Третий и четвертый знаки после запятой снимают со светящегося табло.
11. По окончании взвешивания необходимо убедиться, что весы арретированы, полностью разгружены и дверцы футляра плотно закрыты.
12. Для уменьшения ошибки взвешивания необходимо пользоваться аналитическим разновесом, предназначенным для строго определенных аналитических весов.
Следует отметить, что даже при соблюдении всех упомянутых правил
могут возникать ошибки взвешивания, зависящие от различных причин:
· вызванные неравноплечестью коромысла весов;
· за счет изменения массы тела в процессе взвешивания;
· за счет взвешивания в воздухе, а не в вакууме;
· вызванные несоответствием массы гирь (разновесов) их номинальной
ПРИМЕНЕНИЕ ГРАВИМЕТРИЧЕСКОГО МЕТОДА АНАЛИЗА
Иногда в основу гравиметрических определений положено восстановление определяемого компонента до элемента, который служит гравиметрической формой.
Для гравиметрического определения неорганических веществ предложен ряд органических реагентов, которые, как правило, обладают большей селективностью. Известны два класса органических реагентов. Первые образуют малорастворимые комплексные (координационные) соединения и содержат не менее двух функциональных групп, имеющих пару неподеленных электронов. Еще их называют хелатообразующими реагентами, например 8-оксихинолин осаждает более двадцати катионов:
Растворимость оксихинолятов металлов изменяется в широких пределах в зависимости от природы катиона, значения рН среды.
Диацетилдиоксим (диметилглиоксим) отличается высокой селективностью, и его широко используют для гравиметрического определения малых концентраций никеля:
ПОГРЕШНОСТИ ГРАВИМЕТРИИ
Гравиметрический метод анализа дает наиболее правильный результат, и, несмотря на длительность и трудоемкость, его очень часто применяют как проверочный метод в арбитражных анализах. Систематические методические ошибки в гравиметрии могут быть учтены и уменьшены в ходе выполнения соответствующих операций ( табл. 1.2).
Методические погрешности гравиметрии
Гравиметри-ческая операция
Абсолютная погрешность
положительная (завышенный результат)
отрицательная (заниженный результат)
а) природа осадителя
б) количество осадителя
Нелетучий, неспецифический осадитель
Небольшой избыток осадителя, соосаждение посторонних ионов
Высокая растворимость осаждаемой формы, коллоидообразование
Недостаток осадителя. Слишком большой избыток осадителя, повышение растворимости осадка в результате комплексообразования или солевого эффекта
Соосаждение посторонних ионов
Недостаточное время созревания (кристаллические осадки). Коллоидообразование (аморфные осадки)
Неправильный выбор фильтра – прохождение частиц осадка через фильтр
Промывание нелетучей промывной жидкостью
Избыток промывной жидкости: пептизация аморфного осадка; гидролиз кристаллического осадка. Потери в результате растворимости
Получение гравиметри-ческой формы
Температура прокаливания: получение соединения другого состава, гигроскопичность, поглощение СО2 из воздуха
Превышение температуры высушивания для осадков органической природы. Превышение температуры прокаливания (получения соединения другого химического состава)
Правильность метода объясняется малой систематической ошибкой измерений, связанной с точностью взвешивания на аналитических весах:
Анализ приведенных данных показывает, что выявить вид ошибки можно при рассмотрении методики определения с учетом механизма образования осадка, свойств веществ, используемых и получающихся в ходе анализа.
В настоящее время значение гравиметрических методов анализа несколько уменьшилось, однако не следует забывать, что, имея достоинства и недостатки, гравиметрический анализ является оптимальным для решения достаточно большого количества аналитических задач.