для чего реакция преципитации
Реакция преципитации



Реакция преципитации (РП)– это осаждение растворимого антигена при действии антител в присутствии электролита. Видимый эффект реакции (феномен преципитации) – помутнение (образование мутного кольца или осадка – преципитата).
РП применяют для обнаружения неизвестного антигена при ряде инфекционных заболеваний: при сибирской язве, туляремии, менингите, оспе. В судебной медицине ее используют для определения видовой принадлежности крови, спермы; в санитарно-гигиенических исследованиях – для установления фальсификации пищевых продуктов. РП отличается очень высокой чувствительностью и позволяет обнаружить антиген в разведении 1:1 000 000 и 1: 10 000 000.
Компоненты реакции преципитации.
2. Антитела (преципитины)находятся в сыворотке крови человека или в иммунных диагностических преципитирующих сыворотках, которые содержат известные антитела.
3. Электролит – изотонический раствор хлорида натрия.
Получаютпутемизмельчения материала и извлечения из него белковых антигенов кипячением или другими способами.
Получение преципитирующих сывороток.
Получают путем гипериммунизации кроликов соответствующими преципитиногенами. Такие сыворотки содержат антитела к тем преципитиногенам, которыми иммунизировали кроликов.
Примеры преципитирующих сывороток: преципитирующая сибиреязвенная сыворотка (содержит антитела к антигенам возбудителя сибирской язвы), преципитирующая противоменингококковая сыворотка (содержит антитела против антигенов возбудителя менингита) и др.
Титр преципитирующей сыворотки – это наибольшее разведение преципитиногена, при котором сыворотка еще дает реакцию преципитации.
Способы постановки РП.
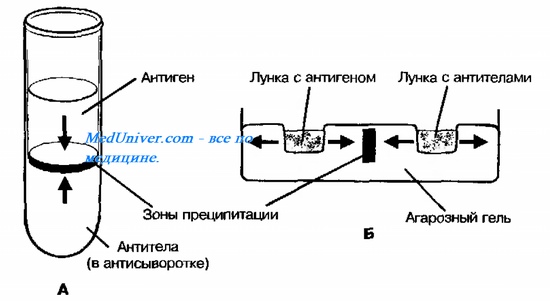
1. Реакция кольцепреципитации – проводится в специальных преципитационных пробирках (диаметр – 0,4-0,5 см, высота – 7-8 см). В пробирку вносят 0,2 – 0,3 мл преципитирующей сыворотки и по стенке длинным носиком пастеровской пипетки осторожно наслаивают такое же количество преципитиногена. Затем осторожно из горизонтального положения пробирки ставят вертикально.
Учет результатов реакции проводят по появлению белого кольца на границе антиген-антитело. При положительной реакции наблюдается образование такого кольца. В этом случае антиген соответствует антителу и происходит их связывание.
Если в качестве преципитиногена используют прокипяченные и профильтрованные водные экстракты органов и тканей, то реакция называется реакцией термокольцепреципитации (например, при диагностике сибирской язвы).
2. Реакция преципитации в геле – проводится в чашках Петри или на предметных стеклах, куда помещают слой агарового геля. При застывании геля в нем вырезают лунки, в которые помещают антигены или антитела, или и то и другое. Различают 2 метода РП в геле:
а) метод простой (радиальной) иммунодиффузии : один из компонентов реакции иммунитета (антиген или антитело) помещают в лунку, а другой компонент – смешивают с агаром; при положительном результате(антиген соответствует антителу) вокруг лунки образуется кольцо преципитата;
б) метод двойной иммунодиффузии : и антитело и антиген помещают в отдельные лунки, они диффундируют в агаровом геле навстречу друг другу; при положительном результате на месте встрече антитела и антигена образуются линии преципитации.
Примером РП в гелеявляетсяреакция двойной иммунодиффузии по Оухтерлони при диагностике дифтерии
Иммуноэлектрофорез – это метод, который сочетает метод электрофореза и реакцию преципитации. Смесь антигенов (например, белков сыворотки крови) разделяется в геле при помощи электрофореза. Затем, чтобы найти и определить нужный белок (неизвестный антиген), используют диагностическую преципитирующую сыворотку, которая содержит антитела к этому белку (известное антитело). Для этого в канавку параллельно белкам вносится диагностическая сыворотка. Если среди белков имеется тот, который соответствует антителу, находящемуся в сыворотке, то вокруг него образуются линии преципитации.
Для чего реакция преципитации
61. Реакции преципитации. Механизм, компоненты, способы постановки, применение. Реакция иммунодиффузии. Иммуноэлектрофорез. Иммунная электронная микроскопия.
Реакция преципитации — РП (от лат. praeci- pito — осаждать,) — это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса. В отличие от реакции агглютинации антигеном для реакции преципитации служат растворимые соединения, величина частичек которых приближается к размерам молекул. Это могут быть белки, комплексы белков с углеводами и липидами, бактериальные экстракты, различные дизаты или фильтраты бульонных культур микробов. Антитела, участвующие в реакции преципитации, называют преципитинами. Образующийся мелкодисперсный комплекс антиген — антитело выявляется при определенных методах постановки реакции преципитации.
Реакция кольцепреципитации предложена впервые Асколи. Ее используют при диагностике сибирской язвы, чумы, туляремии, менингита. Метод прост и доступен.
В узкие преципитационные пробирки разливают специфическую иммунную преципитирующую сыворотку и на нее очень осторожно наслаивают антиген. В качестве антигена берут, например, при диагностике сибирской язвы кусочки кожи, шерсти, шкуры павшего животного и др. Их кипятят, жидкость фильтруют и используют как антиген. Появление на границе двух жидкостей кольца — преципитата свидетельствует о наличии соответствующего антигена.
Реакция преципитации в агаровом геле, или метод диффузионной преципитации, позволяет детально изучить состав сложных водорастворимых антигенных смесей. Для постановки реакции используют гель (полужидкий или более густой агар). Каждый компонент, входящий в состав антигена, диффундирует навстречу соответствующему антителу с разной скоростью. Поэтому комплексы различных антигенов и соответствующих антител располагаются в разных участках геля, где и образуются линии преципитации. Каждая из линий соответствует только одному комплексу антиген — антитело. Реакцию преципитации ставят обычно при комнатной температуре.
Метод иммуноэлектрофореза получил широкое распространение в последние годы при исследовании антигенной структуры микробов. Комплекс антигенов помещают в луночку, которая находится в центре агарового геля, залитого на пластинку. Затем через агаровый гель пропускают электрический ток, в результате чего различные антигены, входящие в комплекс, перемещаются в поле электрического тока в зависимости от их электрофоретической подвижности. После окончания электрофореза в траншею, расположенную по краю пластинки, вносят специфическую иммунную сыворотку и помещают во влажную камеру. В местах образования комплекса антиген — антитело появляются линии преципитации.
Реакции преципитации ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое распространение получили разновидности реакции преципитации в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони. радиальная иммунодиффузия, иммуноэлектрофорез и др
Реакция радиальной иммунодиффузии. Иммунную сыворотку с расплавленным агаровым гелем равномерно наливают на стекло. После застывания в геле делают лунки, в которые помещают антиген в различных разведениях. Антиген, диффундируя в гель, образует с антителами кольце- зые зоны преципитации вокруг лунок (рис. 13.7). Диаметр кольца преципитации пропорционален концентрации антигена. Реакцию используют лля определения содержания в крови иммуноглобулинов различных классов, компонентов системы комплемента и др.
Иммунная электронная микроскопия — электронная микроскопия микробов, чаще вирусов, обработанных соответствующими антителами. Вирусы, обработанные иммунной сывороткой, образуют иммунные агрегаты (микропреципитаты). Вокруг вирионов образуется «венчик» из антител, контрастированный фосфорно-вольфрамовой кислотой или другими электронно-оптически плотными препаратами.
Для чего реакция преципитации
Реакции преципитации (РП) [от лат. praecipito, осаждать] предложены Краусом (1897) и основаны на феномене образования видимого осадка (преципитата) или общего помутнения среды после взаимодействия растворимых либо находящихся в коллоидном дисперсном состоянии Аг с AT. РП ставят в специальных узких пробирках. В качестве реагентов используют гипериммунные преципитирующие сыворотки с высокими титрами AT к гомологичным Аг. При постановке РП разводят не сыворотку, а Аг. Реакционная среда должна содержать электролиты (физиологический раствор) и иметь нейтральный рН. РП позволяет быстро (в течение нескольких секунд) выявлять незначительные количества Аг. Они очень чувствительны, и их применяют для тонкого иммунохимического анализа, выявляющего отдельные компоненты в смеси Аг. Метод имеет несколько разновидностей (рис. 10-16).
Реакция кольцепреципитации
На слой антисыворотки наслаивают жидкость, содержащую растворимый Аг, и через несколько секунд наблюдают образование кольца преципитата (рис. 10-16, А). Широкое распространение получила реакция термопреципитации Асколи на Аг возбудителя сибирской язвы, использующая Аг, экстрагированные кипячением из различного сельскохозяйственного сырья.
Реакцией кольцепреципитации также выявляют AT к бруцеллам в молоке (кольцевая проба Банга).
Реакция микропреципитации
Для выявления низких титров AT (например, при сенсибилизации к ЛС) применяют нефелометрическую реакцию микропреципитации (или реакция помутнения), предложенная Уанье (1955). При её постановке в исследуемую сыворотку крови вносят Аг в убывающей концентрации; при отсутствии AT разведение сыворотки крови Аг уменьшает её оптическую плотность. Однако в присутствии минимальных количеств AT образуются микропреципитаты, повышающие оптическую плотность среды.
ПРЕЦИПИТАЦИЯ
ПРЕЦИПИТАЦИЯ (лат. praecipitatio стремительное падение) — иммунологическая реакция осаждения из раствора комплекса антиген—антитело, образующегося в результате соединения растворимого антигена (преципитиногена) со специфическими антителами (преципитинами).
Реакцию Преципитации широко используют для идентификации и количественного определения самых разнообразных антигенов и антител (см. Иммунодиагностика), при серодиагностике инфекционных болезней (см. Серологические исследования), для обнаружения примесей в пищевых продуктах, при изучении эволюционных взаимосвязей в животном и растительном мире, при исследовании структуры различных биол, соединений, в судебной медицине для определения видовой принадлежности пятен крови и других биол, жидкостей.
Преципитация открыта в 1897 т. Краусом (R. Kraus), наблюдавшим выпадение осадка (преципитата) при смешивании бесклеточных прозрачных фильтратов бульонных культур бактерий чумы, холеры, тифа с гомологичными иммунными сыворотками. В 1899 г. Ф. Я. Чистович, иммунизируя кроликов сывороткой угря, получил преципитирующие антитела и тем самым впервые продемонстрировал видовую специфичность белков сыворотки крови. Применение П. в суд.-мед. экспертизе для определения видовой принадлежности крови было предложено в 1901 г. П. Уленгутом. Реакция получила название реакции Чистовича — Уленгута. Впоследствии было показано, что преципитирующие антитела (см.) образуются у представителей различных видов позвоночных к любым чужеродным высокомолекулярным веществам (см. Антигены). Преципитирующие антитела принадлежат к иммуноглобулинам классов G и M (см. Иммуноглобулины). Скорость и интенсивность биосинтеза преципитирующих антител определяются рядом факторов: дозой и путем введения антигена, схемой иммунизации, особенностями хим. структуры антигена и генетическими особенностями иммунизируемого организма.
Для получения преципитирующих сывороток используют различные схемы иммунизации. Хорошие результаты дают схемы из нескольких циклов иммунизации, каждый из которых включает несколько внутривенных или внутримышечных инъекций антигена в возрастающих количествах. В 1915 г. М. И. Райский предложил схему, состоящую из первичной иммунизации и отдаленной реиммунизации. На этом принципе основано получение преципитирующих сывороток высокого титра. Первичную иммунизацию принято проводить антигеном в смеси с каким-либо депонирующим веществом (ланолином, минеральным маслом, алюмокалиевыми квасцами и др.), усиливающим иммунный ответ, а отдаленную реиммунизацию — только антигеном. Широко применяют в качестве депонирующего вещества адъювант (усилитель) Фрейнда, состоящий из смеси минеральных масел и убитых микобактерий туберкулеза (см. Адъюванты).
Раствор антигена, эмульгированный в равном объеме адъюванта Фрейнда, вводят экспериментальным животным подкожно или внутримышечно в несколько точек спины либо в подушечки задних лапок или в подколенные лимфатические узлы задних конечностей. В некоторых схемах используют комбинации перечисленных способов введения. Через месяц животным вводят р-р антигена внутривенно или внутримышечно. При необходимости перед реиммунизацией проводят гипосенсибилизацию по Безредке (см. Безредки методы). При незначительном расходе антигена (1—3 мг для белковых антигенов на курс иммунизации) количество образующихся антител достигает нескольких миллиграммов в 1 мл иммунной сыворотки.
Для реакции преципитации характерна высокая специфичность. В серии работ К. Ландштейнера с антисыворотками к конъюгированным антигенам, в качестве детерминантных групп которых выступали различные органические радикалы, было продемонстрировано, что в реакции П. можно дифференцировать стереоизомеры органических соединений. Сила наблюдающихся перекрестных реакций определяется близостью хим. структуры детерминантных групп иммуноантигенов и тест-антигенов. В состав преципитата входят антигены и специфичные к ним антитела и практически не включаются другие белки сыворотки крови, кроме комплемента.
П.— высокочувствительная реакция. С ее помощью могут быть обнаружены десятые доли микрограмма антигена. При определении антител порог чувствительности реакции составляет ок. 20 мкг белка. Чувствительность реакции значительно повышается, если применяют антигены или антитела, меченные радиоактивными изотопами (см.).
Постановка реакции
При постановке реакции преципитации необходимо учитывать ее зональный характер, который выражается в том, что молекулярный состав и количество образующегося преципитата определяются соотношением введенных в реакцию антигена и антител (см. Антиген — антитело реакция). При использовании постоянного количества антисыворотки и возрастающих количеств антигена количество преципитата в ряду пробирок вначале увеличивается, достигает максимума, а затем уменьшается вплоть до полного исчезновения. В надосадочной жидкости первых пробирок обнаруживают свободные антитела (зона избытка антител), в жидкости над максимальным преципитатом не содержатся ни свободные антитела, ни свободный антиген (зона эквивалентности), в надосадочной жидкости последних пробирок находят растворимые иммунные комплексы и свободный антиген (зона избытка антигена). Образование растворимых иммунных комплексов с небольшим молекулярным весом в зоне избытка антигена характерно для всех преципитирующих систем, антитела в которых принадлежат к IgG. Эта зона реакции названа поэтому зоной задержки, или постзоной. Следует отметить, что иммунные комплексы антигенов с IgM-антителами нерастворимы в очень большом избытке антигена, в десятки раз превышающем его количество, достаточное для образования растворимых иммунных комплексов с IgG-антителами.
Для лошадиных противобелковых сывороток характерно образование растворимых иммунных комплексов и в зоне избытка антител, т. е. образование прозоны (см. Нейссера-Вексберга феномен). Эту особенность реакции впервые обнаружил Г. Рамон в системе дифтерийный токсин — антитоксическая лошадиная сыворотка (см. Флоккуляция). Растворение иммунных комплексов в зоне избытка антител наблюдали впоследствии при проведении П. с кроличьими и собачьими сыворотками крови против бычьего сывороточного альбумина, с человеческой сывороткой крови против тиреоглобулина, овечьей антисывороткой против синтетических полипептидов.
Молекулярный состав преципитата определяется также мол. весом (массой) антигена. Для яичного альбумина, мол. вес к-рого 42 000 дальтон, в зоне эквивалентности на одну молекулу антигена приходится в среднем 2,5 молекулы антител. С увеличением мол. веса антигена число молекул антител, связываемых одной молекулой антигена, увеличивается.
К полуколичественным методам П. могут быть отнесены методы оценки силы сывороток и количества антигенов по их предельному разведению, дающему еще видимую П. со стандартным антигеном или анти-сывороткой, и методы оптимальных пропорций.
При титровании сывороток по предельному разведению необходимо подбирать такое количество антигена, чтобы не попасть в зону задержки. Поэтому предварительно определяют наименьшее разведение тест-антигена, при к-ром происходит реакция с заведомо положительной сывороткой. Это рабочее разведение (дозу) антигена используют для определения предельного разведения (титра) испытуемых сывороток. Сравнительное титрование антигена методом предельных разведений можно проводить без предварительного подбора рабочей дозы сыворотки, если она содержит антитела преципитирующего, но не флоккулирующего типа.
Метод оптимальных пропорций основан на определении точки эквивалентности серол. системы по инициальной И. и на том наблюдении, что точка эквивалентности в каждой серол. системе возникает при определенном отношении антитела к антигену. Поэтому при титровании сывороток, определив по быстроте П. количество стандартного антигена, соответствующее точке эквивалентности, можно выразить ее активность в любых условных биол. единицах, если в предварительном титровании с сывороткой известной силы установлено, скольким ее единицам эквивалентен стандартный антиген. Аналогичные расчеты проводят при титровании антигена со стандартной сывороткой. Метод оптимальных пропорций может быть выполнен в a-варианте, предложенном Дином и Уэббом (H. Dean, R. Webb, 1928),— с постоянным объемом сыворотки и возрастающими разведениями антигена и в ß-варианте, предложенном Г. Рамоном (1922),— с постоянным объемом антигена и возрастающими разведениями сыворотки.
Количественный метод определения антител в весовых единицах, предложенный в 1933 г. Гейдельбергером (М. Heidelberger) и Кендаллом (F. Е. Kendall), основан на том, что в зоне эквивалентности из раствора в осадок выпадают практически весь антиген и все антитела. Определив любым хим. методом количество белка преципитата в этой точке и вычтя из него количество прибавленного в пробу антигена, рассчитывают количество белка в осадке, приходящееся на долю антител.
При постановке П. любым из описанных методов следует работать с хорошо отцентрифугированными р-рами антигенов и сывороток. Реакция должна сопровождаться контролем: иммунная сыворотка + изотонический р-р хлорида натрия, нормальная сыворотка + антиген, гетерологическая сыворотка + антиген. Следует предотвращать возможность бактериального загрязнения, выполняя П. в стерильных условиях или применяя консерванты типа мертиолата, амида натрия. Реакцию выполняют при физиол. концентрации соли (0,15 М раствор хлорида натрия), в диапазоне pH 6,5—8,0.
П.— двухфазная реакция. Фазы реакции отличаются по механизму и скорости протекания (см. Антиген-антитело реакция). Следует учитывать, что на вторую фазу реакции — собственно образование преципитата — оказывает влияние ряд неспецифических факторов: концентрация в растворе солей и водородных ионов, температура, объем реагентов. При увеличении концентрации солей выше физиол, значения (0,15 М) количество образующегося преципитата уменьшается. В 15% р-ре хлорида натрия преципитаты, образованные полисахаридными антигенами, диссоциируют. Изменение концентрации водородных ионов в физиол. пределах pH (от 6,5 до 8,0) заметно не влияет на формирование преципитата. При снижении pH раствора до 5,0 или повышении до 9,0 существенно уменьшается количество образующегося преципитата, а при pH ниже 3,0 и выше 11,0 ранее образованные преципитаты диссоциируют. На свойстве преципитатов диссоциировать в крепких солевых р-рах и при крайних значениях pH основаны методы выделения чистых антител и антигенов из специфических преципитатов. Наиболее употребляемые диссоциирующие агенты — концентрированные р-ры нейтральных солей, разбавленные к-ты и щелочи, концентрированные р-ры амидов, полианионы.
Преципитация в судебно-медицинском отношении
В судебной медицине П. применяют для дифференцирования крови человека и животных (см. Кровь). Наибольшее распространение получила кольцепреципитация, но она не пригодна для исследования мутных р-ров антигена и подвержена неспецифическим влияниям загрязнений объекта экспертизы. Этих недостатков лишена П. в агаровом геле, однако она требует длительных сроков наблюдения и менее чувствительна. Внедряют в практику электропреципитацию, или встречный иммуноэлектрофорез (см.), сочетающий достоинства П. в агаре с высокой чувствительностью и быстротой проведения реакции. Все варианты П. осуществляют с иммунными сыворотками (см.), преципитирующими белки человека, собаки, лошади и др. Они должны быть активны и специфичны, т. е. вызывать П. гомологичного антигена (напр., соответствующей нормальной сыворотки крови человека пли животного) и не образовывать преципитата с гетерологичными (чужеродными) антигенами.
Из исследуемых пятен крови готовят вытяжки и разводят их до необходимой концентрации белка. Для П. в агаре можно брать вырезки (вытяжки) из пятен и проводить реакцию с несколькими преципитирующими сыворотками. Параллельно испытывают контрольные участки предмета — носителя пятен, которые не должны вызывать П. При положительном результате с пятном крови и преципитирующей сывороткой делают вывод о видовой принадлежности крови, напр. кровь человека, собаки и др. При этом нельзя точно установить происхождение крови, если она принадлежит близкородственным животным (напр., кровь собаки или волка). Отрицательный результат при наличии в вытяжке белка свидетельствует о принадлежности крови животному, белок к-рого не выявляется с помощью обычного набора преципитирующих сывороток. Если в вытяжке не установлен белок, то принимают во внимание лишь положительный результат, т. к. отсутствие преципитата можно объяснить недостаточным количеством белка в вытяжке.
Библиография: Бойд У. Основы иммунологии, пер. с англ., с. 314, М., 1969; Кэбот Е. и Мейер М. Экспериментальная иммунохимия, пер. с англ., с. 8 и др., М., 1968; Райский М. Быстрое получение крепких преципитинов, Харьковск. мед. журн.,т. 20, № 8, с. 135, 1915; он же, Повторная иммунизация, как метод получения преципитирующих сывороток, там же, с. 142; он же, Как долго сохраняются в крови иммунизированного животного крепкие преципитины, там же, № 9, с. 161; он же, Как нужно иммунизировать, чтобы животное устойчиво и длительно сохраняло в крови крепкие преципитины, там же, с. 169; Туманов А. К. Основы судебно-медицинской экспертизы вещественных доказательств с. 57,М., 1975; Чарный В. И. Установление видовой специфичности белков крови, М., 1976; Чистович Ф. Я. Изменения свойств крови при впрыскивании инородной сыворотки и крови, в связи с теорией иммунитета Ehrlich’a, Рус. арх. патол., клин, мед. и бакт., т. 8, в. 1, с. 21, 1899; Carpenter Ph. L. Immunology and serology, Philadelphia, 1975; Methods in immunology and immunochemistry, ed. by C. A. Williams a. M. W. Chase, v. 3, N. Y.— L., 1971.
И. А. Тарханова; В. И. Чарный (суд.).
Реакция преципитации в геле, по Асколе
Реакция преципитации
Реакция преципитации — РП (от лат. praeci- pito — осаждать,) — это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса.
В отличие от реакции агглютинации антигеном для реакции преципитации служат растворимые соединения, величина частичек которых приближается к размерам молекул. Это могут быть белки, комплексы белков с углеводами и липидами, бактериальные экстракты, различные дизаты или фильтраты бульонных культур микробов. Антитела, участвующие в реакции преципитации, называют преципитинами. Образующийся мелкодисперсный комплекс антиген — антитело выявляется при определенных методах постановки реакции преципитации.
Реакция кольцепреципитации предложена впервые Асколи. Ее используют при диагностике сибирской язвы, чумы, туляремии, менингита. Метод прост и доступен.
В узкие преципитационные пробирки разливают специфическую иммунную преципитирующую сыворотку и на нее очень осторожно наслаивают антиген. В качестве антигена берут, например, при диагностике сибирской язвы кусочки кожи, шерсти, шкуры павшего животного и др. Их кипятят, жидкость фильтруют и используют как антиген. Появление на границе двух жидкостей кольца — преципитата свидетельствует о наличии соответствующего антигена.
Реакция преципитации в агаровом геле, или метод диффузионной преципитации, позволяет детально изучить состав сложных водорастворимых антигенных смесей. Для постановки реакции используют гель (полужидкий или более густой агар). Каждый компонент, входящий в состав антигена, диффундирует навстречу соответствующему антителу с разной скоростью. Поэтому комплексы различных антигенов и соответствующих антител располагаются в разных участках геля, где и образуются линии преципитации. Каждая из линий соответствует только одному комплексу антиген — антитело. Реакцию преципитации ставят обычно при комнатной температуре.
Метод иммуноэлектрофореза получил широкое распространение в последние годы при исследовании антигенной структуры микробов. Комплекс антигенов помещают в луночку, которая находится в центре агарового геля, залитого на пластинку. Затем через агаровый гель пропускают электрический ток, в результате чего различные антигены, входящие в комплекс, перемещаются в поле электрического тока в зависимости от их электрофоретической подвижности. После окончания электрофореза в траншею, расположенную по краю пластинки, вносят специфическую иммунную сыворотку и помещают во влажную камеру. В местах образования комплекса антиген — антитело появляются линии преципитации.
Реакции преципитации ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое распространение получили разновидности реакции преципитации в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони. радиальная иммунодиффузия, иммуноэлектрофорез и др
Реакция радиальной иммунодиффузии. Иммунную сыворотку с расплавленным агаровым гелем равномерно наливают на стекло. После застывания в геле делают лунки, в которые помещают антиген в различных разведениях. Антиген, диффундируя в гель, образует с антителами кольце- зые зоны преципитации вокруг лунок (рис. 13.7). Диаметр кольца преципитации пропорционален концентрации антигена. Реакцию используют лля определения содержания в крови иммуноглобулинов различных классов, компонентов системы комплемента и др.
Иммуноэлектрофорез — сочетание метода электрофореза и иммунопреципитации: смесь антигенов вносится в лунки геля и разделяется в геле с помощью электрофореза. Затем в канавку параллельно зонам электрофореза зносят иммунную сыворотку, антитела которой, диффундируя в гель, образуют в месте — встречи» с антигеном линии преципитации.
Иммунная электронная микроскопия — электронная микроскопия микробов, чаще вирусов, обработанных соответствующими антителами. Вирусы, обработанные иммунной сывороткой, образуют иммунные агрегаты (микропреципитаты). Вокруг вирионов образуется «венчик» из антител, контрастированный фосфорно-вольфрамовой кислотой или другими электронно-оптически плотными препаратами.
Реакция преципитации в геле
Реакция преципитации в геле для определения токсигенности микроорганизмов, механизм, методы постановки
Реакция преципитации (РП) — это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса.
В 1946 г. Дж. Оудин предложил метод простой диффузии, по которому один из компонентов реакции преципитации, обычно сыворотка, находится в геле, а другой — антиген — наслаивается на первый в виде раствора.
Антиген, диффундируя в гель, образует в нем с антителами белые линии преципитации, хорошо видимые при боковом освещении. В 1948 г. Ё. Оухтерлоню разработал еще более простой и удобный метод встречной двумерной диффузии, позволяющий проводить прямое сравнение различных антигенов и сывороток. Этот метод также является весьма ценным при исследовании перекрестных реакций.

Антитела и антигены диффундируют навстречу друг другу, и в участках, где создаются их эквивалентные концентрации, образуются дугообразные полосы преципитации. Если полосы преципитации, идущие от двух соседних луночек, сливаются, это указывает на наличие нескольких антигенных компонентов в исследуемой жидкости. Реакцию встречной диффузии по Оухтерлоню часто применяют для определения токсигенности бактерий, например дифтерийных.
Дальнейшим развитием метода преципитации в геле является иммуноэлектрофорез. Этим термином обозначают метод, объединяющий электрофоретическое разделение смеси антигенов и встречную диффузию по Оухтерлоню на одной и той же пластинке агарового геля. Преципитирующую сыворотку при этом наливают в канавку, вырезанную в геле параллельно направлению электрофоретического разделения.
Образующиеся в результате реакции линии преципитации имеют вид дуг, вытянутых в направлении электрофоретического движения фракций антигенов. Иммуноэлектрофорез позволяет определять состав сложных смесей растворимых антигенов, содержащих до 30 компонентов, и является поэтому ценным диагностическим методом.
Реакция преципитации. Её модификации
Реакцией преципитации (РП) называется осаждение из раствора Аг (преципитиногена) при воздействии на него иммунной сыворотки (преципитина) и электролита.
Посредством РП можно выявить антиген в разведениях 1:100 000 и даже 1:1 000 000, т. е. в таких малых количествах, которые не обнаруживаются химическим путем.
Преципитиногены представляют собой ультрамикроскопические частицы белково–ПС прир: экстракты из мкÒ, органов и тк, пат материала; продукты распада бактериальной клетки, их лизаты, фильтраты. Преципитиногены обладают термоустойчивостью, поэтому для их получения материал подвергается кипячению.
В РП используются жидкие прозрачные Аг.
Преципитирующие сыворотки обычно получают гипериммунизацией кроликов циклами в течение нескольких месяцев, вводя им бактериальные взвеси, фильтраты бульонных культур, аутолизаты, солевые экстракты микроорганизмов, сывороточные белки.
Постановка РП Асколи. В узкую пробирку с небольшим кол-вом неразведенной преципитирующей сыворотки, держа ее в наклонном положении, пипеткой медленно по стенке наслаивается такой же объем Аг.
Чтобы не смешать две жидкости, пробирку осторожно ставят вертикально. При положительной реакции в пробирке на границе между сывороткой и исследуемым экстрактом через 5–10 мин появляется серовато–белое кольцо. Постановка реакции обязательно сопровождается контролями сыворотки и антигена.
Реакция Асколи применяется для идентификации сибиреязвенного, туляремийного, чумного Аг.
Она нашла также применение в судебной медицине для опред-я видовой принадлежности белка, в частности кровяных пятен, в санитарной практике при выявлении фальсификации мясных, рыбных, мучных изделий, примесей в молоке. Недостатком этой РП является нестойкость преципитата (кольца), который исчезает даже при легком встряхивании. Кроме того, с ее помощью нельзя определить количественный состав Аг, участвующих в формировании преципитата.
Реакция преципитации Оухтерлони. Реакцию ставят на чашках Петри в лунках агарового геля.
В качестве геля используют хорошо отмытый прозрачный агар. Аг и сыворотки вносятся в агаровый гель так, чтобы лунки, содержащие их, находились на определенном расстоянии. Диффундируя навстречу друг другу и соединяясь друг с другом, антитело и антиген образуют через 24–48 ч иммунный комплекс в виде белой полосы.
При наличии сложного по составу преципитиногена возникает несколько полос. При этом полосы серологически родственных антигенов сливаются воедино, а полосы разнородных перекрещиваются, что позволяет определить детали антигенной структуры исследуемых веществ.
Широко используется для диагностики заболеваний, вызываемых вирусами и бактериями, продуцирующими экзотоксины.
3.Реакция непрямой гемагглютинации (РНГА). Ставится для обнаружения полисахаридов, белков, экстрактов бактерий, микоплазм, риккетсий и вирусов, иммунные комплексы которых с агглютининами в обычных классических РА увидеть не удается, или же для выявления антител в сыворотках больных к этим высокодисперсным веществам и мельчайшим микроорганизмам.
РНГА для серодиагностики инфекционных болезней. Используя РНГА для обнаружения антител в сыворотках больных, готовят ЭРИТРОЦИТАРНЫЕ АНТИГЕННЫЕ ДИАГНОСТИКУМЫ.
Для этого эритроциты обрабатывают 15 мин раствором танина в разведении 1:20 000–1:200 000, что придает им устойчивость и повышает адсорбционную способность. Затем их смешивают с известным антигеном и инкубируют в течение 2 ч при температуре 37°С.. Сенсибилизированные антигеном эритроциты 2–3 раза отмывают изотоническим раствором натрия хлорида и добавляют к сыворотке, разведенной и разлитой в лунки панелей.
Контролем служат взвеси интактных и нагруженных антигеном эритроцитов, которые вносят в сыворотки, дающие заведомо положительную и отрицательную реакции.
Результаты реакции учитывают через 2 ч после инкубации в термостате и оценивают плюсами: «++++» – эритроциты покрывают лунку в виде зонтика с неровными краями; «–» – скопление эритроцитов в виде «пуговицы»
Реакция кольцепреципитации
Реакция кольцеприцепитации – одна из наиболее простых серологических методов. Она выполняется в узких преципитационных пробирках. Сначала во все пробирки поровну разливают прозрачный раствор антигена, взятого в нескольких разведениях (1:2; 1:4; 1:8; 1:16).
Соединение антигенов и антител происходит на границе соприкосновения реагентов. В результате этого взаимодействия в положительных случаях (когда антиген соответствует антителу) через некоторое время происходит образование преципитата в виде опалесцирующего кольца.
Реакция нашла широкое применение в медицинской практике для выявления в шерсти, шкурах, мясе животных сибиреязвенного антигена (реакция Асколи); для обнаружения других возбудителей инфекционных болезней в патологическом материале, полученном от больных, или в объектах внешней среды, а также в судебно-медицинской экспертизе для определения видовой принадлежности белка в частности, белка крови или других биологических жидкостей.
Иммунодиффузия по Оухтерлони
Реакция преципитации может быть поставлена в агаровом геле.
Метод основан на том, что частицы антигенов и антител из-за различных размеров диффундируют в геле с неодинаковой скоростью и вследствие этого продвигаются на разные расстояния. Это позволяет разделить отдельные системы антигенов в тех случаях, когда они находятся в смеси, и, следовательно, дает возможность изучить антигенную структуру бактерий и сложных белковых веществ, сывороток и тканей животных.
Наглядный и эффективный метод преципитации в геле предложил Оухтерлони.
На чашках Петри с агаром делают небольшие лунки, вырезанные на некотором расстоянии друг от друга. В один из них наливают антиген, в другие — сыворотки. Компоненты реакции диффундируют в геле по направлению друг к другу и образуют видимую линию преципитации там, где антигены встречаются с оптимальными концентрациями специфических для него антител. Поскольку реагенты диффундируют из лунок концентрически, можно провести сразу несколько исследований, если разместить вокруг лунки с антителами несколько лунок с разными антигенами (или с разными разведениями одного и того же антигена).
Реакция Оухтерлони дает возможность делать заключение о природе антигена по известной сыворотке и, наоборот, по известному антигену определяется природа антител.
Преимущество метода – в том, что он позволяет сравнить антигенные компоненты сложных смесей и судить об их общности или различиях. Для сравнения общности антигенов готовят агар с лунками: в одну наливают антисыворотку, в другие – сравниваемые антигены. Если антигены различны, то полосы преципитации располагаются неодинаково.
Иммуноэлектрофорез
В последние годы для тонких иммунологических исследований применяется метод иммуноэлектрофореза. Метод впервые описали П.
Грабар и К. А. Уильямс в 1953 г. Он представляет собой сочетание электрофореза в агаровом геле на стеклянных пластинках с иммунодиффузией. В начале проводится электрофоретическое разделение антигена, зачастую представляющего собой смесь белковых или других молекул. Для этого антиген вносят в заранее вырезанную в агаре лунку, и пластинку с агаром на некоторое время помещают в зону постоянного электрического тока.
Из-за разной скорости движения молекул происходит разделение антигена на составляющие части. После этого в канавку, вырезанную в направлении, параллельном движению тока, вносят преципитирующую иммунную сыворотку.
Антиген и антисыворотка диффундируют в геле навстречу друг другу.
Каждый антиген дает зону преципитации в виде дуги с соответствующими для него антителами. Число, положение и форма этих линий дают представление о составе исходной смеси антигена.
Реакция флоккуляции
Метод предложен Рамоном в 1924 году.
Он основан на том, что смесь токсина с антитоксической сывороткой в определенных условиях дает помутнение и выпадение осадка. При этом реакция наступает раньше в тех пробирках, где количество антитоксина соответствует дозе, полностью нейтрализующей данное количество токсина.
Следовательно, если известна сила токсина, то можно установить количество антитоксина в неизвестной испытуемой сыворотке. Для этого готовят несколько разведений исследуемой сыворотки, добавляют к каждому разведению одинаковые количества известного токсина, после чего наблюдают, в какой из пробирок раньше всего наступит флоккуляция (помутнение раствора). Определяют инициальную флоккуляцию. Затем производиться расчет.
Например, требуется определить концентрацию противодифтерийных антител в исследуемой сыворотке. В реакции применяется дифтерийный токсин, содержащий 50 Lf в 1 мл (Lf – это минимальное количество токсина, которое нейтрализуется 1 антитоксической единицей (АЕ) антисыворотки.
Допустим, что инициальная флоккуляция отмечена в пробирке, где находилось 0,2 мл этой сыворотки и 2 мл известного токсина активностью 100 Lf (50 Lf х 2).
Значит, 0,2 мл сыворотки нейтрализовали этот токсин. Следовательно, 0,2 мл сыворотки содержат 100АЕ, а в 1 мл этой сыворотки концентрация антител соответствует 500 АЕ (100 АЕ х 5).
Аналогичным методом реакцию флоккуляции можно применять и с противоположной целью – для определения иммунизирующих свойств анатоксинов.
Для этого необходима стандартная антитоксическая сыворотка.
Реакция нейтрализации
Реакция применяется при диагностике пищевых бактериальных отравлениях для определения в исследуемом материале бактериальных токсинов. Кроме того, ее можно ставить при исследовании некоторых объектов внешней среды на содержание патогенных бактерий, продуцирующих токсины, например, при исследовании почвы на наличие возбудителей столбняка или газовой гангрены.
Известно, что токсин в смеси с гомологической антитоксической сывороткой не проявляет своего токсического действия, так как токсин нейтрализуется. Реакция взаимодействия токсина с антитоксином, как правило, строго специфична, поэтому для постановки реакции нейтрализации с целью определения типа токсина необходимо иметь диагностические сыворотки, специфические к каждому виду и типу токсина. Можно применять одновременно применять смесь 2-3 антитоксических сывороток и более, если предполагается наличие в исследуемом материале несколько токсинов.
Реакция нейтрализации позволяет определить вид и тип токсина возбудителя.
Исследуемым материалом может быть фильтрат пищевых продуктов, предположительно вызвавших отравление, смывы с посуды, где находились эти продукты и др.
Предварительно проводится нейтрализация предполагаемого токсина. Для этого в пробирку с исследуемым материалом ( опытная пробирка ) добавляется антитоксическая диагностическая сыворотка (она содержит антитела к искомому токсину); в другую пробирку (контрольную) доливается равный объем физиологического раствора.
После кратковременной инкубации содержимое пробирок вводится двум группам белых мышей (опытной и контрольной).
Результаты реакции нейтрализации учитывают сразу же после гибели контрольных животных. В таком случае факт выживания животных, получивших антитоксическую сыворотку вместе с исследуемым материалом, указывает на наличие в нем токсина, соответствующего вводимой сыворотке.
Достоинством реакции нейтрализации является высокая достоверность получаемых результатов.
Однако по своей чувствительности и быстроте получения ответа она уступает некоторым другим методам исследования.
Реакции лизиса
Реакциями лизиса принято называть растворение корпускулярных антигенов под действием антител, специфичных в отношении данного антигена, в присутствии комплемента.
Из иммунных реакций, основанных на феномене лизиса бактерий и других корпускулярных антигенов, применяются, главным образом, реакции бактериолиза и гемолиза.
Реакция бактериолиза
Реакция происходит как in vitro, так и in vivo. Последняя известна под названием реакции В.И. Исаева – Пфейффера.
Этими учеными показано, что если морских свинок предварительно проиммунизировать холерными антигенами, то последующее введение им в брюшную полость высоковирулентной культуры холерного вибриона не вызывает заражения животных, так как в брюшной полости происходит растворение возбудителя под воздействием специфических антител.
В дальнейшем И. И. Мечников доказал, что аналогичное растворение холерного вибриона под воздействием иммунной сыворотки происходит и в пробирке, если к основным компонентам добавить свежую сыворотку — источник комплемента. Растворение бактерий под действием специфических антител в присутствии комплемента получило название реакции бактериолиза.
При постановке реакции бактериолиза сначала готовят ряд 10-кратных разведений исследуемой сыворотки. Затем в каждуюпробирку добавляют одинаковое количество (по 1-2 капли)микробной взвеси. К смеси добавляют комплемент. После инкубирования при 37 °С из каждой пробирки делается высев смеси на питательную среду для установления наличия или отсутствия жизнеспособных бактерий.
Реакцию можно применять для определения антител с помощью известного микроорганизма или для определения вида микробов с помощью диагностической иммунной сыворотки.
В практической работе бактериологов эта реакция применяется редко, главным образом, для дифференциации холерных и холероподобных вибрионов.
Реакция гемолиза
Механизм гемолиза аналогичен механизму бактериолиза.
Используемые в реакции эритроциты являются антигеном. Источником антител является антиэритроцитарная сыворотка (например, если в реакции применяются бараньи эритроциты, то необходимую сыворотку со специфическими антиэритроцитарными антителами получают от кроликов, иммунизированных бараньими эритроцитами).
В качестве комплемента в реакциях лизиса чаще всего используется сыворотка крови морской свинки, так как в ней содержится значительно больше комплемента, чем в сыворотках других животных.
В тех случаях, когда антитела в присутствии комплемента разрушают эритроциты, из них выходит гемоглобин, и реагирующая смесь из мутной взвеси эритроцитов превращается в прозрачную красную жидкость (лаковая кровь).
Такую реакцию называют гемолизом. В лабораторной практике она применяется в качестве показателя адсорбции комплемента в реакции связывания комплемента.
Преципитации реакция
Ветеринарная микробиология и ее задачи
РА впервые разработана М.Грубером в 1896 г.
Сущность реакции заключается во взаимодействии антитела с антигеном, в результате чего происходит склеивание (агглютинация) микробов с образованием хлопьев, комочков, видимых невооруженным глазом.
РА широко применяется для серологической диагностики многих бактериальных инфекций (бруцеллеза, сапа, сальмонеллезов, колибактериоза и др.) и для серологической идентификации видов и типов выделенных микроорганизмов.
Существует несколько методов постановки РА: пробирочный (объемный), капельный (пластинчатый), кровекапельный, кольцевая реакция с молоком, реакция гемагглютинации и ее варианты (РЗГА, РНГА), антиглобулиновый тест Кумбса и др.
^ – вместо сыворотки берется кровь.
Ставят пластинчатую реакцию. Диагностируют пуллороз кур и индеек, микоплазмоз кур.
Реакция Кумбс�� позволяет выявить неполные антитела. Последние одновалентны, в связи с чем они тормозят образование агглютината. Метод основан на применении антиглобулиновой сыворотки, служащей посредником для соединения неполных антител, фиксированных на корпускулярных антигенах (эритроциты, бактерии).
^ – она не относится к серологическим и диагностически точным реакциям, однако позволяет обнаружить антиген – гемагглютинин и установить гемагглютинирующие свойства (способность агглютинировать эритроциты) у некоторых бактерий и микоплазм.
РНГА – в последние годы заняла одно из ведущих мест в серодинамике.
Сущность ее заключается в том, что белковые молекулы антигена соответствующего возбудителя или антитела предварительно адсорбируют на обработанных танином эритроцитов барана или др. животного. Затем ставят реакцию путем смешивания сенсибилизированных эритроцитов с сыворотками крови больных животных или во втором случае с исследуемым антигеном.
При наличии в сыворотке спец. Антител на данный антиген (или наоборот) происходит агглютинация эритроцитов – реакция положительная.
Предложена Р.Краусом в 1897 году. Преципитация – явление, наблюдающееся при взаимодействии антител-преципитинов и антигена-преципитиногена.
Сущность реакции заключается в изменении дисперсности коллоидов антигена и их осаждением под влиянием специфических антител, находящихся в иммунной сыворотке. РП может быть поставлена в пробирках в жидкой среде (реакция кольцеприципитации) или в агаровом геле (пластинчатая РДП).
Реакция кольцеприципитации впервые предложена Асколи (1910), наиболее широко ее применяют в целях диагностики сибирской язвы.
При проведении ветеринарной экспертизы РП является методом определения фальсификации мясных, мучных и др. продуктов. Особое значение эта реакция имеет в судебно-медицинской экспертизе при определении видовой принадлежности крови. Применение реакции преципитации в жидкой среде не позволяет, однако, охарактеризовать гетерогенность антигенов, т.е.
количество и концентрацию антигенов в препарате. Данные сведения можно получить, если поставить РП в геле (чаще агаровом).
Обладая скоростью передвижения, различные антигены препарата неодинаково диффундируют, образуя в толще прозрачного геля не месте встречи с гомологичным антителом преципитаты.
Локализация и концентрация линий преципитинов будут характерны для каждого компонента антигенного препарата, что служит критерием его качества. Путем разведения препарата можно характеризовать относительное содержание в нем антигенов.
Разработано несколько методов постановки РДП: метод прямой одномерной диффузии по Удену (1946), метод простой радиальной иммунодиффузии по Манчини (1963), метод двойной диффузии в агаровый гель по Оухтерлони (1948) и др.
Реакцию впервые продемонстрировал Беринг и Китазато в 1890 г.
на модели столбнячных токсинов и антитоксинов. Сущность РН заключается в способности гомологичных антител иммунной сыворотки подавлять (нейтрализовать) инфекционные свойства возбудителя болезни или продуктов его жизнедеятельности. Для установления результата реакции смесью антиген-антитело заражают лабораторных животных, КК, КЭ.
Показатель положительно РН – отсутствие гибели биологических тест-систем. В бактериальной практике РН применяют при диагностике анаэробной энтеротоксемии, ботулизма и др. РН проводят с целью обнаружения и титрования токсинов, анатоксинов или антитоксинов.
Разработана Борде и Жангу (1901) на основе двух феноменов: бактериолиза и гемолиза.
Используют для выявления антител в сыворотке крови и для обнаружения в исследуемом материале антигена (при бруцеллезе, сапе, риккетсиозах, туберкулезе и др.).
Данная реакция относится к непрямой двухсистемной. В ней участвуют 5 компонентов:
Компоненты 3,4,5 составляют индикаторную систему.
Если антиген и антитело испытуемой сыворотки соответствуют друг другу, возникает иммунный комплекс антиген-антитело, который связывает и извлекает из среды, где протекает реакция, комплемент.
При отсутствии в испытуемой сыворотке антител, соответственных антигену, указанный комплекс не образуется – комплемент остается свободным.
Поскольку это невидимые процессы, то для решения вопроса, что же произошло с комплементом, в пробирку в качестве индикатора вводят компоненты гемолитической системы – гемолитическую сыворотку + эритроциты.
Если в бактериологической системе комплемент связался – гемолиз эритроцитов не произойдет, результат положительный – в сыворотке содержатся антитела. Наличие гемолиза служит показателем наличия свободного комплемента в бактериологической системе, что возможно только при отсутствии в испытуемой сыворотке антител – результат отрицательный.
РСК протекает при строгих количественных соотношениях компонентов.
Это достигается их предварительным титрованием (комплемент и гемолитическую сыворотку титруют в день постановки реакции; микробный антиген – один раз в течение 2-3 месяцев).
Титрование – определение наименьшего количества того или иного компонента в реакции для проведения реакции, лишнее или недостаток – искажение результатов.
РДСК – это вариант РСК, но отличающийся тем, что первая фаза реакции протекает в течение 16-18 часов на холоде (40С), что повышает чувствительность из-за более длительной адсорбции комплемента комплексом антиген-антитело.



