для чего ставят уколы в живот беременным
Использование гепаринов во время беременности

А говорит она о том, что в некоторых непростых ситуациях могут помочь антикоагулянты – гепарины. На сегодняшний день чаще всего беременным назначают НМГ (низкомолекулярные гепарины). Как показали исследования, такие препараты не проникают сквозь плацентарный барьер, а посему считаются безопасными для плода. Помимо НМГ в отдельных случаях могут также использоваться НФГ (нефракционированные гепарины) и непрямые коагулянты: антагонисты витамина К – АВК (например, варфарин). Применяются они строго по показаниям, с оценкой рисков пользы/вреда для матери и ребенка.
В целом, напомню, что гепарины назначают беременным с 2-мя целями:
Минимизировать риски невынашивания плода и задержку его развития у женщин с АФС (антифосфолипидным синдромом).
Предупредить и предотвратить ВТЭО (в том числе и у женщин с клапанными пороками сердца и при наличии протезированных клапанов).
По вопросу использования гепаринов во время беременности проведено немало исследований. Результаты разнятся. В некоторых случаях они вовсе неутешительны. К примеру, исследования, проведенные в ряде медицинских центров Германии и Австрии, говорят о том, что терапия низкомолекулярными гепаринами у женщин с повторной невынашиваемостью не уменьшает риск невынашивания (Ann Intern Med. 2015 May 5;162(9):601-9.). Эти выводы основываются на наблюдениях за 449-ю пациентками с повторяющейся потерей беременности непонятной этиологии.

Значит, гепарины справляются с задачей предотвращения тромбоза маточно-плацентарных сосудов (и, соответственно, предупреждают гипоксию, задержку развития плода и уменьшают риск выкидыша) на поздних срока беременности, а вот на ранних, к сожалению, они оказываются недейственными.
Что же касается связи тромбофилии и плаценто-зависимых осложнений, вывод таков: наличие или отсутствие тромбофилии едва ли влияет на эффективность гепаринов в плане минимизации вероятности развития осложнений.
Итак, гепарины в некоторых ситуациях, связанных с интересным положением женщин, очень важны! Только их подбором и назначением должен заниматься опытный доктор, ориентируясь, прежде всего, на анамнез пациентки.
Уколы при ЭКО: как правильно колоть самой?
Большинство протоколов ЭКО включают курс гормональных уколов для стимуляции яичников, подготовки организма женщины к имплантации эмбрионов, сохранения беременности после процедуры. Как правило, инъекции проводятся врачом при посещении пациенткой медицинского учреждения или амбулаторно. Однако, это не всегда удобно или возможно – например, если женщина работает или находится далеко от клиники. Такие инъекции можно выполнять и самостоятельно, но пациентка должна четко представлять, как колоть уколы при ЭКО, чтобы они были максимально эффективными и безопасными.
Какие уколы при ЭКО назначаются?
При подготовке и проведении экстракорпорального оплодотворения пациентке назначаются следующие виды гормональных инъекций:
Помимо этих основных групп веществ, при ЭКО могут назначаться инъекции других гормонов, антикоагулянтов, препятствующих тромбозу вен и т. д. Список препаратов зависит от того, какой протокол ЭКО назначен пациентке. Например, в длинном поочередно используются препараты для стимуляции и сдерживания овуляции, чтобы синхронизировать процессы в женском организме и тем самым увеличить шансы на успешное зачатие. В коротком и естественном протоколе ЭКО уколы гормонов могут использоваться минимально или отсутствовать вовсе, чтобы не вызвать синдром гиперстимуляции яичников.
Подготовка к уколам при ЭКО
Инъекции в рамках экстракорпорального оплодотворения осуществляются подкожно или внутримышечно. Оба способа упрощают процедуру и делают ее более безопасной, так как нет необходимости вводить иглу непосредственно в вену. Тем не менее, такие уколы тоже требуют подготовки и определенных знаний.
Подкожные инъекции совершаются в определенные места на теле, где имеется достаточный слой жировой клетчатки:
Точки вхождения иглы при каждом уколе нужно выбирать новые (в пределах указанных областей). Если делать инъекции в одно и то же место, то из-за травматизации тканей в нем возникнет воспалительный очаг, который может либо инфицироваться, либо сильно уплотниться из-за рубцевания.
Перед тем, как делать уколы при ЭКО, необходимо купить назначенные врачом препараты. Сегодня они поставляются в удобных одноразовых шприц-капсулах или в многоразовых шприцах со сменными иглами. Помимо этого, для безопасного проведения инъекций нужны:
Если репродуктолог назначил инъекции только половины флакона, оставшуюся часть препарата нужно хранить в холодильнике в плотно закрытой емкости.
Как делать уколы при ЭКО в живот?
Самостоятельные инъекции не являются сложной процедурой, но требуют внимания и аккуратности. Поэтому предварительно выберите для их проведения спокойное место с хорошим освещением. Расстелите на доступной поверхности чистое полотенце, на котором разложите все необходимые инструменты для укола перед ЭКО – шприц, флакон с препаратом, сменные иглы, салфетку для инъекций, марлевую подушку. Далее действуйте по следующему алгоритму:
После ЭКО уколы прогестерона выполняются в ягодичную мышцу. В целом алгоритм действий тот же, однако этот гормон поставляется в виде ампул с жировым раствором, которые предварительно нужно разогреть, потерев между ладоней или подержать в теплом (но не горячем) месте. Слегка разогретый препарат разжижается и легче втягивается в шприц.
Подготовив инструмент к инъекции, встаньте перед зеркалом, обнажите ягодицу, мысленно разделив ее на 4 части – колите в верхний наружный участок, предварительно обработав его спиртом. Собирать кожный валик не нужно, так как прогестерон вводится внутримышечно. Одним резким движением введите иглу под углом в 90 градусов до упора и надавите на кнопку шприца. Масляный препарат будет выходить из иглы с некоторым затруднением – паниковать не нужно, просто подождите, пока шприц полностью не опустеет. Затем вытащите иглу, прижмите место укола салфеткой на несколько секунд, после чего утилизируйте расходники.
Безопасность гормональных уколов при ЭКО
При правильном выполнении всех действий риск повреждений минимален – вы почувствуете небольшую кратковременную боль в момент входа иглы. В месте укола возможно небольшое кровотечение, которое тут же останавливается. Важно выполнять инъекцию быстро и аккуратно, без волнения, так как при любом промедлении ткани повреждаются сильнее, что приведет к образованию подкожной или внутримышечной гематомы (синяка). Опасности для здоровья и жизни она не представляет, но место укола будет болеть сильнее, а препарат всасываться тканями – хуже.
Перед тем, как ставить при ЭКО укол в живот или ягодицу, обязательно проконсультируйтесь с врачом – он подробно расскажет и покажет, как выполнять процедуру. Обязательно соблюдайте рекомендованную специалистом дозу препаратов и выполняйте инъекции регулярно в одно и то же время суток. В противном случае возможна гормональная передозировка, способная спровоцировать синдром гиперстимуляции и другие негативные побочные эффекты.
Как правильно применять Клексан?
Акушер-гинеколог Кикина Юлия о правильном применении кроворазжижающих препаратов.
Клексан — лишь один из многих препаратов, которые применяются в медицине, в том числе акушерстве, гинекологии и репродуктологии для разжижения крови. Таким же эффектом обладают, например, фраксипарин, фрагмин и другие. Все это — низкомолекулярные гепарины. Их особенность — противостояние формированию тромбов, благодаря которому удается спасти жизнь многим людям (в том числе при сегодняшней опасной вирусной инфекции), а также — сохранить беременность и помочь избежать осложнений при терапии гормональными препаратами.
От всех этих проблем спасает адекватное и своевременное применение антикоагулянтов.
Когда мы их применяем
Когда мы их отменяем
Я прекрасно знаю, насколько вы грамотны и начитаны. Вы практически в деталях наслышаны о тромбофилиях, мутации Лейдена, повышении уровня и прочих (достаточно сложных!) вещах, когда приходится прибегать к вмешательству в процесс гемостаза. И многие девушки, приходя на прием, сами просят назначить Клексан, прочитав на форумах, насколько он полезен и важен. И часто их в этом поддерживают доктора из женских консультаций, которые назначают антикоагулянты, мониторя уровень на фоне беременности, пугая при этом и без того запуганных женщин возможными осложнениями. Но вот тут хотелось бы малость притормозить ваше рвение. Несмотря на те хвалебные слова препарату, что я написала выше, я прошу вас не применять его без назначений врача и не повышать рекомендуемые дозировки!
Однажды мне довелось присутствовать на очень поучительной лекции врача гематолога, кандидата медицинских наук Виноградовой Марии Алексеевны. Тогда она поделилась несколькими случаями из своей практики, когда неоправданный прием гепаринов только на основании анализа крови на тромбофилии и мониторинга уровня привел к тяжелым осложнениям во время беременности: формированию пневмонии внутрилегочного кровотечения, носовых и ушных кровотечений. Все это удалось устранить путем отмены лишних препаратов. Но, по ее словам, борьба с аналогичными ситуациями в ее практике происходит постоянно.
Всегда важно помнить, что у любой медали две стороны. Благоприятный эффект препарат дает лишь тогда, когда правильно подобрана дозировка, и проводится адекватный мониторинг его эффективности. Нет необходимости применять гепариновые препараты в качестве профилактической терапии (за несколько месяцев до протокола, например). С такими случаями мне тоже приходилось сталкиваться, когда женщина применяла Клексан «для подготовки к беременности» в связи с тем, что у нее выявлены несколько форм так называемых тромбофилий. Гепарины действуют, только пока вы их колете. Накопительным эффектом эти лекарства не обладают, поэтому такая подготовка ни к чему кроме потери средств и провоцирования осложнений не приведет.
Дозировка препаратов подбирается индивидуально, исходя из веса пациента и под строгим контролем гемостазиограммы. Длительность приема препарата определяется также индивидуально, в зависимости от показаний — от нескольких дней до нескольких месяцев.
И еще один момент, который важно знать: препараты гепаринов входят в список ОМС и выдаются в программе ЭКО по ОМС бесплатно (правда количество ампул в этом случае ограничено).
Применение низкомолекулярных гепаринов в акушерской практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Д о настоящего времени тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают 2 типа ГИТ: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
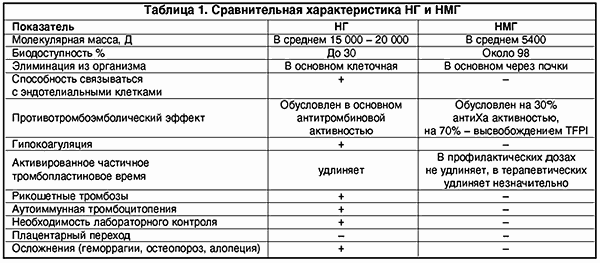
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
Последние 5-7 лет в клиническую медицину активно внедряются низкомолекулярные гепарины (НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора (ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.