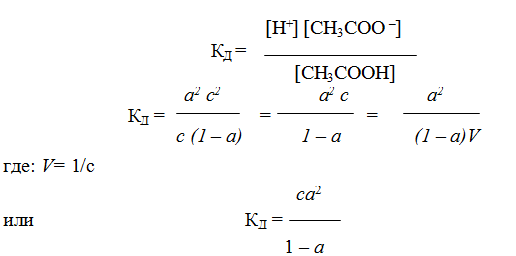докажите что диссоциация электролита
Докажите что диссоциация электролита
Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счёт движения электронов в электрическом поле, либо за счет движения ионов. Электрическая проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединения, обладающим ионным строением, например, солям в твёрдом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить на две категории:
а) вещества, растворы которых обладают ионной проводимостью, называются электролитами;
б) вещества, растворы которых не обладают ионной проводимостью, называются неэлектролитами.
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты, углеводы.
Оказалось, что, кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давлениями пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств, шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации.
Сущность теории электролитической диссоциации С. Аррениуса
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы: положительные (катионы) и отрицательные (анионы).
Электролиты подразделяются в зависимости от степени диссоциации на сильные и слабые.
вещества, которые диссоциируют полностью и необратимо, т. е. в растворе присутствуют только гидратиро-ванные ионы. Относятся все соли, сильные кислоты `»HI»`, `»HCl»`, `»HBr»`, `»HNO»_3`, `»H»_2″SO»_4`, `»HMnO»_4`, `»HClO»_4`, `»HClO»_3`, щелочи `»NaOH»`, `»LiOH»`, `»KOH»`, `»RbOH»`, `»CsOH»`, `»Ca»(«OH»)_2`, `»Ba»(«OH»)_2`, `»Sr»(«OH»)_2`.
С точки зрения теории электролитической диссоциации, кислотой называется соединение, образующее при диссоциации в водном растворе только ионы `»H»^+`:
Если кислота является двухосновной, то диссоциация кислоты происходит ступенчато. Количество стадий определяется основностью кислоты:
Сила бескислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующего элемента: `»HCl»-«HBr»-«HI»`. Бромоводородная кислота `»HBr»` и йодоводородная `»HI»` кислоты сильнее хлороводородной, что объясняется увеличением межъядерных расстояний в их молекулах.
Фтороводородная (плавиковая) кислота `»HF»` растворяет стекло, но это вовсе не говорит о её силе. В ряду бескислородных галогенсодержащих кислот она относится к кислотам средней силы ввиду низкой концентрации в растворе ионов водорода из-за способности молекул `»HF»` к объединению (ассоциации), благодаря сильным водородным связям, возникающим при взаимодействии ионов `»F»^-` с молекулами `»HF»` (водородные связи) с образованием ионов `»HF»_2^-`, `»H»_2″F»_3^-` и других боле сложных частиц. В результате концентрация ионов водорода в водном растворе фтороводородной кислоты оказывается сильно пониженной.
Сила однотипных кислородных кислот изменяется в противоположном направлении, например, йодная кислота `»HIO»_4` слабее хлорной кислоты `»HClO»_4`. Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность.
Так, в ряду кислот `»HClO»-«HClO»_2-«HClO»_3-«HClO»_4` хлорная кислота наиболее сильная.
Схематически процесс распада (диссоциации) соляной кислоты на ионы можно представить следующим образом. Чтобы вещество в воде было электролитом, его молекула должна быть полярной.
Полярная молекула вещества окружена полярными молекулами воды, которые разрывают молекулу на две противоположно заряженные частицы – ионы.
с точки зрения теории электролитической диссоциации, представляет собой вещество, способное отдавать в растворе гидроксильную группу `»OH»^-`:
Диссоциация многокислотного гидроксида происходит ступенчато, например:
В свете теории электролитической диссоциации соли представляют собой соединения, образующие в водном растворе положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка (для средних солей), а также кроме них ионы водорода (для кислых солей) и гидроксид-ионы (для основных солей):
вещества, которые диссоциируют частично и обратимо.
В растворе слабого электролита присутствуют гидратированные ионы и некоторая часть недиссоциированных молекул.
К слабым электролитам относятся:
3) оставшиеся кислоты, не относящиеся к сильным, например, `»HF»`, `»H»_2″S»`, `»HNO»_2`, `»H»_3″PO»_4` и другие, а также незамещённые органические кислоты. При растворении углекислого газа в воде образуется его гидрат `»CO»_2*»H»_2″O»` и в незначительном количестве угольная кислота `»H»_2″CO»_3`. Тем не менее, для диссоциации воспользуемся формулой угольной кислоты:
Практически диссоциация осуществляется лишь по первой ступени. Образующийся гидрокарбонат-ион `»HCO»_3^-` ведёт себя как слабый электролит.
Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем. В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы.
Диссоциации проходит благодаря тому, что при гидратации ионов выделяется больше энергии, чем требуется на разрыв связи в молекуле. Примерно также происходит растворение ионного кристалла в воде и образование ионов. У кристаллов энергия гидратации ионов выше энергии кристаллической решётки.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. При некоторой постоянной температуре в данной системе устанавливается химическое равновесие, при котором скорость диссоциации станет равной скорости ассоциации.
Основные свойства гидроксидов одного и того же элемента усиливаются с уменьшением его валентности. Так, основные свойства у гидроксида железа (II) выражены сильнее, чем у гидроксида железа (III) и наоборот.
Слабым электролитом является гидроксид аммония `»NH»_4″OH»`. При растворении аммиака `»NH»_3` в воде образуется раствор, который слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора основная. В растворе образуются гидрат аммиака `»NH»_3*»H»_2″O»` и в незначительном количестве гидроксид аммония `»NH»_4″OH»`, который диссоциирует как слабый электролит с образованием ионов аммония `»NH»_4^+` и гидроксид-иона `»OH»^-`.
К слабым электролитам относят некоторые соли, например хлорид цинка `»ZnCl»_2`, тиоцианат железа `»Fe»(«NCS»)_3`, цианид ртути `»Hg»(«CN»)_2`, которые также диссоциируют по ступеням.
Разделение электролитов на сильные, средние и слабые зависит от доли продиссоциированных молекул или степени диссоциации `alpha`, которая показывает отношение числа молекул, распавшихся на ионы `(N_»д»)`, к общему числу введённых в раствор молекул `(N_»р»)`:
Степень диссоциации не является строгим показателем силы электролита, т. к. она зависит от концентрации раствора, природы растворителя, присутствия в растворе другие электролитов.
При понижении концентрации степень диссоциации может повышаться, и в очень разбавленных растворах слабый электролит может находиться в состоянии почти полной диссоциации, в то же время в концентрированном растворе сильный электролит может вести себя как слабый и даже как неэлектролит.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор). Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
Поскольку диссоциация слабого электролита является обратимым равновесным процессом, то к данной реакции применим закон действующих масс, и можно определить константу равновесия как
`[AK]` – концентрация недиссоцированных молекул;
Рассчитайте количество ионов водорода в `1` л раствора серной кислоты с концентрацией `0,1` моль/л.
Количество ионов водорода равно `0,1` моль.
Запишем уравнение диссоциации по второй ступени и по справочным данным определим степень диссоциации (`0,3`):
Используем формулу для нахождения степени диссоциации (при решении задачи степень диссоциации удобно выразить в долях от единицы):
`n(«диссоцH»_2″SO»_4)=0,1` моль/л `*0,3=0,03` моль.
Таким образом, в растворе появилось ионов `»H»^+` :
`0,1` моль `+ 0,03` моль `= 0,13` моль.
Следовательно, концентрация ионов водорода в растворе серной кислоты равна `0,13` моль/л.
Степень диссоциации гидроксида бария по первой ступени `- 92%`, по второй ступени `- 56%`. Рассчитайте число катионов бария и число гидроксид-ионов в `0,5` л `1,5 M` растворе.
1) Запишем уравнение электролитической диссоциации гидроксида бария:
1 ступень: `»Ba(OH»)_2-> «BaOH»^+ + «OH»^-`,
2) Найдём количество вещества гидроксида бария, содержащегося в данном образце раствора:
3) Зная степень диссоциации вычислим число молекул `»Ba(OH»)_2` распавшихся на ионы по первой ступени диссоциации:
Согласно диссоциации по `»I»` ступени, это количество вещества равно количеству вещества гидроксид-ионов, образовавшихся по первой ступени диссоциации, и количество ионов `»Ba(OH»)^+`:
4) Исходя из количества вещества гидроксокатионов бария, образовавшихся на первой стадии диссоциации, и степени диссоциации по второй ступени, вычислим количество ионов `»Ba»(«OH»)^+`, диссоциирующих по второй ступени:
В соответствии с диссоциацией по `»II»` ступени, это количество вещества равно количеству вещества катионов `»Ba»^(2+)` и количеству ионов `»OH»^-`, образовавшихся по `»II»` ступени диссоциации:
5) Найдём число катионов `»Ba»^(2+)`, образующихся при диссоциации:
6) Вычислим количество вещества гидроксид-ионов, образовавшихся на обеих стадиях диссоциации, и их число:
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Электролитическая диссоциация
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.

Вещества, которые проводят электрический ток назвали электролитами, вещества, непроводящие ток – неэлектролиты. Электролиты делятся на сильные и слабые. Сильные хорошо проводят ток, лампочка горит ярко, слабые – плохо проводят ток, лампочка горит тускло, например, в растворе уксусной кислоты (см. рисунок).
В чем же причина электропроводности? Почему одни вещества проводят электрический ток, а другие нет?
Электрический ток – это направленно движение заряженных частиц под действием разности потенциалов. Электрический ток в металлах осуществляется за счет электронов, именно электроны являются носителями заряда. А в растворах и расплавах заряд переносят ионы. Вещества, которые распадаются на ионы в растворе или расплаве и проводят электрический ток называются электролитами.
Запомнить! Электролиты – вещества, которые проводят электрический ток в растворах. Электролиты в растворах распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам. Это и есть причина электрического тока в растворах.
Химическая связь в электролитах — ионная или ковалентная сильнополярная (соли, кислоты, основания).
Неэлектролиты – вещества, которые не проводят электрический ток в растворах. Связь в таких веществах — ковалентная неполярная и слабополярная. При растворении они образуют не ионы, а молекулы, которые не способны переносить электрический ток, например, органические вещества (сахароза, бензин, спирт).
Теория электролитической диссоциации была сформулирована Сванте Аррениусом в 1887 году, но актуальна и по сей день. Основные положения этой теории:
Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации.
В зависимости от значения степени диссоциации, электролиты можно разделить на сильные, средние и слабые.
Сильные электролиты имеют степень диссоциации α > 30%, средние от 3 – 30%, а слабые – меньше 3%.
К сильным относят все раств. соли, все щелочи и некоторые кислоты. В растворе эти соединения практически полностью распадаются на ионы.
При написании уравнений диссоциации помните, что суммарный заряд катионов и анионов должен быть равен нулю.
Эти реакции распада на ионы протекают необратимо (только в одну сторону), ионы обратно не соединяются в кристаллическую решетку, препятствуют молекулы воды, окружающие эти ионы (гидратные оболочки).
К электролиам средней силы относят гидроксид магния, сернистую и фосфорную кислоты.
К слабым электролитам, которые лишь частично распадаются на ионы, α Опубликовано admin в 15:59
Растворы электролитов. Степень диссоциации. Константа диссоциации
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Растворы электролитов.
Примерами растворов электролитов могут служить растворы щелочей, солей и неорганических кислот в воде, растворы ряда солей и жидком аммиаке и некоторых органических растворителях, например ацетонитриле.
Растворы электролитов являются ионными проводниками (проводниками второго рода). В них наблюдаются отклонения от законом Рауля и Вант-Гоффа. Например, согласно закона Рауля, при введении 0,1 моль вещества на 1000 г воды температура замерзания должна снижаться на 0,186 К, а фактически снижается на 0,318 К у NaCl и 0,52 К-у MgCl2. Вант-Гофф ввел поправочный коэффициент i, называемый изотоническим коэффициентом и позволяющий использовать это уравнение для любых разбавленных растворов:
Изотонический коэффициент характеризует отклонение от законов идеальных растворов вследствие электролитической диссоциации электролитов.
7.3.1. Степень диссоциации электролитов.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации а. По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, в также некоторые кислоты.
Электролиты, степень диссоциации которых в растворах меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, ряд кислот, основания р-, d- и f-элементов. Между этими двумя группами нет четкой границы, одно и то же вещество в одном растворителе проявляет свойства сильного, а в другом — слабого электролита. Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку,
при растворении в воде ведут себя как типичные сильные электролиты,
при растворении же в ацетоне или уксусной кислоте эти вещества
являются слабыми электролитами со степенью диссоциации в раствоpax меньше единицы.
7.3.2. Слабые электролиты. Константа диссоциации.
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты
константа равновесия КС равна
Константа равновесия для процесса диссоциации называется константой диссоциации КД. Например, константа диссоциации уксусной кислоты СН3СООН равна
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температурь и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается, что в соответствии с принципом Ле Шателье свидетельствует об экзотермическим характере реакции.
Константа диссоциации указывает на прочность молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Степень диссоциации изменяется с концентрацией раствора. Рассмотрим зависимость степени диссоциации от концентрации слабого электролита на примере уксусной кислоты:
Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с – ас 2 = с (1 – а). Подставив значения равновесных концентраций ионов и кислоты в уравнение (1), получим:
Уравнение (1) было получено Оствальдом и называется законом Оствальда. Если а « 1, то уравнение упрощается:
Уравнение (2а, 2б) называется законом разбавления Оствальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита. Аналогичное уравнение можно получить для слабого основания.
Многоосновные слабые кислоты и основания диссоциируют ступенчато, причем константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем по предыдущей.
7.3.3.Сильные электролиты.
Многие свойства растворов, такие, как осмотическое давление, температура кипения и замерзания, давление насыщенного пара, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность их зарядов и чем меньше среднее расстояние между ними.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью. Поэтому в уравнении диссоциации электролита стрелка указывает только на прямой процесс, например:
В растворах сильных электролитов из-за полной их диссоциации концентрация ионов велика. Поэтому свойства таких растворов существенно зависят от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Взаимодействие ионов в растворах сильных электролитов приводит к тому, что катионы и анионы испытывают взаимное притяжение, а ионы одного знака заряда будут отталкиваться друг от друга. Поэтому в растворе каждый произвольно выбранный ион окружен в среднем во времени преимущественно противоположно заряженными ионами, как, например, в ионных кристаллах. Однако энергия теплового движения ионов в жидких растворах и значительно выше, чем в кристаллах. Поэтому ионы, взаимодействующие с выбранным центральным ионом, располагаются вокруг него не в виде кристаллической решетки, а в виде сферы, которая, согласно П. Дюбая и Э. Хюккеля, называется ионной атмосферой. В состав ионной атмосферы входят катионы и анионы. Однако преобладают ионы, противоположные по знаку заряда центральному иону. Суммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку. Все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона. За счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т. е. ионная атмосфера имеет статистический характер.
Законы Рауля и Вант – Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Активность а связана с концентрацией следующим соотношением:
где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора, а также от температуры (табл. 18).
Таблица 18. Коэффициенты активности некоторых электролитов в растворах при 298 К