дсп болезнь что это
Неврологические расстройства при дискалгиях и дорсопатиях
ФАКТОРЫ РИСКА
Некорректируемые:
— стеноз позвоночного канала в поясничном, грудном или шейном отделах позвоночника;
— аномалии развития позвоночника;
— травмы.
Корректируемые:
— постоянная тяжелая физическая работа, неадекватные физические нагрузки с нагрузкой на все группы мышц, без учета индивидуальных особенностей опорно-двигательной системы;
— занятия спортивными упражнениями, танцами;
— частые психофизиологические перегрузки.
Этот процесс может продолжаться много лет. В пульпозном ядре МПД начинается деполимеризация гликозаминогликанов, деструкция коллагена в белково-полисахаридном комплексе и пролиферация хондроцитов. Последняя сопровождается накоплением молочной кислоты, что усиливает про-никновение гиалуронидазы в фиброзное кольцо и разрушение коллагена. Пульпозное ядро сначала разбухает, затем высыхает, теряя способность амортизировать нагрузки. Основное давление приходится в этом случае на фиброзное кольцо. Усиленное давление разрушает фиброзное кольцо и вытесняет его элементы в просвет позвоночного канала. В дистрофически измененных коллагеновых волокнах фиброзного кольца появляются трещины и разрывы, в которые внедряются ткани пульпозного ядра. По мере прогрессирования заболевания количество трещин в МПД увеличивается и, по данным гистологов, когда он разрушится на 2/3, появляются мелкие, чаще срединные, выпячивания задней части фиброзного кольца по 2-3 мм, раздражающие ЗПС, в которой имеется большое количество чувствительных нервных окончаний. Многообразные клинических проявленияй дорсалгий и дорсопатий зависят от мозаики распределения ФБ и вызываемых ими вазомоторных, вегетативных, мышечно-тонических и нейродистрофических неврологических расстройств.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические расстройства при дискалгиях и дорсопатиях следующие:
«Неуклюжий ребенок» или синдром диспраксии у детей
Все дети в ходе своего роста и развития проходят через стадию неуклюжести. Если жалобы на трудности координации и нарушения мелкой моторики сохраняются после 7 лет, необходимо выяснить, нет ли у этого ребенка диспраксии.
От 6 до 20% детей страдают диспраксией. По результатам последних исследований нарушение развития двигательных функций выявляется примерно у 50% детей, имеющих последствия гипоксически-ишемического повреждения головного мозга во время перинатального периода.
Причины возникновения диспраксии
Причины возникновения диспраксии окончательно неизвестны, но последние нейрофизиологические исследования указывают на то, что болезнь может вызываться недостаточным развитием или незрелостью нейронов головного мозга, а не их повреждением. Особую роль в развитии данного заболевания играет гипоксически-ишемическое повреждение головного мозга в перинатальном периоде.
Нарушение праксиса (способности к выполнению целенаправленных движений) может быть диагностировано только после седьмого года жизни, когда её можно отличить от расстройств координации и двигательных нарушений.
Диагноз «диспраксия» может быть поставлен только врачом-педиатром или детским неврологом, психоневрологом.
Проявления синдрома «неуклюжего ребенка»:
Дети с таким диагнозом испытывают определенные трудности в социальных отношениях, часто сверстники отказываются контактировать с ними. «Неумелому» ребенку не легко соответствовать здоровым детям в повседневной жизни. Такие дети характеризуются повышенной утомляемостью, ведь энергетические затраты на выполнение обычных ежедневных задач у них значительно выше, чем у здоровых сверстников.
Лечение диспраксии
Лечение диспраксии должно быть комплексным. В зависимости от вида и степени тяжести заболевания, в лечении должны принимать участие неврологи, психологи и логопеды.
Игры для развития координационных возможностей у детей с диспраксией:
(развивает мелкую моторику рук, осязание, тактильную чувствительность).
В непрозрачный мешок из ткани складывают до 10 небольших предметов, предварительно показав их ребенку: ручку, пробку от бутылки, блокнотик, пульт и др. Ребенок на ощупь определяет предметы, находящиеся в мешке.
(развивает моторику мелких мышц кисти, устную связную речь, память и воображение).
Во время проговаривания текста: «На двери висит замок.
«Чья лошадка быстрее».
(развивает координацию и быстроту движений крупных и мелких мышечных групп, формирует правильную осанку, тренирует внимание, улучшает зрение и слух, координирует движения туловища и конечностей).
Необходимы палочки длиной 20 см, шнурки или куски веревки, игрушечные лошадки или любые другие игрушки.
Дети сидят на стульях и держат в руках палочки, к которым за шнурки привязаны игрушечные лошадки (или другие игрушки) на расстоянии 15-20 шагов. По сигналу, дети начинают наматывать шнурок на палочку, приближая к себе игрушку.
(развивает внимание, память, приобретаются навыки игры в мяч).
Игроки становятся по кругу. Водящий в центре подкидывает мяч вверх и называет имя игрока. Названный игрок должен поймать мяч. Если мяч не пойман, игрок меняется местом с водящим. Побеждает тот, кто меньше всех был водящим.
Что такое детский церебральный паралич (ДЦП)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Морошек Е. А., детского невролога со стажем в 13 лет.
Определение болезни. Причины заболевания
Детский церебральный паралич (ДЦП) — это заболевание, при котором движения у ребёнка ограничены или отсутствуют, а поддержание вертикальной позы и ходьбы затруднено. Часто сопровождается сниженным интеллектом, задержкой речи и эпилепсией.
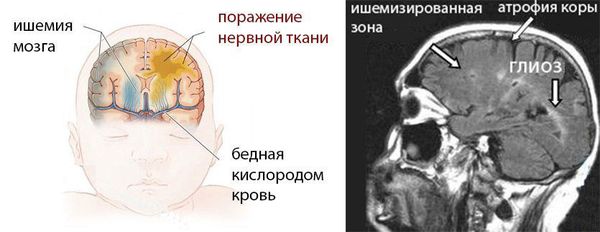
ДЦП формируется в результате пороков развития головного мозга до рождения или сразу после. Причины, которые мешают развиваться головному мозгу, патологически воздействуют на плод во время беременности или на мозг новорожденного ребёнка в первые недели жизни.
Моторные нарушения при церебральных параличах часто сопровождаются:
Единой причины формирования ДЦП не существует. Как правило, это комплекс факторов, которые повлияли на развитие и созревание головного мозга плода и ребёнка. Условно все факторы можно разделить на три основные группы:
Резус-конфликт также может стать причиной ДЦП, но только если помимо него были другие причины развития патологии.
Чем больше неблагоприятных факторов воздействовало на плод во время беременности и на ребёнка после рождения, тем выше риск формирования ДЦП. Например, гипоксия мозга плода на протяжении всей беременности может привести к недостаточному развитию головного мозга как структурно, так и функционально. К моменту рождения в головном мозге могут сформироваться кисты, которые в последующем будут играть роль очага, провоцирующего эпилепсию. Недоразвитость двигательных путей (нервов, которые отвечают за совершение движений) приводит к патологии двигательной функции.
В процесс могут быть вовлечены зоны мозга, которые отвечают за речь. Формируется системное недоразвитие речи в виде моторной или сенсомоторной дисфазии — нарушения речи с поражением корковых центров. Если повреждены моторные зоны, ребёнок понимает обращённую речь, но не может говорить (дизартрия). Если повреждены сенсорные зоны, ребёнок не понимает обращённую речь, проговаривает случайные слова. При смешанных формах может отсутствовать как способность воспринимать речь, так и разговаривать.
Симптомы детского церебрального паралича
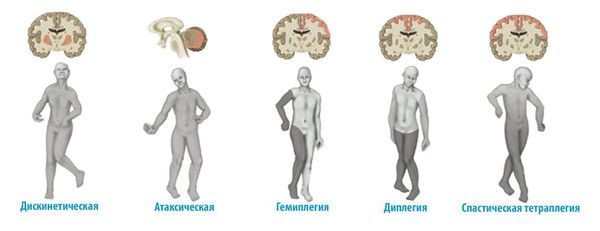
Клиническое проявление ДЦП у детей зависит от формы заболевания и может характеризоваться самыми разными патологическим изменением мышечного тонуса:
Ранние признаки формирования ДЦП можно наблюдать с рождения. По мере созревания и роста ребёнка они могут модифицироваться и проявляться по разному. К ранним признакам относятся:
Если доношенный ребенок к 3 месяцам не удерживает голову, к 6 месяцам не переворачивается, к 10 месяцам не ползает и не сидит, то обязательно нужно обратить на это внимание, не ждать пока он наверстает упущенное, а сразу обращаться к детскому неврологу.
Основные клинические симптомы уже сформированного церебрального паралича [1] :
Патогенез детского церебрального паралича
Патогенез формирования ДЦП — это сложный процесс внутриутробного и родового поражения мозга, который влечет за собой и многообразие клинических проявлений. Патоморфологические изменения в нервной системе многообразны. У 30–40 % детей имеются аномалии развития мозга:
Дистрофические изменения мозговой ткани являются следствием глубоких циркуляторных расстройств — недостаточно питания в тканях мозга из-за недостаточного кровотока мозга. Они проявляются диффузным или очаговым глиозом (смертью мозговых нейронов и замена их на неспецифическую рубцовую ткань), кистозной дегенерацией, атрофией коры больших полушарий, порэнцефалией (кистозными полостями в тканях мозга), отложениеми солей.
Наряду с описанными изменениями могут обнаруживаться недостаточно сформированная оболочка нервных проводников, нарушение разделения нервных клеток и их аксонов, патология межнейрональных связей и сосудистой системы мозга и другие изменения.
Классификация и стадии развития детского церебрального паралича
Выделяют три стадии заболевания: ранняя, начальная остаточная (резидуальная) и остаточная.
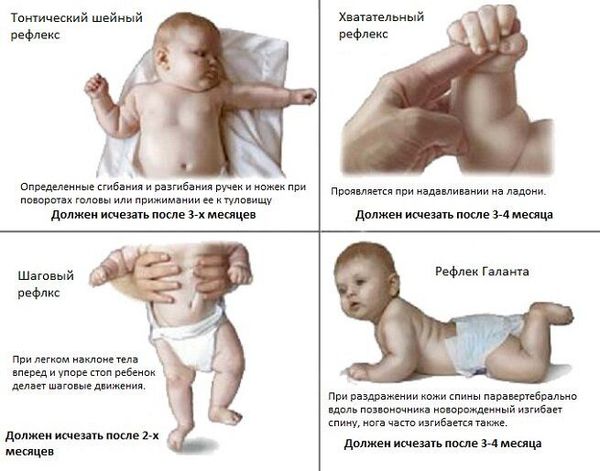
• В ранней стадии патология, возникшая у плода при внутриутробном поражении мозга или поражении в процессе родов, могут вызывать ощутимые нарушения регуляции тонуса мышц и подавлять врожденные двигательные рефлексы. Выявляется отчётливый гипертензионный синдром (повышение внутричерепного давления, которое характеризуется головной болью и раздражительностью) и судороги. Со стороны двигательной системы отмечается угнетение всех или части врожденных рефлексов: защитного — нет поворота головы в сторону, рефлекса опоры — нет выпрямления ног, хватательного рефлекса, ползания и других. Судорожный синдром может наблюдаться с первых дней жизни. Очень рано, иногда к концу второго года жизни, формируется функциональный кифоз или кифосколиоз в поясничном и грудном отделах позвоночника. Одним из наиболее тяжелых симптомов в отношении прогноза являются торсионные спазмы (медленное сокращение мышц, вытягивающее ноги, руки и туловище), которые приводят к вынужденному положению (чаще скручиванию туловища или переразгибанию туловища).
• Вторую стадию заболевания, в зависимости от причин ДЦП, рассматривают как начальную резидуальную или начальную резидуально-хроническую. Она начинается сразу после того, как проходят острые проявления. Эта стадия характеризуется тем, что установочные рефлексы не формируются или формируются недостаточно. У детей с ДЦП появление рефлексов задерживается до 2-5 лет и более, либо они не формируются совсем, в то время как тонические рефлексы продолжают нарастать. Показателен отрицательный симптом Ландау: здоровый ребенок, поддерживаемый на весу в горизонтальном положении, примерно с полугода начинает поднимать голову, разгибать туловище и выносить руки вперед; ребенок с ДЦП не может этого сделать и повисает на руках врача. Нарастают патологические содружественные движения. Проявляются контрактуры — ограничения в подвижности суставов.
Осложнения детского церебрального паралича
У детей, которые не могут самостоятельно передвигаться и часто находятся в лежачем состоянии, сохраняется высокий риск развития пневмонии, инфекций мочевыделительной системы, нейрогенных запоров, аспирации верхних дыхательных путей слюной и пищей. Эти особенности развиваются из-за низкой подвижности. Дыхание ослаблено, грудная клетка не работает так, как у здоровых детей, которые постоянно активны.
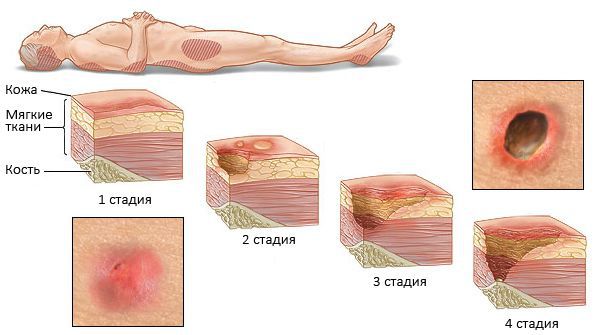
При недостаточном уходе и подвижности ребенка от сильной мышечной спастичности могут возникать пролежни — повреждение целостности кожи. Когда ребенок долго лежит в одном положении, кости под действием силы тяжести давят на мягкие ткани (мышцы, жир, кожа). Их питание (кровообращение) нарушается, и они отмирают. Профилактикой пролежней является частая смена положения, использование различных валиков и подушек, которые подкладывают под опасные места — крестец, пятки и коленные суставы.
Диагностика детского церебрального паралича
Дети первого года жизни, особенно рожденные раньше срока, требуют особого внимания со стороны врача невролога. Если ребёнок родился раньше срока, то при оценке нервно-психического развития необходимо учитывать степень недоношенности, коррегировать возраст (из фактического возраста вычитать то количество недель, которое он «не досидел» в утробе), но при этом не надеятся, что при наличии отклонений ребёнок сам компенсирует разницу. Родители объективно не могут оценить все факторы, влияющие на развитие ребёнка, и определить риск формирования ДЦП. На динамическом осмотре малышей невролог уже в первый месяц жизни может выставить риски формирования заболевания.
Головной мозг нужно обязательно обследовать с помощью нейросонографии (УЗИ головного мозга, НСГ). Она проводится у детей в период, пока остаётся незакрытым родничок (до 1,5 лет жизни), и показывает структурные изменения головного мозга.
При необходимости проводят МРТ головного мозга. Магниторезонансная томография — исследование, которое позволяет получить информацию о функции и строении мозга, выявить патологию и посмотреть, как болезнь протекает в динамике. По сравнению с НСГ, на МРТ лучше визуализируется структура мозга, что позволяет найти очень мелкие патологические образования.
ЭНМГ (электронейромиография) позволит провести дифференциальную диагностику поражения центральной нервной системы от периферической и других нейромышечных заболеваний (спинальная мышечная атрофия, миопатиия, миастения и другие).
Часто требуется консультация генетика, особенно при нормальном акушерско-гинекологическом анамнезе и родах, чтобы правильно поставить диагноз и прогноз заболевания.
Для контроля развития тазобедренных суставов необходимо проводить рентгенографию тазобедренных суставов в прямой проекции с расчетом индекса Реймерса. Это индекс миграции головки бедренной кости из вертлужной впадины, который показывает наличие подвывиха и определяет тактику ведения пациентов ортопедом (врач решает, оперировать или не оперировать в случае отклонений).
Лечение детского церебрального паралича
Можно выделить неско лько основных подходов к лечению ДЦП:
Лечебные подходы применяют в зависимости от степени тяжести ДЦП и возраста ребёнка. Функциональная терапия, консервативное ортопедическое лечение и постуральный менеджмент могут быть использованы с самого раннего возраста. Ботулинотерапия обычно применяется с 2-х летнего возраста. Применение этих подходов в сочетании с непрерывным длительным лечением и коррекцией всех коморбидных (сопутствующих) нарушений обеспечивает высокую эффективность комплексного лечения. Оральные антиспастические препараты при ДЦП часто применяют ограничено из-за развития системных побочных эффектов.
Неотъемлемой частью реабилитационного процесса детей с ДЦП является психолого-логопедическая помощь и социальная адаптация. Она заключается в о бучении детей навыкам речи, общения с другими детьми, окружающими, развитии мелкой моторики, обучении навыкам самообслуживания.
Ортопедическое лечение помогает устраненить контрактуры и деформации, а также создать рациональное положение ребенка. Лечение включает специальные лечебные укладки в часы отдыха и сна, этапную коррекцию контрактур с помощью гипсовых шин и циркулярных повязок. Большое значение имеет профилактика вторичных деформаций и контрактур у детей в период бурного роста в 5-7 лет и затем с 12-15 лет, когда отмечается тенденция к образованию и рецидиву контрактур.
При стойких контрактурах проводят оперативное лечение, но не ранее чем в 3-летнем возрасте, так как до этого происходит активный костный рост и при раннем оперативном лечении могут возникать рецидивы из-за роста ребенка. В современной нейроортопедии стараются как можно дольше отсрочить оперативное лечение, чтобы не вызвать откатов в дальнейшем.
Прогноз. Профилактика
Прогноз при ДЦП определяется формой паралича. Для оценки перспектив реабилитационного лечения и социальной адаптации решающую роль играет состояние интеллекта и речевых функций пациента, а также наличие сопутствующих синдромов.
Профилактика ДЦП возможна с момента рождения ребенка и заключается в ранней реабилитации. В зависимости от тяжести можно как предотвратить формирование ДЦП, так и улучшить исход, если невозможно полностью нивелировать заболевание.
Дисплазия соединительной ткани: основные клинические синдромы, формулировка диагноза, лечение
Дисплазия соединительной ткани (ДСТ) (dis — нарушения, рlasia — развитие, образование) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах, генетически детерминированное состояние, характеризующееся дефектами волокнистых стр
Дисплазия соединительной ткани (ДСТ) (dis — нарушения, рlasia — развитие, образование) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах, генетически детерминированное состояние, характеризующееся дефектами волокнистых структур и основного вещества соединительной ткани, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений висцеральных и локомоторных органов с прогредиентным течением, определяющее особенности ассоциированной патологии, а также фармакокинетики и фармакодинамики лекарств [15, 24].
Данные о распространенности собственно ДСТ разноречивы [5, 14, 17], что обусловлено различными классификационными и диагностическими подходами. Распространенность отдельных признаков ДСТ имеет половозрастные различия [3]. По самым скромным данным показатели распространенности ДСТ, по меньшей мере, соотносятся с распространенностью основных социально значимых неинфекционных заболеваний.
ДСТ морфологически характеризуется изменениями коллагеновых, эластических фибрилл, гликопротеидов, протеогликанов и фибробластов, в основе которых лежат наследуемые мутации генов, кодирующих синтез и пространственную организацию коллагена, структурных белков и белково-углеводных комплексов, а также мутации генов ферментов и кофакторов к ним [1, 12, 23]. Некоторые исследователи, основываясь на выявляемом в 46,6–72,0% наблюдений при ДСТ дефиците магния в различных субстратах (волосы, эритроциты, ротовая жидкость), допускают патогенетическое значение гипомагниемии.
Одна из основополагающих характеристик дисплазии соединительной ткани как дисморфогенетического феномена — фенотипические признаки ДСТ могут отсутствовать при рождении или иметь очень незначительную выраженность (даже в случаях дифференцированных форм ДСТ) и, подобно изображению на фотобумаге, проявляться в течение жизни. С годами количество признаков ДСТ и их выраженность нарастает прогредиентно.
Классификация ДСТ — один из самых дискутабельных научных вопросов. Отсутствие единой, общепринятой классификации ДСТ отражает разногласие мнений исследователей по данной проблеме в целом. ДСТ может классифицироваться с учетом генетического дефекта в периоде синтеза, созревания или распада коллагена [1, 12]. Это перспективный классификационный подход, который дает возможность обосновать генетически дифференцированную диагностику ДСТ [23], однако на сегодняшний день данный подход ограничен наследственными синдромами ДСТ.
Т. И.Кадурина (2000 г.) выделяет MASS-фенотип, марфаноидный и элерсоподобный фенотипы, отмечая, что именно эти три фенотипа являются наиболее частыми формами несиндромной ДСТ. Это предложение является очень заманчивым, благодаря своей простоте и исходной идее, что несиндромные формы ДСТ являются «фенотипическими» копиями известных синдромов. Так, «марфаноидный фенотип» характеризуется сочетанием «признаков генерализованной дисплазии соединительной ткани с астеническим телосложением, долихостеномелией, арахнодактилией, поражением клапанного аппарата сердца (а порой и аорты), нарушением зрения». При «элерсоподобном фенотипе» отмечается «сочетание признаков генерализованной дисплазии соединительной ткани с тенденцией к гиперрастяжимости кожи и разной степенью выраженности гипермобильности суставов». «MASS-подобному фенотипу» присущи «признаки генерализованной дисплазии соединительной ткани, ряд нарушений со стороны сердца, скелетные аномалии, а также кожные изменения в виде истончения или наличия участков субатрофии». На основе этой классификации предлагается формулировать диагноз ДСТ [12].
Учитывая, что классификация любой патологии несет важный «прикладной» смысл — используется как основа для формулировки диагноза, решение классификационных вопросов являются очень важным с точки зрения клинической практики.
Универсальных патологических повреждений соединительной ткани, которые бы формировали конкретный фенотип, не существует. Каждый дефект у каждого больного в своем роде уникален. При этом всеобъемлющее распространение в организме соединительной ткани определяет полиорганность поражений при ДСТ. В связи с этим предлагается классификационный подход с обособлением синдромов, связанных с диспластикозависимыми изменениями и патологическими состояниями [15, 24].
Синдром неврологических нарушений: синдром вегетативной дисфункции (вегетососудистая дистония, панические атаки и др.), гемикрания.
Синдром вегетативной дисфункции формируется у значительного числа пациентов с ДСТ одним из самых первых — уже в раннем детском возрасте и рассматривается как обязательный компонент диспластического фенотипа [11, 12, 14, 15, 17]. У большинства пациентов выявляется симпатикотония, реже встречается смешанная форма, в малом проценте случаев — ваготония [9, 23]. Выраженность клинических проявлений синдрома нарастает параллельно тяжести ДСТ [11, 23]. Вегетативная дисфункция отмечается в 97% случаев наследственных синдромов, при недифференцированной форме ДСТ — у 78% пациентов. В формировании вегетативных нарушений у пациентов с ДСТ, несомненно, имеют значение генетические факторы, лежащие в основе нарушения биохимизма обменных процессов в соединительной ткани и формировании морфологических субстратов, приводящих к изменению функции гипоталамуса, гипофиза, половых желез, симпатико-адреналовой системы.
Астенический синдром: снижение работоспособности, ухудшение переносимости физических и психоэмоциональных нагрузок, повышенная утомляемость.
Астенический синдром выявляется в дошкольном и особенно ярко — в школьном, подростковом и молодом возрасте, сопровождая пациентов с ДСТ на протяжении всей жизни. Отмечается зависимость выраженности клинических проявлений астении от возраста больных: чем старше пациенты, тем больше субъективных жалоб.
Клапанный синдром: изолированные и комбинированные пролапсы клапанов сердца, миксоматозная дегенерация клапанов.
Чаще он представлен пролапсом митрального клапана (ПМК) (до 70%), реже — пролапсами трикуспидального или аортального клапанов, расширением корня аорты и легочного ствола; аневризмами синусов Вальсальвы. В части случаев выявленные изменения сопровождаются явлениями регургитации, что отражается на показателях контрактильности миокарда и объемных параметрах сердца. Durlach J. (1994) предположил, что причиной ПМК при ДСТ может быть дефицит магния.
Клапанный синдром начинает формироваться также в детском возрасте (4–5 лет). Аускультативные признаки ПМК выявляются в различном возрасте: от 4 до 34 лет, однако наиболее часто — в возрасте 12–14 лет. Следует отметить, что эхокардиографические данные находятся в динамическом состоянии: более выраженные изменения отмечаются при последующих осмотрах, что отражает влияние возраста на состояние клапанного аппарата. Кроме того, на выраженность клапанных изменений влияет степень тяжести ДСТ и объем желудочков.
Торакодиафрагмальный синдром: астеническая форма грудной клетки, деформации грудной клетки (воронкообразная, килевидная), деформации позвоночника (сколиозы, кифосколиозы, гиперкифозы, гиперлордозы и др.), изменения стояния и экскурсии диафрагмы.
Среди пациентов с ДСТ наиболее часто встречается воронкообразная деформация грудной клетки, на втором месте по частоте — килевидная деформация и наиболее редко выявляется астеническая форма грудной клетки.
Начало формирование торакодиафрагмального синдрома приходится на ранний школьный возраст, отчетливость проявлений — на возраст 10–12 лет, максимальная выраженность — на период 14–15 лет. Во всех случаях воронкообразная деформация отмечается врачами и родителями на 2–3 года раньше, чем килевидная.
Наличие торакодиафрагмального синдрома определяет уменьшение дыхательной поверхности легких, деформацию просвета трахеи и бронхов; смещение и ротацию сердца, «перекрут» основных сосудистых стволов. Качественные (вариант деформации) и количественные (степень деформации) характеристики торакодиафрагмального синдрома определяют характер и выраженность изменений морфофункциональных параметров сердца и легких. Деформации грудины, ребер, позвоночника и связанное с ними высокое стояние диафрагмы приводят к уменьшению грудной полости, повышению внутригрудного давления, нарушают приток и отток крови, способствуют возникновению аритмий сердца [13, 15]. Наличие торакодиафрагмального синдрома может повлечь за собой повышение давления в системе малого круга кровообращения [23, 27].
Сосудистый синдром: поражение артерий эластического типа: идиопатическое расширение стенки с формированием мешотчатой аневризмы; поражение артерий мышечного и смешанного типов: бифуркационно-гемодинамические аневризмы, долихоэктазии удлиненных и локальных расширений артерий, патологическая извитость вплоть до петлеобразования; поражение вен (патологическая извитость, варикозное расширение вен верхних и нижних конечностей, геморроидальных и др. вен); телеангиоэктазии; эндотелиальная дисфункция.
Изменения сосудов сопровождаются повышением тонуса в системе крупных, мелких артерий и артериол, уменьшением объема и скорости наполнения артериального русла, снижением венозного тонуса и избыточным депонированием крови в периферических венах.
Сосудистый синдром, как правило, манифестирует в подростковом и молодом возрасте, прогрессируя с увеличением возраста пациентов.
Изменения артериального давления: идиопатическая артериальная гипотензия.
Торакодиафрагмальное сердце: астенический, констриктивный, ложностенотический, псевдодилатационный варианты, торакодиафрагмальное легочное сердце.
Формирование торакодиафрагмального сердца происходит параллельно манифестации и прогрессированию деформации грудной клетки и позвоночника, на фоне клапанного и сосудистого синдромов. Варианты торакодиафрагмального сердца служат отражением нарушения гармоничности взаимоотношений веса и объема сердца, веса и объема всего тела, объема сердца и объема больших артериальных стволов на фоне диспластикозависимой дезорганизации роста тканевых структур самого миокарда, в частности, его мышечных и нервных элементов.
У пациентов с типичной астенической конституцией формируется астенический вариант торакодиафрагмального сердца, характеризующийся уменьшением размеров камер сердца при «нормальной» систолической и диастолической толщине стенок и межжелудочковой перегородки, «нормальных» показателях миокардиальной массы, — формирование истинного малого сердца. Сократительный процесс в данной ситуации сопровождается увеличением циркулярного стресса и внутримиокардиального напряжения в циркулярном направлении в систолу, что свидетельствовало о гиперреактивности компенсаторных механизмов на фоне преобладавших симпатических влияний. Установлено, что определяющими факторами в изменении морфометрических, объемных, контрактильных и фазовых параметров сердца являются форма грудной клетки и уровень физического развития костно-мышечного аппарата [15].
У части больных с выраженной формой ДСТ и различными вариантами деформации грудной клетки (воронкообразная деформация I, II степени) в условиях уменьшения объема грудной полости наблюдается «перикардитоподобная» ситуация с развитием диспластикозависимого констриктивного сердца. Уменьшение максимальных размеров сердца с изменением геометрии полостей при этом носит гемодинамически неблагоприятный характер, сопровождаясь уменьшением толщины стенок миокарда в систолу. При уменьшении ударного объема сердца происходит компенсаторное повышение общего периферического сопротивления.
У ряда пациентов с деформацией грудной клетки (воронкообразная деформация III степени, килевидная деформация) при смещении сердца, когда оно «уходит» от механических воздействий костяка грудной клетки, ротируя и сопровождаясь «перекрутом» основных сосудистых стволов, формируется ложностенотический вариант торакодиафрагмального сердца. «Синдром стеноза» выхода из желудочков сопровождается увеличением напряжения миокардиальных структур в меридиональном и циркулярном направлениях, ростом систолического напряжения миокардиальной стенки с увеличением длительности подготовительного периода к изгнанию, увеличением давления в легочной артерии.
У пациентов с килевидной деформацией грудной клетки II и III степени выявляется увеличение устьев аорты и легочной артерии, связанное со снижением упругости сосудов и зависящее от степени тяжести деформации. Изменения геометрии сердца характеризуются компенсаторным увеличением размеров левого желудочка в диастолу либо в систолу, в результате чего полость приобретает шаровидную форму. Сходные процессы наблюдаются со стороны правых отделов сердца и устья легочной артерии. Формируется псевдодилятационный вариант торакодиафрагмального сердца.
В группе пациентов с дифференцированной ДСТ (синдромами Марфана, Элерса–Данлоса, Стиклера, несовершенного остеогенеза), а также у пациентов с недифференцированной ДСТ, имеющих сочетание выраженных деформаций грудной клетки и позвоночника, морфометрические изменения правого и левого желудочков сердца совпадают: уменьшается длинная ось и площади полостей желудочков, особенно в конце диастолы, отражая снижение сократительной способности миокарда; снижаются конечно- и среднедиастолические объемы. Наблюдается компенсаторное снижение общего периферического сосудистого сопротивления, зависящее от степени снижения сократимости миокарда, выраженности деформаций грудной клетки и позвоночника. Неуклонный рост легочного сосудистого сопротивления приводит в данном случае к формированию торакодиафрагмального легочного сердца.
Метаболическая кардиомиопатия: кардиалгии, аритмии сердца, нарушения процессов реполяризации (I степень: увеличение амплитуды Т V2-V3, синдром Т V2 > Т V3; II степень: инверсия Т, смещение ST V2-V3 вниз на 0,5–1,0 мм; III степень: инверсия Т, косовосходящее смещение ST до 2,0 мм).
Развитие метаболической кардиомиопатии определяется влиянием кардиальных факторов (клапанный синдром, варианты торакодиафрагмального сердца) и экстракардиальных условий (торакодиафрагмальный синдром, синдром вегетативной дисфункции, сосудистый синдром, дефицит микро- и макроэлементов). Кардиомиопатия при ДСТ не имеет специфических субъективных симптомов и клинических проявлений, вместе с тем потенциально определяет повышенный риск внезапной смерти в молодом возрасте с преобладающей ролью в танатогенезе аритмического синдрома.
Аритмический синдром: желудочковая экстрасистолия различных градаций; многофокусная, мономорфная, реже полиморфная, монофокусная предсердная экстрасистолия; пароксизмальные тахиаритмии; миграция водителя ритма; атриовентрикулярные и внутрижелудочковые блокады; аномалии проведения импульса по дополнительным путям; синдром предвозбуждения желудочков; синдром удлинения интервала Q-T.
Частота выявления аритмического синдрома — около 64%. Источником нарушения ритма сердца может быть очаг нарушенного метаболизма в миокарде. При нарушении структуры и функции соединительной ткани всегда присутствует подобный субстрат биохимического генеза. Причиной нарушений сердечного ритма при ДСТ может служить клапанный синдром. Возникновение аритмий при этом может быть обусловлено сильным натяжением митральных створок, содержащих мышечные волокна, способные к диастолической деполяризации с формированием биоэлектрической нестабильности миокарда [29]. Кроме того, появлению аритмий может способствовать резкий сброс крови в левый желудочек с пролонгированной диастолической деполяризацией. Изменения геометрии камер сердца также могут иметь значение в возникновении аритмий при формировании диспластического сердца, особенно торакодиафрагмального варианта легочного сердца. Кроме кардиальных причин происхождения аритмий при ДСТ существуют и экстракардиальные, обусловленные нарушением функционального состояния симпатического и блуждающего нервов, механического раздражения сердечной сорочки деформированным костяком грудной клетки. Одним из аритмогенных факторов может быть дефицит магния, выявляемый у пациентов с ДСТ. В предшествующих исследованиях российских и зарубежных авторов получены убедительные данные о причинной взаимосвязи между желудочковыми и предсердными аритмиями и внутриклеточным содержанием магния [19, 22, 25, 26]. Предполагают, что гипомагниемия может способствовать развитию гипокалиемии. При этом увеличивается мембранный потенциал покоя, нарушаются процессы деполяризации и реполяризации, снижается возбудимость клетки. Замедляется проводимость электрического импульса, что способствует развитию аритмий. С другой стороны, внутриклеточный дефицит магния повышает активность синусового узла, снижает абсолютную и удлиняет относительную рефрактерность [19, 22, 26].
Бронхолегочный синдром: трахеобронхиальная дискинезия, трахеобронхомаляция, трахеобронхомегалия, вентиляционные нарушения (обструктивные, рестриктивные, смешанные нарушения), спонтанный пневмоторакс.
Бронхолегочные нарушения при ДСТ современные авторы описывают как генетически обусловленные нарушения архитектоники легочной ткани в виде деструкции межальвеолярных перегородок и недоразвития эластических и мышечных волокон в мелких бронхах и бронхиолах, ведущие к повышенной растяжимости и сниженной эластичности легочной ткани [12, 15, 23]. Следует отметить, что согласно классификации болезней органов дыхания у детей, принятой на Совещании педиатров-пульмонологов РФ (Москва, 1995), такие «частные» случаи ДСТ органов дыхания, как трахеобронхомегалия, трахеобронхомаляция, бронхоэктатическая эмфизема, а также синдром Вильямса–Кемпбелла, на сегодняшний день трактуются как пороки развития трахеи, бронхов, легких [18].
Изменение функциональных параметров дыхательной системы при ДСТ зависит от наличия и степени деформации грудной клетки, позвоночника и чаще характеризуется рестриктивным типом вентиляционных нарушений со снижением общей емкости легких (ОЕЛ) [18, 23]. Остаточный объем легких (ООЛ) у многих пациентов с ДСТ не меняется или слегка повышается без изменения соотношения объема форсированного выдоха в первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ) [23]. У некоторых пациентов выявляются обструктивные нарушения, феномен гиперреактивности бронхов, что пока не нашло однозначного объяснения [2, 10, 23]. Пациенты с ДСТ представляют собой группу с высоким риском возникновения ассоциированной патологии, в частности, туберкулеза легких [32].
Синдром иммунологических нарушений: синдром иммунодефицита, аутоиммунный синдром, аллергический синдром.
Функциональное состояние иммунной системы при ДСТ характеризуется как активацией иммунных механизмов, обеспечивающих поддержание гомеостаза, так и их недостаточностью, ведущей к нарушению способности адекватно освобождать организм от чужеродных частиц и, следовательно, к развитию рецидивирующих инфекционно-воспалительных заболеваний бронхолегочной системы. Иммунологические нарушения у части пациентов с ДСТ включают повышение в крови уровня иммуноглобулина Е [4]. В целом, литературные данные о нарушениях в иммунной системе при различных клинических вариантах ДСТ носят неоднозначный, нередко противоречивый характер, что требует дальнейшего их изучения. До сих пор остаются практически неизученными механизмы формирования иммунных нарушений при ДСТ. Наличие иммунных нарушений, сопутствующее бронхолегочному и висцеральному синдромам ДСТ, повышает риск возникновения ассоциированной патологии соответствующих органов и систем.
Висцеральный синдром: нефроптоз и дистопии почек, птозы органов желудочно-кишечного тракта, органов малого таза, дискинезии органов желудочно-кишечного тракта, дуоденогастральные и гастроэзофагеальные рефлюксы, несостоятельность сфинктеров, дивертикулы пищевода, грыжи пищеводного отверстия диафрагмы; птозы половых органов у женщин.
Синдром патологии органа зрения: миопия, астигматизм, гиперметропия, косоглазие, нистагм, отслойка сетчатки, вывих и подвывих хрусталика.
Нарушения аккомодации проявляется в различные периоды жизни, у большинства обследованных — в школьные годы (8–15 лет) и прогрессирует до 20–25 лет.
Геморрагические гематомезенхимальные дисплазии: гемоглобинопатии, синдром Рандю–Ослера–Вебера, рецидивирующие геморрагические (наследственная дисфункция тромбоцитов, синдром Виллебранда, комбинированные варианты) и тромботические (гиперагрегация тромбоцитов, первичный антифосфолипидный синдром, гипергомоцистеинемия, резистентность фактора Vа к активированному протеину С) синдромы [20].
Синдром патологии стопы: косолапость, плоскостопие (продольное, поперечное), полая стопа.
Синдром патологии стопы является одним из самым ранних проявлений несостоятельности соединительнотканных структур. Наиболее часто встречается поперечно-распластанная стопа (поперечное плоскостопие), в части случаев сочетающаяся с отклонением 1 пальца наружу (hallus valgus) и продольное плоскостопие с пронацией стопы (плосковальгусная стопа). Наличие синдрома патологии стопы еще больше уменьшает возможность физического развития пациентов с ДСТ, формирует определенный стереотип жизни, усугубляет психосоциальные проблемы.
Синдром гипермобильности суставов: нестабильность суставов, вывихи и подвывихи суставов.
Синдром гипермобильности суставов в большинстве случаев определяется уже в раннем детском возрасте. Максимальная гипермобильность суставов наблюдается в возрасте 13–14 лет, к 25–30 годам распространенность снижается в 3–5 раз. Частота встречаемости гипермобильности суставов достоверно выше среди пациентов с выраженной ДСТ.
Вертеброгенный синдром: ювенильный остеохондроз позвоночника, нестабильность, межпозвонковые грыжи, вертебробазиллярная недостаточность; спондилолистез.
Развиваясь параллельно развитию торакодиафрагмального синдрома и синдрома гипермобильности, вертеброгенный синдром существенно усугубляет их последствия.
Косметический синдром: диспластикозависимые дисморфии челюстно-лицевой области (аномалии прикуса, готическое небо, выраженные асимметрии лица); О- и Х-образные деформации конечностей; изменения кожных покровов (тонкая просвечивающаяся и легко ранимая кожа, повышенная растяжимость кожи, шов в виде «папиросной бумаги»).
Косметический синдром ДСТ значительно усугубляется наличием малых аномалий развития, выявляемых у абсолютного большинства пациентов с ДСТ. При этом подавляющее большинство пациентов имеет 1–5 микроаномалий (гипертелоризм, гипотелоризм, «мятые» ушные раковины, большие торчащие уши, низкий рост волос на лбу и шее, кривошея, диастема, неправильный рост зубов и др.).
Нарушения психической сферы: невротические расстройства, депрессии, тревожность, ипохондрия, обсессивно-фобические расстройства, нервная анорексия.
Известно, что пациенты с ДСТ формируют группу повышенного психологического риска, характеризующуюся сниженной субъективной оценкой собственных возможностей, уровнем претензий, эмоциональной устойчивости и работоспособности, повышенным уровнем тревожности, ранимостью, депрессивностью, конформизмом [3, 9]. Наличие диспластикозависимых косметических изменений в сочетании с астенией формируют психологические особенности этих больных: сниженное настроение, потеря ощущения удовольствия и интереса к деятельности, эмоциональная лабильность, пессимистическая оценка будущего, нередко с идеями самобичевания и суицидальными мыслями [23]. Закономерным следствием психологического дистресса является ограничение социальной активности, ухудшение качества жизни и значительное снижение социальной адаптации [12, 3, 23], наиболее актуальные в подростковом и молодом возрасте.
Поскольку фенотипические проявления ДСТ чрезвычайно многообразны и практически не поддаются какой-либо унификации, а их клиническое и прогностическое значение определяется не только степенью выраженности того или иного клинического признака, но и характером «комбинаций» диспластикозависимых изменений, с нашей точки зрения, наиболее оптимально использовать термины «недифференцированная дисплазия соединительной ткани», определяющий вариант ДСТ с клиническими проявлениями, не укладывающимися в структуру наследственных синдромов, и «дифференцированная дисплазия соединительной ткани, или синдромная форма ДСТ». Практически все клинические проявления ДСТ имеют свое место в Международном классификаторе болезней (МКБ 10). Таким образом, у практического врача есть возможность определить шифр ведущего на момент обращения проявления (синдрома) ДСТ.При этом в случае недифференцированной формы ДСТ при формулировке диагноза следует указывать все имеющиеся у пациента синдромы ДСТ, формируя таким образом «портрет» пациента, понятный любому врачу последующего контакта.
Варианты формулировки диагноза.
1. Основное заболевание. Синдром Вольфа–Паркинсона–Вайта (синдром WPW) (I 45.6), ассоциированный с ДСТ. Пароксизмальная мерцательная аритмия.
Фоновое заболевание. ДСТ:
Осложнения: хроническая сердечная недостаточность (ХСН) IIА, ФК II.
2. Основное заболевание. Пролапс митрального клапана II степени с регургитацией (I 34.1), ассоциированный с малой аномалией развития сердца — аномально расположенной хордой левого желудочка.
Фоновое заболевание. ДСТ:
Осложнения основного: ХСН, ФК II, дыхательная недостаточность (ДН 0).
3. Основное заболевание. Хронический гнойно-обструктивный бронхит (J 44.0), ассоциированный с диспластикозависимой трахеобронхомаляцией, обострение.
Фоновое заболевание. ДСТ:
Осложнения: эмфизема легких, пневмосклероз, адгезивный двухсторонний плеврит, ДН II ст., ХСН IIА, ФК IV.
Вопросы тактики ведения пациентов с ДСТ также являются открытыми. Единых общепризнанных подходов к лечению пациентов с ДСТ на сегодняшний день не существует. Учитывая, что в настоящее время медицине недоступна генная терапия, врачу необходимо использовать любые способы, которые помогут остановить прогредиентность течения заболевания. Наиболее приемлем синдромальный подход к выбору терапевтических вмешательств: коррекция синдрома вегетативных нарушений, аритмического, сосудистого, астенического и др. синдромов.
Ведущим компонентом терапии должны быть немедикаментозные воздействия, направленные на улучшения гемодинамики (лечебная физкультура, дозированные нагрузки, аэробный режим). Однако нередко существенным фактором, ограничивающим достижения целевого уровня физических нагрузок у пациентов с ДСТ, оказывается плохая субъективная переносимость тренировок (обилие астенических, вегетативных жалоб, эпизоды гипотонии), что снижает приверженность пациентов к этому виду реабилитационных мероприятий. Так, по нашим наблюдениям до 63% пациентов имеют низкую толерантность к физической нагрузке по данным велоэргометрии, большинство из этих пациентов отказываются от продолжения курса лечебной физкультуры (ЛФК). В связи с этим представляется перспективным применение в комплексе с ЛФК вегетотропных средств, препаратов метаболического действия. Целесообразным является назначение препаратов магния. Многогранность метаболических эффектов магния, его способность повышать энергетический потенциал миокардиоцитов, участие магния в регуляции гликолиза, синтезе белков, жирных кислот и липидов, вазодилятационные свойства магния широко отражены в многочисленных экспериментальных и клинических исследованиях [6, 7, 22, 26, 30, 31]. В ряде работ, проведенных к настоящему времени, показана принципиальная возможность устранения характерной кардиальной симптоматики и ультразвуковых изменений у больных с ДСТ в результате лечения препаратами магния [7, 22, 25, 26].
Нами проводилось изучение эффективности поэтапного лечения пациентов, имеющих признаки ДСТ: на первом этапе больным проводилась терапия препаратом «Магнерот», на втором к медикаментозному лечению добавляли комплекс лечебной физкультуры. В исследование были включены 120 пациентов с недифференцированной формой ДСТ, имеющих низкую толерантность к физической нагрузке (по данным велоэргометрии) в возрасте от 18 до 42 лет (средний возраст 30,30 ± 2,12 года), мужчин — 66, женщин — 54. Торакодиафрагмальный синдром проявлялся воронкообразной деформацией грудной клетки различной степени (46 человек), килевидной деформацией грудной клетки (49 пациентов), астенической формой грудной клетки (7 пациентов), комбинированными изменениями позвоночного столба (85,8%). Клапанный синдром был представлен: пролапсом митрального клапана (I степени — 80,0%; II степени — 20,0%) с регургитацией (91,7%) или без таковой. У 8 человек было выявлено расширение корня аорты. В качестве группы контроля были обследованы 30 практически здоровых добровольцев, соответствующих по полу и возрасту.
По данным ЭКГ у всех пациентов с ДСТ выявлялись изменения конечной части желудочкового комплекса: I степень нарушения процессов реполяризации выявлялась у 59 пациентов; II степень — у 48 пациентов, III степень определялась реже — в 10,8 % случаев (13 человек). Анализ вариабельности сердечного ритма пациентов с ДСТ по сравнению с группой контроля продемонстрировал статистически значимо более высокие значения среднесуточных показателей — SDNN, SDNNi, RMSSD. При сопоставлении показателей вариабельности сердечного ритма с тяжестью вегетативной дисфункции у пациентов с ДСТ была выявлена обратная зависимость — чем выраженнее вегетативная дисфункция, тем ниже показатели вариабельности сердечного ритма.
На первом этапе комплексной терапии назначался Магнерот по следующей схеме: 2 таблетки 3 раза в день первые 7 дней, затем по 1 таблетке 3 раза в день в течение 4 недель.
В результате проведенного лечения была отмечена отчетливая положительная динамика частоты кардиальных, астенических и разнообразных вегетативных жалоб, предъявляемых пациентами. Позитивная динамика ЭКГ-изменений проявилась в снижении частоты встречаемости нарушений процессов реполяризации I степени (р
Г. И. Нечаева, доктор медицинских наук, профессор
В. М. Яковлев, доктор медицинских наук, профессор
В. П. Конев, доктор медицинских наук, профессор
И. В. Друк, кандидат медицинских наук
С. Л. Морозов
ОмГМА Росздрава, Омск
СГМА Росздрава, Ставрополь