кар мкг что это
7 причин есть морскую капусту каждый день
Водоросли — настоящий суперфуд, лучший источник йода, который помогает поддерживать здоровье щитовидной железы. Морская капуста помогает бороться с лишним весом, контролировать уровень сахара в крови и положительно сказывается на уровне холестерина.
Ольга Игнатова — эндокринолог GMS CLinic;
Мария Волченкова — нутрициолог компании BestDoctor, клинический психолог, эксперт по работе с ДНК-тестами, член Российского союза нутрициологов, диетологов и специалистов пищевой индустрии
Что это
Морская капуста — это водоросли из рода Ламинария. Их уникальные свойства открыли в Древней Японии. Первые письменные труды о необходимости употреблять в пищу морскую капусту относятся к XII веку, эпохе правления династии Тан.
Целебным свойствам водорослей посвящена глава «Лечение едой» в труде китайского врача Сунь Сымяо «Необходимые рецепты, стоящие тысячу золотых монет». Это одна из древнейших работ по диетологии, которая имела большое значение в становлении учения о медицинской значимости продуктов питания. Кстати, в народе Сунь Сымяо прозвали королем фармацевтики, а со временем его стали считать покровителем всех лекарей [ 1].
В странах Азии за ламинарией закрепилась слава продукта, который помогает избавиться от зоба, лечит дизентерию, справляется с болезнями почек и мочевого пузыря и в целом продлевает жизнь. В России о морской капусте узнали лишь благодаря морским экспедициям Витуса Беринга, однако долгое время ламинария оставалась недооцененной.
Так, в 1960-е годы полки магазинов в СССР наводнили консервы из морской капусты, а в прессе провели соответствующую рекламную компанию. Однако полезные водоросли покупали неохотно. Лишь в последние несколько десятилетий ламинария получила заслуженное признание и в России.
Калорийность и питательная ценность морской капусты на 100 г
Польза
Водоросли считаются хорошим источником пищевых волокон, аминокислот, омега-3 жирных кислот, витаминов АК, Е, А, группы В, а также минералов: фосфора, магния, железа и натрия [ 3], [4], [5], [6]. Но более всего ламинария ценится за высокое содержание йода. Морская капуста укрепляет иммунитет, может предотвратить развитие атеросклероза, анемии и авитаминоза [7], [8].
Поддерживает функцию щитовидки
Ламинария накапливает йод из морской воды и является хорошим диетическим источником этого вещества. Причем количество йода в морской капусте сильно варьируется в зависимости от того, где росло растение, сколько ему лет и не в последнюю очередь — от производителя.
ВОЗ рекомендует потреблять от 120 до 150 мкг йода в сутки. По данным Союза потребителей «Росконтроль», в морской капусте от отечественных производителей может содержаться от 290 до 480 мкг этого вещества [ 9]. То есть получить нужную суточную норму йода можно из 50 г продукта.
Йод признан важным диетическим элементом, который необходим для синтеза гормонов щитовидной железы. Недостаток этого вещества негативно сказывается на состоянии мышц, сердца, печени, почек и развивающегося мозга [ 11], [12]. Если дефицит йода не восполнять, ткани щитовидки начинают разрастаться, что приводит к образованию эндемического зоба [13].
Кроме того, в составе морской капусты присутствует аминокислота тирозин. Она также участвует в выработке гормонов щитовидной железы [ 14].
Помогает контролировать уровень сахара
Ученые выяснили, что морская капуста может снизить риск развития диабета [ 15], [16]. Вещество фукоксантин в составе бурых водорослей помогает контролировать уровень сахара в крови, в том числе у людей с генетической предрасположенностью к инсулинорезистентности, которая обычно сопровождает диабет 2-го типа [17].
Кроме того, в морской капусте содержится альгиновая кислота, которая препятствует скачкам уровня сахара в крови [ 18], [19]. Однако исследования полезных свойств этого вещества пока проводились только на животных.
Способствует здоровью кишечника
Обнаруженные в морских водорослях сульфатированные полисахариды (фукоиданы) увеличивают рост «хороших» кишечных бактерий [ 22]. Эти полисахариды также могут стимулировать выработку короткоцепочечных жирных кислот (КФК). КФК быстро всасываются в кровь и служат основным источником энергии для клеток слизистой толстого кишечника, способствуют их росту и обновлению, поддерживают микробное равновесие.
Помогает контролировать вес
Морская капуста является отличным источником клетчатки (25–75% сухой массы), из которых водорастворимая клетчатка составляет примерно 50–85%. Это больше, чем в большинстве фруктов и овощей [ 20], [21]. Клетчатка помогает отсрочить чувство голода и не переедать.
Некоторые исследования показали, что ламинария также может помочь в нормализации веса и в борьбе с ожирением. Так, альгинаты в составе ламинарии действуют как блокаторы жира, препятствуя его всасыванию в кишечнике [ 22]. А фукоксантин в составе водорослей может помочь уменьшить жировые отложения [23], [24]. Хотя результаты исследований кажутся многообещающими, их пока проводили только на животных.
Может снизить риск сердечно-сосудистых заболеваний
Морская капуста может снизить уровень холестерина в крови [ 25], [26]. У людей с высоким холестерином повышается риск инфаркта, инсульта, ишемической болезни сердца, заболеваний центральных и периферических сосудов и т. д. Как показали исследования, альгиновая кислота в составе морской капусты полезна при атеросклерозе и препятствует росту уровня холестерина в крови [27], [28]
Ученые также обратили внимание на содержащиеся в водорослях пептиды. Исследования на животных показали, что эти вещества могут способствовать нормализации кровяного давления [ 29], [30], [31]. Однако для подтверждения этих многообещающих результатов нужны крупномасштабные исследования на людях.
Замедляет процессы старения
Морская капуста богата антиоксидантами, которые борются с окислительными процессами, помогают клеткам восстанавливаться, замедляют процессы старения, укрепляют иммунную систему и т. д. [32]
Также морские водоросли содержат широкий спектр полезных растительных соединений, включая флавоноиды и каротиноиды (в частности, фукоксантин). Доказано, что они также защищают клетки организма от повреждения свободными радикалами [ 33], [34]. Так, антиоксидантные свойства фукоксантина в 13,5 выше, чем у витамина Е [35].
Помогает бороться с раком
Исследования показали, что ламинария может быть эффективна в профилактике рака, в частности опухолей молочной железы и толстой кишки [ 37], [38], [39]. Ученые протестировали сырые или частично очищенные полисахариды из различных бурых, зеленых и красных водорослей на их противоопухолевую активность.
Оказалось, что морские водоросли представляют собой источник новых биологически активных соединений с потенциалом в качестве терапевтических противораковых агентов. Однако в этой области необходимы дальнейшие исследования.
Морская капуста считается очень здоровой пищей. Однако у нее есть некоторые противопоказания. Так, ламинарию не стоит употреблять при гиперфункции щитовидной железы. Также водоросли имеют свойство накапливать тяжелые металлы, однако их концентрация, как правило, не вызывает опасений [ 40], [41], [42]. На морскую капусту может быть аллергия, поэтому начинать использовать продукт лучше с небольших порций.
Советы эндокринолога
Ольга Игнатова — эндокринолог GMS Clinic
Для здоровой щитовидной железы одномоментно пришедшее в кровоток большое количество йода совершенно безопасно. Она возьмет столько, сколько ей необходимо сегодня для синтеза тиреоидных гормонов, остальное без проблем выведется с мочой.
Например, если вы поели устриц, то получили полумесячную норму йода, помазали горло «Люголем» — месячную, а если вам ввели йодсодержащий контраст во время КТ-исследования, то — годовую. Но за день-два организм все это выведет без последствий. Именно поэтому йод нельзя накопить впрок, а необходимо получать каждый день.
Существуют категории людей, которые могут быть чувствительны к переизбытку йода не в организме, а во внешней среде и еде. Это люди с повышенной функцией щитовидной железы, или тиреотоксикозом. Он бывает аутоиммунного происхождения либо развивается из автономно функционирующих узлов щитовидной железы. У таких людей йод будет ухудшать проявления этого нарушения.
Недостаток йода часто не имеет ярких внешних симптомов. У взрослых дефицит будет выражаться в образовавшихся узлах, которые могут быть обнаружены во время УЗИ. По ощущениям они напоминают ком в горле. Одним из наиболее явных признаков наличия у человека дефицита йода будет увеличение зоба, но это говорит об уже прогрессирующем заболевании. У детей к симптомам можно отнести вялость, слабость, снижение успеваемости в школе, замедление старта речи у малышей, замедление развития.
Наиболее уязвимой категорией при нехватке йода являются беременные женщины и дети. Йододефицит во время беременности особенно опасен, т.к. при этом состоянии страдают щитовидные железы матери и плода. Низкое содержание йода у будущей мамы приводит к его нехватке и у плода. Женщины во время беременности или кормления грудью нуждаются в дополнительном поступлении йода.
У новорожденных детей дефицит йода может вызвать снижение функции щитовидной железы, замедление умственного развития. Формирование нервной системы головного мозга интеллектуальных функций происходит при участии йода. Подросткам (11–17 лет) может его не хватать для синтеза гормонов. В период активного роста организма, увеличения и роста щитовидной железы он им особенно необходим.
Говоря о морской капусте, нельзя быть точно уверенным, какое количество йода содержится в конкретном продукте. Сколько полезного вещества сохранилось и сколько усвоилось, самостоятельно определить невозможно.
Медицина давно нашла простой и эффективный способ профилактики дефицита йода: использование йодированной соли в пищу. Всего 5 г соли (обычно именно это количество человек использует ежедневно при приготовлении продуктов) содержат суточную норму йода для взрослого человека.
Морская капуста в кулинарии
В азиатских странах готовят более трехсот блюд с водорослями. Ламинария хорошо сочетается с рыбой и морепродуктами, мясом, овощами, макаронами, грибами, рисом и т.д.
Попробуйте приготовить дома салат из морской капусты. Для двух порций понадобится 300 г ламинарии, 3–4 редиса, 2 огурца, 2 яблока и свежая зелень. Мелко нарежьте редис и огурец, яблоко можно натереть на крупной терке. Нашинкуйте зелень и смешайте все ингредиенты в салатнице. Заправьте блюдо маслом виноградной косточки (но можно и оливковым). Украсьте салат семенами льна или кунжута.
Как выбрать и хранить морскую капусту
Перед покупкой морской капусты обращайте внимание на срок годности и состав. Лучше выбирать продукт в прозрачной банке. Если рассол мутный или на капусте белый налет, от покупки лучше воздержаться. Консервированную морскую капусту лучше съесть сразу после вскрытия. Сушеную ламинарию можно хранить три года с даты изготовления, в темном и прохладном месте. Если морскую капусту заморозить, можно продлить срок ее хранения до полугода.
Комментарий эксперта
Мария Волченкова — нутрициолог компании BestDoctor, клинический психолог, эксперт по работе с ДНК-тестами, член Российского Союза нутрициологов, диетологов и специалистов пищевой индустрии
Морскую капусту можно отнести к суперфудам. В ней достаточно много защитников наших клеток — антиоксидантов и полисахаридов, которые становятся пищей для полезных бактерий, живущих в кишечнике. Но главное преимущество морской капусты — высокое содержание йода. Правда, количество йода в разных образцах морской капусты различается, так что невозможно точно рассчитать разовую порцию, которая закроет суточную потребность в этом веществе.
Если ваша цель — поддерживать здоровый вес, оптимальный вариант — есть морскую капусту в виде салата. Такое блюдо содержит много клетчатки и воды, то есть обладает низкой калорийностью при большом объеме. Этот продукт можно есть в любое время суток, поскольку он обладает низким гликемическим индексом.
С другой стороны, сушеные листья (например, нори) можно использовать для полезных домашних роллов. Если взять вместо белого риса бурый, добавить авокадо и немного лосося, то получится отличный источник мононенасыщенных жирных кислот, калия и незаменимых жирных кислот омега-3.
Есть такой парадокс морской капусты: с одной стороны, высокое содержание йода делает ее очень полезной для большинства людей. С другой — из-за плохо прогнозируемого содержания йода в отдельно взятом блюде невозможно сказать, сколько же его съесть. Одна и та же порция может содержать как слишком много йода, так и слишком мало. Если речь идет о консервированной морской капусте, то ориентировочно — 50 г за раз.
Людям с тиреотоксикозом стоит быть осторожными с морской капустой и другими пищевыми источниками йода (например, с морепродуктами). В этом случае лучше обсудить допустимые нормы потребления с эндокринологом.
Особое внимание на морскую капусту стоит обратить строгим вегетарианцам и веганам. В продуктах растительного происхождения очень мало йода, поэтому ламинария может стать отличным дополнением к привычному рациону.
Анализ минерального обмена (23 элемента) (плазма) (венозная кровь) в Москве
Анализ позволяет оценить содержание важнейших минеральных веществ в организме и выявить их недостаточное или избыточное поступление с пищей.
Приём и исследование биоматериала
Когда нужно сдавать анализ Анализ минерального обмена (23 элемента) (плазма)?
Подробное описание исследования
Минералы необходимы для поддержания нормальной жизнедеятельности организма. Они не дают энергии, но обеспечивают нормальное протекание процессов метаболизма, входя в состав ферментов, транспортных белков (в том числе, гемоглобина), обеспечивая прочность зубов и костей, нормальное функционирование нервной системы, работу мышц и сердца.
Жизненно-необходимы человеку микроэлементы, перечисленные ниже. Условно их можно разделить на следующие группы:
Важно понимать, что микроэлементы необходимы организму в очень малых количествах. В высоких дозах они токсичны.
Железо. Оно входит в состав гемоглобина, обеспечивая возможность переноса кислорода и углекислого газа кровью. Также железо входит в состав миоглобина – похожего на гемоглобин белка, который содержится в мышцах и в сердце, который запасет кислород, создавая его резерв. В крови и некоторых органах есть подобный «резервуар», ферритин – железо-белковый комплекс, который содержит этот металл в резервной форме. Если железа в организме будет недостаточно, ферритин обеспечит его дополнительное поступление в кровь.
Медь. Входит в состав ферментов, обеспечивающих клеточное дыхание. Цитохром- с-оксидаза переносит электроны в дыхательной цепи для выработки энергии, а супероксиддисмутаза обезвреживает токсичные активные формы кислорода.
Цинк. Этот металл необходим для синтеза ростовых гормонов: инсулина, гормона роста соматотропина, тестостерона. Он входит в состав фермента алкогольдегидрогеназы, расщепляющей алкоголь, а также необходим для усвоения и использования мощнейшего антиоксиданта – витамина Е. Цинк особенно важен для здоровья мужчин: только с ним возможны выработка спермы и большинства мужских гормонов, и от него зависит здоровье предстательной железы.
Кобальт. Входит в состав витамина В12 (кобаламина), который необходим для синтеза ДНК, нормального кроветворения (при его недостатке может возникнуть анемия). Он же обеспечивает защиту и поддержание жизнеспособности нервных клеток и детоксикационную функцию печени.
Хром. Входит в состав желудочного фермента трипсина, который расщепляет белки. Также принимает участие в метаболизме углеводов и липидов. Его недостаток может привести к повышению уровня холестерина в крови.
Молибден. Входит в состав ферментов, участвующих в тканевом дыхании и обмене азота мочевой кислоты, при нарушении которого может возникнуть подагра. Усиливает эффект антиоксидантов (витаминов С и Е), поддерживает активность иммунной системы.
Никель. Усиливает действие инсулина на клетки организма, не допуская чрезмерного повышения уровня сахара в крови. Усиливает эффективность аскорбиновой кислоты и обеспечивает работу ферментов, участвующих в обезвреживании токсических веществ.
Селен. Сам по себе является антиоксидантом (защищает клетки от действия активных форм кислорода – одной из причин старения организма). Авторитетный медицинский журнал Lancet сообщает, что он показал значительную противораковую активность в отношении опухолей прямой и толстой кишки, простаты, легкого, в целом снижая смертность от онкологических заболеваний на 39%. Селен обладает противоаллергическим действием, улучшает заживление тканей, поддерживает работу сердечно-сосудистой и иммунной систем.
Марганец. Микроэлемент, важный для кроветворения, развития и поддержания здоровья половых желез.
Мышьяк. Необходим организму в очень малых дозах, считается ультрамикроэлементом. Участвует в кроветворении и поддержании иммунитета. Также способствует росту и укреплению костей в детском и молодом возрасте.
Литий. Играет очень важную роль в функционировании нервной системы, снижая ее возбудимость. Препараты лития используются в психиатрии и неврологии для лечения эпилепсии. Принимает участие в обмене углеводов и жиров, обладает легкими противоаллергическими свойствами.
Использованная литература
Другие названия этого исследования
Analysis of mineral metabolism
Подготовка к исследованию
Противопоказания и ограничения
Абсолютных противопоказаний нет.
Интерпретация результата
Возможные причины дефицита минеральных элементов:
Возможные причины избытка минеральных элементов:
Способны ли CAR-Т-клетки уничтожить опухоль?
Т-клетки атакуют опухолевую клетку. Т-клеточная терапия химерным рецептором антигена — это новая форма лечения рака, одобренная FDA. Терапия разработана на собственных Т-клетках пациента для поиска и уничтожения раковых клеток.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Способность использовать иммунные клетки, направленно изменять их и обучать нацеливаться на опухолевые клетки изменила парадигму лечения многих гематологических опухолевых заболеваний, в том числе неходжкинской лимфомы и острого лимфобластного лейкоза. Т-клеточная терапия химерным рецептором антигена (CAR) показала замечательную противоопухолевую активность против В-клеточных опухолей. В 2017 году Управление по санитарному надзору за качеством пищевых продуктов и лекарственных препаратов (FDA) одобрило две терапии CAR-T, что дало шанс на ремиссию и увеличение продолжительности жизни множеству пациентов. Наш обзор посвящен эволюции CAR-T-клеток, способам их производства, а также будущим перспективам использования.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Способность иммунной системы выявлять и уничтожать возникающие опухоли известна давно. Иммунная система играет три основные роли в профилактике опухолей.
Во-первых, она защищает хозяина от вирусных опухолей, устраняя и подавляя вирусные инфекции.
Во-вторых, своевременная ликвидация патогенных микроорганизмов и быстрое устранение воспаления может предотвратить создание воспалительной среды, способствующей онкогенезу.
В-третьих, иммунная система может специфически распознавать и устранять опухолевые клетки на основе присутствия на их поверхности специфических антигенов или молекул, индуцированных клеточным стрессом.
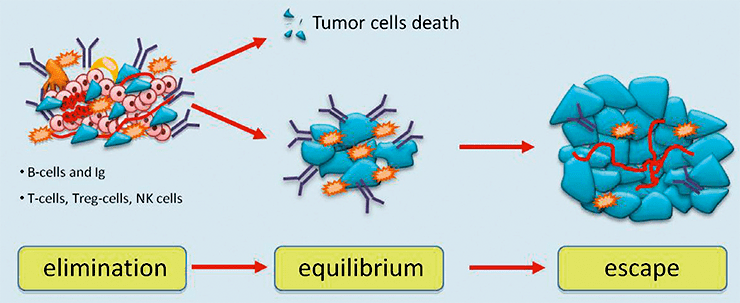
Третий процесс называется иммунным надзором, при котором иммунная система способна выявлять раковые и предраковые клетки и уничтожать их до того, как они начнут причинять вред организму. Несмотря на иммунный надзор, опухоли развиваются в присутствии функционирующей иммунной системы. Этот процесс делится на три стадии, или фазы: устранения, или элиминации (elimination), равновесия (equilibrium) и избегания (escape) (рис. 1) [1–4].
Рисунок 1. Три фазы иммуноредактирования рака. Различные иммунные реакции уничтожают опухоль. Однако некоторые опухолевые клетки могут вступить в фазу равновесия с иммунными клетками. Опухоль не увеличивается, но и не исчезает. Со временем опухолевые клетки могут выйти из-под иммунного надзора и расти, вызывая увеличение массы опухоли.
Фаза элиминации — это процесс обнаружения и уничтожения опухолевых клеток иммунной системой. Фаза элиминации завершается либо уничтожением всех опухолевых клеток, либо только их части. В случае частичной элиминации между иммунной системой и опухолью может развиться временное состояние равновесия.
В течение фазы равновесия опухолевые клетки могут оставаться в состоянии покоя или продолжать развиваться и накапливать мутации. Во время этой фазы иммунная система способна контролировать прогрессирование опухоли, но иммунный ответ все еще не может полностью уничтожить ее. При этом происходит отбор опухолевых клеток, которые способны подавлять иммунный ответ, приводящий к фазе избегания.
Во время фазы избегания иммунная система больше не может сдерживать прогрессирование опухоли. Противоопухолевый иммунный ответ существует в организме, но, к сожалению, он не настолько эффективен, чтобы полностью сдерживать мишень, в результате чего опухоль подавляет его.
Тем не менее данная концепция стала основой современной иммуноонкологии, включая клеточную адоптивную терапию, которая заключается в использовании иммунных клеток для лечения рака [5]. Клеточная терапия CAR-T является формой адоптивной терапии. Она привлекла к себе особое внимание благодаря успехам в клинических испытаниях уже двух одобренных FDA таких стратегий лечения опухолевых заболеваний [5].
Как и другие методы лечения опухолей, это не решает полностью проблему эффективности лечения, но предоставляет клиницистам еще один ресурс в их арсенал, который сегодня включает хирургические, химиотерапевтические, радиационные и иммунотерапевтические методы, в том числе использование антител, цитокинов, онколитических вирусов, биспецифических молекул [6].
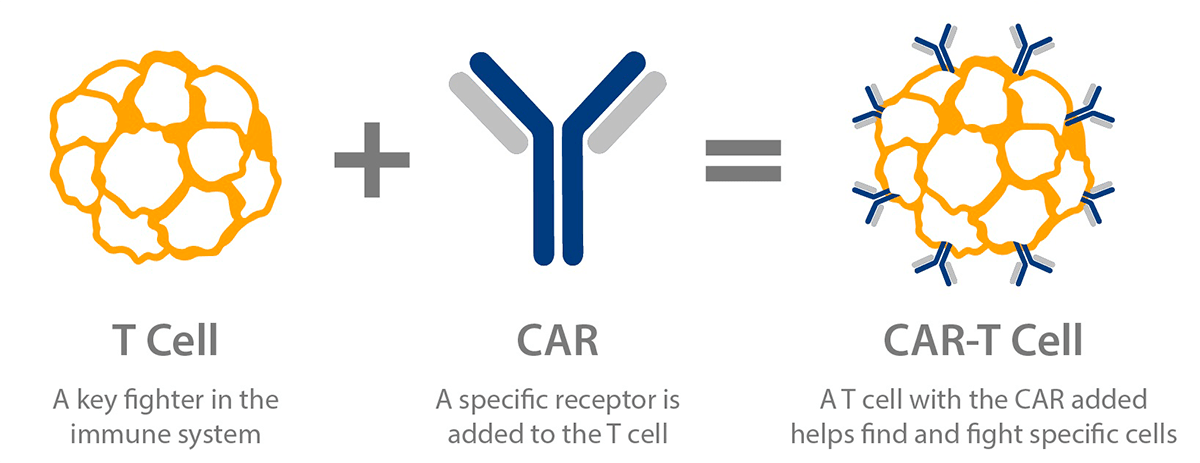
Что такое CAR-T-клетки?
Т-клетки, несущие химерный антигенный рецептор, или CAR-T-клетки, — это генно-инженерные Т-клетки, выставляющие CAR на своей поверхности (рис. 2) [5]. CAR является модифицированным поверхностным рецептором, который прибавляет специфичность Т-клеткам к предварительно определенному антигену-мишени, выставленному на опухолевых клетках [5], [7]. Например, CD19 CAR-T-клетки несут на своей поверхности химерный рецептор, нацеленный против CD19 — трансмембранного белка, который синтезируется во всех лимфоцитах линии В, в том числе при В-клеточных лейкозах и лимфомах [5], [7], [8].
Рисунок 2. Схема CAR-T-клеток. Т-клетка несет на своей поверхности специфический рецептор, называемый химерным антигенным рецептором, который помогает находить определенные виды клеток и уничтожать их.
Структура и механизм действия CAR-T-клеток
Все Т-клетки берут свое начало в красном костном мозге, дифференцируясь из гемопоэтических стволовых клеток. Затем они мигрируют в тимус, который создает среду, необходимую для дальнейшей дифференцировки. Стадии дифференциации тимоцитов зависят от выставления на поверхность различных маркеров. На ранней стадии они не синтезируют корецепторы (CD4 и CD8), поэтому называются двойными негативными. На следующей стадии производятся оба рецептора. Такие тимоциты носят название двойных позитивных. В конце концов, клетки начинают выставлять на поверхность только один из корецепторов. При выставлении CD8 Т-клетка связывается с МНС (главным комплексом гистосовместимости) I класса и в дальнейшем становится эффекторной клеткой, то есть цитотоксическим Т-лимфоцитом; а при выставлении CD4 — с МНС II класса, и становится Т-хелпером, то есть помощником [10–14].
В итоге образуются наивные Т-клетки, которые успешно прошли селекцию, но не контактировали с антигеном. После распознавания антигена, Т-клетки активируются и начинают выполнять свои функции в организме [11].
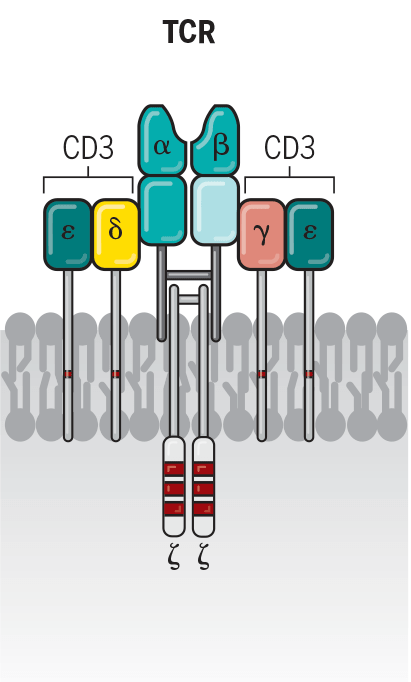
Рисунок 3. Т-клеточный рецепторный комплекс
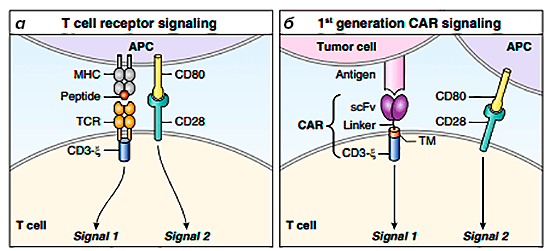
Т-клеточный рецептор (TCR) выставляется на поверхность зрелых Т-клеток. Он состоит из двух цепей и принадлежит суперсемейству иммуноглобулинов. Цепи имеют сходное строение и могут принадлежать двум классам: альфа и бета, гамма и дельта. Более 95% зрелых Т-клеток имеют рецептор с альфа- и бета-цепями. Однако только один Т-клеточный рецептор не способен активировать Т-клетку. Он является частью рецепторного комплекса, который в сочетании с несколькими структурами обеспечивает возникновение сигнала (рис. 3). К этим структурам относятся: CD3-комплекс (CD3γ-, CD3δ-, CD3ε-цепи) и ζ-цепи, которые содержат ITAMs (immunoreceptor tyrosine-based activation motifs). После распознавания антигена происходит фосфорилирование тирозиновых остатков ITAMs, в результате чего запускается весь сигнальный каскад. Такой сигналинг называется сигналом 1, он необходим, но не достаточен для активации Т-клеток. Для активации необходимо сочетание сигнала 1 и сигнала 2. Сигнал 2 — это взаимодействие корецептора с соответствующим лигандом на той же антигенпрезентирующей клетке [10–13].
Костимулирующие рецепторы стабилизируют взаимодействие антигенного рецептора и комплекса «пептид—МНС», которое может быть непрочным и недостаточно продолжительным для активации рецептора [11], [12]. Также наличие двух сигналов необходимо для того, чтобы активация клеток происходила только тогда, когда она нужна. Активированный Т-лимфоцит убивает зараженную клетку или выделяет цитокины, привлекающие другие иммунные клетки [11].
Таким образом, Т-клеточный рецептор состоит из антиген-специфических α- и β-цепей, связанных с комплексом CD3, который определяет целевой антиген, представленный в контексте главного комплекса гистосовместимости (МНС) [4], [5].
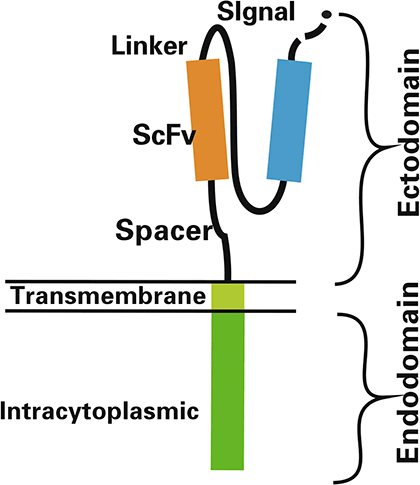
Рисунок 4. Структура химерного антигенного рецептора (CAR)
Основной задачей химерных рецепторов является использование цитотоксического потенциала Т-лимфоцитов путем замены собой TCR. Химерными они называются потому, что «собраны» в единый рецептор из комплексов различного происхождения [13].
CAR включает эктодомен, трансмембранный домен и эндодомен (рис. 4).
Все эти домены методами генной инженерии собраны в одну аминокислотную последовательность, то есть кодируются одним геном. Такая структура позволяет целенаправленно активировать Т-лимфоциты при контакте с клетками-мишенями и не зависеть от МНС, то есть появляется возможность распознавать любые антигены, а не только пептидные [12], [16].
Эволюция CAR-T-клеток
Начала CAR
Иммунологи годами боролись за то, чтобы перепрограммировать иммунную систему для борьбы с раком. Достижения в области ретровирусных систем, используемых для генетической инженерии иммунных клеток, впервые продемонстрировали многообещающие результаты с рецепторами Т-клеток, предназначенными для нацеливания на опухолевые пептиды [17], [18]. Положительные результаты были замечены, в частности, при синовиальной саркоме и меланоме, но методы лечения на основе TCR ограничены вариантами главного комплекса гистосовместимости, которые уменьшают количество потенциальных пациентов: многообразие этих белков настолько велико, что каждый человек обладает индивидуальным набором [8].
Учитывая все ограничения, Зелиг Эшхар первым выработал концепцию и получил первую Т-клетку с химерным рецептором, который впоследствии стал известен как рецептор химерного антигена (CAR) [19].
Т-клеточный рецептор включал ζ-сигнальный домен CD3, подобно TCR, но заменял субъединицы α и β одноцепочечным вариабельным фрагментом (scFv) из антитела (рис. 5). Этот единственный маневр после более чем десяти лет исследований и улучшений превратился в первую чрезвычайно успешную целевую иммунотерапию при рецидивах и рефрактных злокачественных новообразованиях В-клеток [8].
Рисунок 5. Схема строения TCR и CAR первого поколения. а — Эндогенный TCR при обнаружении комплекса пептид—МНС на антигенпрезентирующей клетке обеспечивает сигнал 1 через домен CD3-дзета. Полная активация не достигается, пока не будет обеспечен сигнал 2 (например, взаимодействие CD80—CD28). б — CAR-клетки 1 поколения основаны на МНС-независимом взаимодействии для обеспечения сигнала 1, однако не происходит полной активации вследствие отсутствия дополнительной стадии костимуляции.
CAR первого поколения проявляли активность в доклинических исследованиях, однако ранние испытания на людях показали минимальную активность из-за неполной активации Т-клеток [5], [8].
Второе и третье поколения
Наблюдения Мартина Пуля за пациентами, получившими CAR-T-клетки первого поколения, показали ограничения такого вида терапии [20]. После инфузии CAR-T-клеток только у 5 из 11 пациентов были обнаружены циркулирующие CAR-T-клетки. Это говорит о том, что у некоторых пациентов CAR-T-клетки взаимодействовали с антигенами опухоли (сигнал 1). То есть они были способны успешно нацеливаться и взаимодействовать с злокачественными клетками, но не способны их уничтожить, так как им не удавалось полностью активироваться (отсутствовал сигнал 2). У остальных пациентов не были обнаружены CAR-T-клетки, так как активация не происходила. Одной из причин отсутствия активации являлось то, что многие раковые клетки, особенно при остром лимфоцитарном лейкозе, подавляют действие иммунных клеток, вмешиваясь в костимуляторный сигналинг [8], [21].
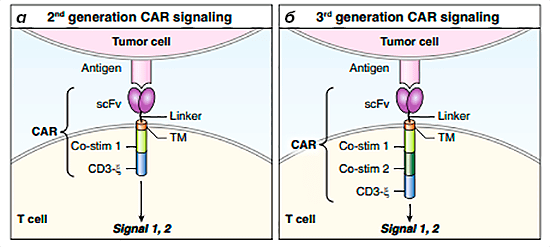
Этот барьер был преодолен в ходе разработки CAR второго и третьего поколений (рис. 6). CAR второго поколения пытались обойти это ограничение путем включения костимуляторного домена непосредственно в рецептор [3], [5]. Костимулирующие молекулы работают в тандеме с CD3: CD3, обеспечивая активацию Т-клеток, усиливают пролиферацию и выживаемость клеток, а также обеспечивают выработку цитокинов [8]. Существует несколько доменов-кандидатов, но чаще всего используются CD28 и 4-1BB (CD137).
Рисунок 6. Схема строения CAR-T-клеток второго и третьего поколений. а — Интеграция CD3-ζ и костимуляторного домена в одном и том же рецепторе дает CAR 2 поколения способность полностью активировать Т-клетки за один этап. б — CAR 3 поколения включают два костимулирующих домена с CD3-ζ.
Таким образом, добавление костимулирующей молекулы к ζ-домену CD3 значительно усиливает функцию CAR-T-клеток. Важно, что это достигается за счет одного взаимодействия с антигеном-мишенью, а не с помощью многоэтапного процесса, зависящего от активированных антигенпрезентирующих клеток. Кроме того, отрицательные иммуномодуляторы, такие как регуляторные Т-клетки или другие иммуносупрессивные сигналы от опухолей или микроокружения, не влияют на костимуляцию CAR, по крайней мере, в течение начального периода действия [8].
К сожалению, CAR третьего поколения, содержащие CD3-ζ и два костимуляторных домена, не были более успешными, чем их аналоги второго поколения [22]. Несмотря на эффективное уничтожение опухолевых клеток в кратковременных анализах цитотоксичности in vitro, тестирование in vivo не было настолько эффективным. Во-первых, это могло быть связано с чрезмерной активаций CAR-T-клеток, что приводило к потере аутотолерантности и последующему апоптозу. Во-вторых, у ряда пациентов наблюдалось ингибирование активности CAR-T-клеток [23].
Четвертое и последующие поколения
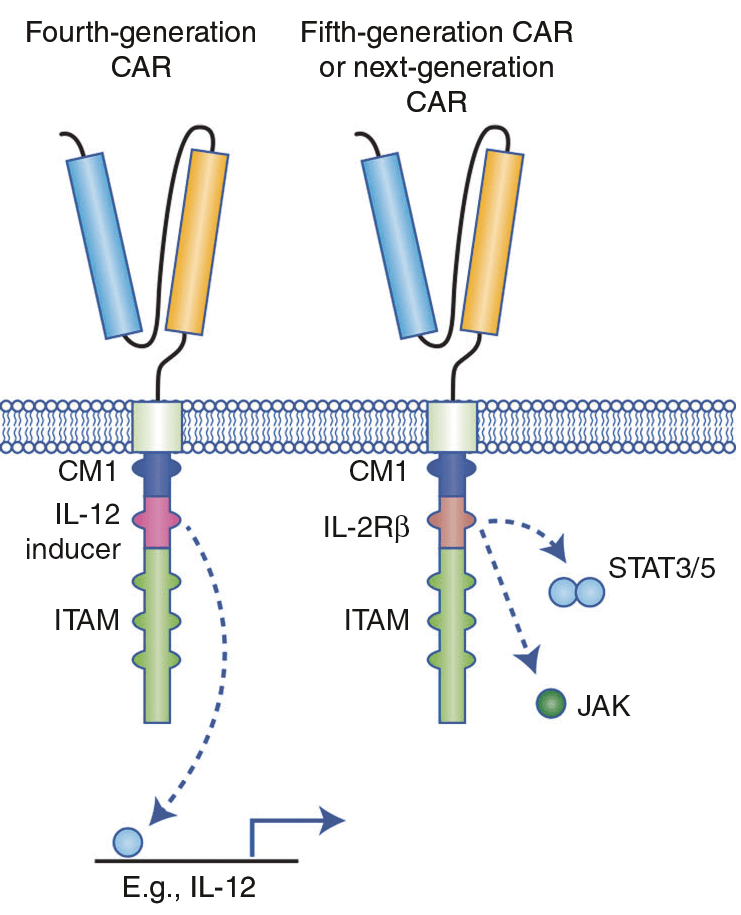
В дополнение к CAR второго и третьего поколений были созданы «бронированные» CAR, или CAR четвертого поколения (рис. 7) [5]. Они были получены путем добавления доменов, кодирующих иммуностимулирующие цитокины (IL-2, IL-12, IL-8, IL-15, IL-18). Их добавление к основанию конструкций второго поколения позволяет увеличить экспансию CAR-T-клеток, в то же время делая их устойчивыми к иммуносупрессивной среде опухоли. Однако чрезмерная экспрессия иммуностимулирующих цитокинов может привести к ряду побочных эффектов, поэтому необходимо уделить особое внимание безопасности данного вида терапии [24].
Рисунок 7. Структура CAR четвертого и последующих поколений. CAR четвертого поколения были основаны на CAR второго поколения в паре с конститутивно или индуцибельно синтезируемым хемокином (например, IL-12).
Пятое и следующие поколения также основаны на CAR 2 поколения с добавлением внутриклеточных доменов цитокиновых рецепторов [22].
Применение CAR-T-терапии
Клинические испытания CAR-T-клеток в лечении злокачественных новообразований В-клеток разворачивались быстро. В-клетки являются привлекательной мишенью, так как несут на своей поверхности специфические молекулы, такие как CD19, CD20 и CD22, которые не характерны для других типов клеток. Результаты доклинических исследований показали, что опухоли В-клеток могут быть уничтожены CAR-T-клетками. Первые клинические исследования на пациентах с хроническим лимфолейкозом, острым лимфоцитарным лейкозом и неходжкинской лимфомой показали замечательные противоопухолевые эффекты CD19-специфических CAR-T-клеток [6]. В настоящее время CAR-T-клеточная терапия одобрена FDA в качестве стандарта лечения некоторых форм агрессивной, рефрактерной неходжкинской лимфомы и пациентов с рецидивирующим или рефрактерным острым лимфобластным лейкозом в возрасте до 25 лет [8], [25], [26].
Кроме того, на стадии клинических исследований находятся CAR-T-клеточные терапии для других форм онкогематологических заболеваний, например, В-крупноклеточной лимфомы, хронического лимфолейкоза, малой лимфоцитарной лимфомы [6–8], [26].
Таким образом, в основном CAR-T-терапия используется при гематологических злокачественных новообразованиях, когда неконтролируемое размножение и рост злокачественных клеток затрагивает саму кровь, костный мозг, лимфу и ликвор [8].
Однако эти успехи еще не были воспроизведены на арене сóлидных (плотных) опухолей.
Эффективность CAR-T-клеток при гематологических злокачественных новообразованиях частично может быть объяснена наличием лучшего доступа к опухолевым клеткам в костном мозге и лимфатических узлах, где обычно перемещаются T-клетки [8]. Распознавание сóлидных опухолей требует выхода терапевтических Т-клеток из крови в опухоль, а многие злокачественные новообразования развиваются так, что их инфильтрация затруднена. В данном случае может быть эффективным региональное, а не системное введение CAR-T-клеток [8].
Также в отличие от гематологических злокачественных новообразований, терапия сóлидных опухолей встречает на своем пути множество проблем. Помимо неполной активации CAR первого поколения, одним из возможных объяснений недостаточной эффективности T-клеток CAR в сóлидных опухолях может быть микроокружение опухоли, которое часто является иммуносупрессивным, или неэффективный перенос Т-клеток CAR в опухоль [8].
Побочные эффекты CAR-T-терапии
Однако нужно быть реалистами. CAR-T-клетки — это не чудодейственное лекарство от рака. CAR-T-терапия, как и другие методы лечения онкологических заболеваний, имеют нежелательные эффекты. Несмотря на то, что эта терапия работает там, где другие методы бессильны, у нее довольно много тревожных и потенциально смертельных токсических побочных эффектов.
Существует несколько механизмов, влияющих на развитие побочных эффектов при инфузии CAR-T-клеток. Во-первых, это влияние на мишень, которое возникает в результате интенсивного высвобождения цитокинов из Т-клеток CAR. Во-вторых, это повреждения, нанесенные нормальной ткани в результате производства ею антигена-мишени либо белка, перекрестно взаимодействующего с CAR. Также в ряде исследований сообщалось об аллергических реакциях и синдроме лизиса опухоли — метаболического нарушения, вызванного гибелью большого количества клеток опухоли за короткий период времени, при котором их содержимое попадает в кровь [5], [8], [27]. В литературе наиболее часто упоминаются два специфических эффекта: синдром высвобождения цитокинов и нейротоксичность [5], [8], [28].
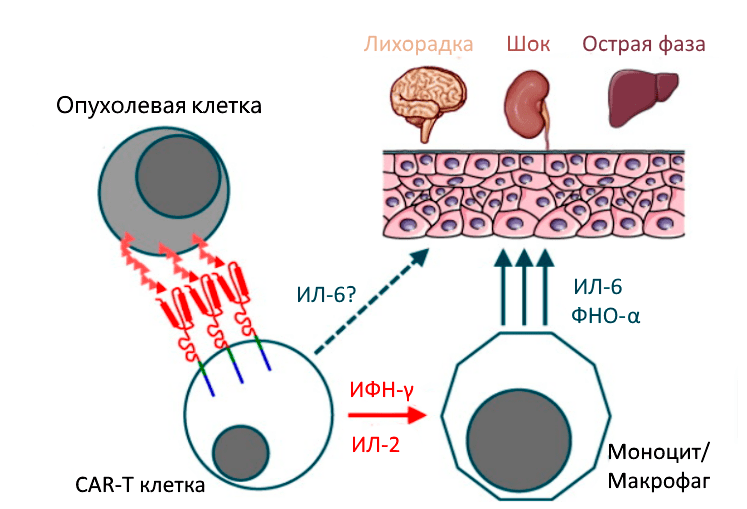
В рамках своих обязанностей, связанных с иммунитетом, Т-клетки высвобождают цитокины — химические мессенджеры, которые помогают стимулировать и направлять иммунный ответ. В случае цитокинового шторма происходит быстрое и массивное выделение цитокинов в кровоток, что может привести к опасно высокой температуре и резким падениям артериального давления (рис. 8) [5].
Рисунок 8. Цитокиновый шторм. У пациентов с массивной опухолью высок риск развития тяжелого цитокинового шторма. Ранними маркерами являются высокие уровни IL-6, IL-15, IL-8 INF-γ до введения или в течение одного дня после введения. Поэтому стандартом применения CAR-T-терапии является обязательная госпитализация пациента.
Синдром цитокинового шторма характеризуется высокими уровнями интерлейкина-6 (IL-6) и интерферона-γ (IFN-γ). Для его предупреждения используется тоцилизумаб — антагонист IL-6, одобренный FDA [5], [8]. Глюкокортикоиды показаны при отсутствии быстрого ответа на тоцилизумаб [5].
Нейротоксичность была отмечена множеством исследовательских групп, тестирующих CD19 CAR-T-клетки [5], [8]. Обычно сообщаемые симптомы включают головную боль, делирий, афазию, очаговый неврологический дефицит, судороги и потерю сознания. Патофизиология неврологических симптомов еще не выяснена, но обычно она полностью обратима, за исключением нескольких случаев фатального кровоизлияния в мозг или отека [5].
Как и в случае с другими методами иммуномодуляции, лечение Т-клетками CAR может предрасполагать к инфекциям. Пациенты, получающие Т-клетки CAR, часто страдают лимфопенией и нейтропенией, что делает их восприимчивыми к оппортунистическим инфекциям [5], [8].
Механизмы сопротивления опухолей
Существует несколько механизмов развития устойчивости к CAR-T-терапии: антиидиотипические антитела, утрата опухолевого антигена, мутация антигенного гена, встраивание CAR в лейкемические клетки [5], [29].
ScFv, используемые для производства CAR, могут быть получены из мышиных моноклональных антител. На данный фрагмент может выработаться иммунный ответ, который ингибирует действие CAR-T-клеток, что делает терапию неэффективной [1]. Для решения проблемы можно использовать человеческие scFv, которые устранят образование антител против мышиных последовательностей, но вероятность появления антиидиотипических антител все же сохраняется [5].
Пониженная регуляция или потеря презентации целевого антигена на лейкозных клетках является механизмом, приводящим к рецидиву опухоли [30]. Значительный объем данных в этом отношении поступает из исследований, включающих использование анти-CD19 CAR. Утрата презентации антигена и переключение опухолевой линии на синтез другого антигена являются двумя различными способами потери CD19, описанными в литературе [5]. Если после ремиссии происходит рецидив с утратой целевого антигена, то развивается фенотипически сходное заболевание. В случае CD19-клеток, переключение клонов приводит к фенотипически различному, но генетически связанному злокачественному новообразованию, например, острому миелолейкозу [5], [30]. Разработка CAR, нацеленных на более чем один антиген, может потенциально помочь в преодолении утраты антигена.
В 2018 году описан случай, когда ген CAR был случайно включен в лейкозную B-клетку во время конструирования T-клеток. Это, в свою очередь, привело к получению продукта, который связывался с эпитопом CD19 на поверхности лейкозной клетки и, следовательно, маскировал его от распознавания терапевтическими Т-клетками. У пациента отмечался рецидив. Пациент получил спасательную химиотерапию и иммунотерапию, но в конце концов скончался [5], [7].
Производство CAR-T-клеток
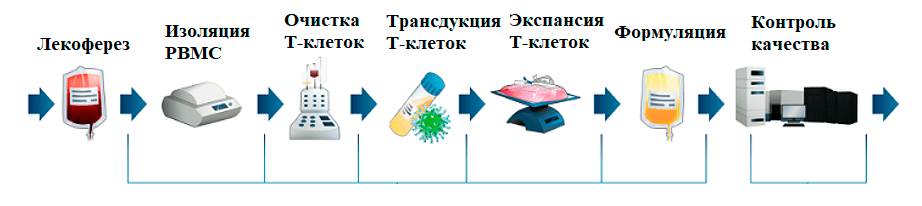
Несмотря на различные конструкции, процедура производства CAR-T-клеток остается неизменной. Она включает в себя сбор у пациента Т-клеток с их последующей обработкой и подготовкой: активацией Т-клеток, их генетической модификацией, крупномасштабной экспансией, формованием [8].
Далее более подробно рассмотрим каждый из этапов производства (рис. 9).
Рисунок 9. Схема производства CAR-T-клеток
1. Источник Т-клеток. Поскольку зарегистрированные CAR-T — аутологичная клеточная терапия, процесс производства CAR-T-клеток начинается со сбора мононуклеарных клеток периферической крови у пациента, обычно с помощью лейкафереза. Врачи выбирают подходящее время для сбора на основе схемы лечения, чтобы обеспечить достаточное количество Т-лимфоцитов. Ориентировочно необходимо 100×10 6 клеток, следовательно, сбор желательно проводить до курсов химиотерапии [8], [31].
2. Обработка Т-клеток. Собранные продукты лейкафереза могут быть обработаны различными способами в зависимости от дальнейших процедур. Т-клетки отбираются с помощью проточного центрифугирования. Обработанный исходный материал может быть использован непосредственно для последующей процедуры или криоконсервирован для будущего использования [8], [31].
3. Т-клеточная активация. Для дальнейшей трансдукции необходимо активировать клетки. Существует множество методов активации, но обычно используется синтетический поликлональный активатор, связывающийся с рецепторами CD3 и CD28 [20].
4. Генетическая модификация Т-клеток. Современные методы модификации Т-клеток в значительной степени основаны на стабильной экспрессии CAR при доставки вирусными и невирусными системами переноса генов. Существует три основных подхода к стабильной экспрессии генов:
Ретровирусы, γ-ретровирус (γ-RV) и лентивирусы (LV), остаются основным механизмом трансдукции Т-клеток [8]. Вирусные векторы обеспечивают высокую эффективность переноса генов и стабильный уровень экспрессии CAR. Однако ретровирусные векторы представляют собой сложные биологические реагенты, которые требуют постоянного и дорогостоящего тестирования биобезопасности. Также существует высокий риск возникновения в них спонтанных мутаций, которые могут привести к развитию онкологических заболеваний [5], [8], [31].
Относительно новая система экспрессии на основе плазмидной системы транспозон/транспозаза обладает рядом преимуществ: простая производственная процедура и относительно низкая стоимость. Однако интеграция конструкта является случайной и, соответственно, представляет потенциальный онкогенный риск. При этом исследования показали низкую токсичность для Т-клеток. Однако эффективность CAR-T-клеток, получаемых этим методом, еще предстоит продемонстрировать [8], [32].
Использование матричной РНК для трансфекции обеспечивает кратковременную экспрессию в цитоплазме. В этом процессе не происходит никакой геномной интеграции, и поэтому устраняются проблемы генотоксичности [8], [31].
5. Экспансия CAR-T-клеток. Этот процесс происходит в биореакторе в течение нескольких дней под действием цитокинов (IL-2, IL-7, IL-15), поддерживающих пролиферацию Т-клеток [31].
6. Промывка и концентрирование продукта [31].
7. Контроль качества клеточного продукта [31]. Согласно правилам GMP, качество продукта закладывается при его разработке и проверяется на каждом этапе производства. В связи со сложной природой клеточных продуктов необходимо тщательно продумать список тестов, чтобы обеспечить безопасность, чистоту и эффективность.
Так, безопасность CAR-T-клеток определяется по отсутствию загрязнителей: эндотоксина, микоплазмы, компетентного по репликации ретровируса. Чистота продукта зависит от соотношения количества определенных уровней активированных и неактивированных CD3+ и CAR+ Т-клеток CAR. Примеси, такие как нежелательные типы клеток, опухолевая нагрузка и др., должны быть ниже определенных установленных уровней [33]. До настоящего времени активность клеток CAR-T часто определяли анализом цитотоксических Т-лимфоцитов in vitro или секрецией интерферона-γ [33].
8. Криоконсервация для удобства транспортировки [31].
9. Инфузия пациенту готового продукта [31].
Доставка персонализированных лекарств зависит от параметров высвобождения сложных биологических молекул, входящих в их состав. Качество клеточных продуктов CAR-T изменяется от донора к донору, но также в значительной степени зависит от условий производства, качества и доступности вспомогательного сырья и материалов [31].
Производство CAR-T должно соответствовать требованиям GMP. Согласно им, чистые помещения должны быть надлежащим образом оборудованы системами обеспечения условий окружающей среды (кондиционер), оборудованием для мониторинга окружающей среды (счетчик частиц), технологическим (биореакторы) и аналитическим (автоматические счетчики клеток) оборудованием. Еще одним ключевым компонентом GMP-производства является наличие высококвалифицированного персонала, обладающего обширными знаниями в области производства [31].
Тщательное документирование и своевременный анализ производственных процессов являются важной частью GMP-производства и необходимы для успешного выполнения сложной процедуры изготовления клеток CAR-T [33].
Производство включает в себя использование различных вспомогательных компонентов (культуральной среды, цитокинов, реагентов для генетической модификации, криоконсервации и т.д.). Все материалы и сырье, используемое при производстве клеточного продукта, должны пройти тщательный контроль [33].
Будущие направления
Разработка CAR-T-клеток, которые успешно убивают свои клетки-мишени, является сложной задачей. Вероятно, может потребоваться разработка нескольких CAR для нескольких мишеней одной и той же опухоли, поскольку опухоль стремится ускользнуть от действия терапии. Так, у пациентов с лейкемией, получавших иммунотерапию, направленную на CD19, через некоторое время обнаруживаются CD19-отрицательные клоны [8]. Ориентация на несколько антигенов опухоли, конечно, добавит трудностей в и без того сложный процесс разработки успешной терапии, однако это поможет в борьбе с резистентностью опухолевых клеток.
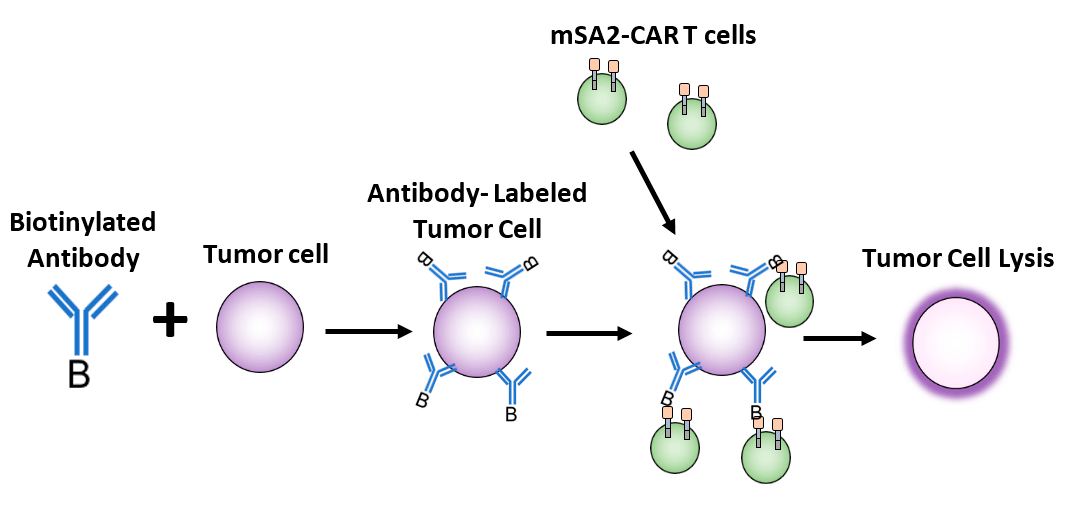
Другим подходом к нацеливанию на опухолевые антигены может стать разработка одного универсального CAR. Например, CAR, нацеленный на биотин. В этом случае пациенту предварительно вводят биотинилированные моноклональные антитела к опухолевым антигенам — таким образом происходит маркировка опухолевых клеток. Затем уже вводят CAR-T-клетки со специфичностью к биотину (рис. 10). Такие препараты уже разрабатываются и сейчас находятся на ранних стадиях доклинических исследований [35].
Рисунок 10. Механизм действия CAR-T-клеток, нацеленных на биотин
Разрабатываются различные методы усиления иммунотерапии и модуляции микроокружения для обеспечения более эффективного эндогенного иммунного надзора за опухолями [5], [8]. То есть вместо того, чтобы блокировать ингибирующие сигналы с помощью моноклональных антител, они заменяются на стимулирующие. Например, это может быть достигнуто добавлением второго химерного рецептора PD-1 в сигнальный домен CD28 CAR-T-клеток. Рецептор PD-1 выставляется на поверхность активированных Т- и В-клеток. Он относится к иммунологическим контрольным точкам, которые участвуют в регуляции иммунного ответа. Взаимодействие PD-1 с лигандом PD-L1 на опухолевых клетках и клетках опухолевого микроокружения способствует подавлению противоопухолевого иммунного ответа [36], [37]. Использование PD-1 в качестве второго химерного рецептора обеспечивает дополнительную стимуляцию, которая преодолевает ингибирование [8]. Таким образом, механизмы, способствующие иммунологическому избеганию опухоли, могут быть использованы для устранения злокачественных новообразований.
Один из перспективных способов нацелить Т-клетки на опухоль — использование аллогенной (или полученной от здорового донора) CAR-T-терапии, где Т-клетки от здорового донора модифицированы для использования у нескольких пациентов. Тем не менее аллогенная терапия имеет свой собственный набор проблем, которые необходимо преодолеть, а именно: опасный для жизни побочный эффект, называемый реакцией трансплантата против хозяина. Он возникает, когда донорские CAR-T-клетки распознают клетки пациента как чужеродные и атакуют их. Однако большинство разработок CAR-T-терапий, нацеленных на B-клеточные опухоли, в настоящее время направлены на использование аллогенных Т-клеток [6–8].
Несмотря на ранний успех, область CAR-T-клеточной терапии все еще находится в стадии становления, и пройдет некоторое время, прежде чем она увидит свет в качестве традиционной терапии. Время, необходимое для подготовки пациентов к инфузии, высокая цена самой терапии и значительные расходы на здравоохранение, связанные с ее назначением, являются существенными ограничивающими факторами для обеспечения доступности такой терапии широкому кругу пациентов [8].
Дальнейшие исследования в области Т-клеточной терапии должны привести к более быстрому производству, расширению использования готовых продуктов с более низкой токсичностью, что поможет сделать CAR-T-терапию более дешевой и доступной.