кевзара препарат для чего назначают
Клиническое исследование препарата для лечения тяжелой формы COVID-19
Исследование 2/3 фазы о развитии острого респираторного дистресс-синдрома у пациентов с тяжелой формой COVID-19
Первый пациент за пределами США получил лечение в рамках международного клинического исследования по оценке применения препарата Кевзара® (сарилумаб) у пациентов, госпитализированных с тяжелой формой коронавирусной инфекции COVID-19. В настоящее время реализация международной программы клинических исследований уже начата, получено одобрение на проведение исследования в Италии, Испании, Германии, Франции, Канаде, России и США — во всех странах, затронутых коронавирусной инфекцией COVID-19.
Это второе многоцентровое двойное слепое исследование фазы 2/3 в рамках программы исследования применения данного препарата при коронавирусной инфекции COVID-19, и компании продолжают работать с органами здравоохранения по всему миру для обеспечения начала исследования в клинических центрах. Оно инициировано после объявления компаниями Санофи и Regeneron ранее в этом месяце о начале первого исследования в США.
Сарилумаб является полностью человеческим моноклональным антителом, ингибирующим путь ИЛ-6 посредством связывания и блокады рецептора ИЛ-6. ИЛ-6 может играть важную роль в инициации сверхактивного воспалительного ответа иммунной системы в легких пациентов с тяжелой или критической формой коронавирусной инфекции COVID-19. Роль ИЛ-6 подтверждается предварительными данными, полученными в ограниченном исследовании в Китае с использованием другого ингибитора рецептора ИЛ-6.
Данные из ограниченного исследования в Китае указывают на то, что путь интерлейкина 6 может играть важную роль в сверхактивном воспалительном ответе в легких пациентов с коронавирусной инфекцией COVID-19. Несмотря на эти обнадеживающие результаты, крайне важно провести надлежащим образом запланированное рандомизированное исследование для понимания реального воздействия препарата.
В исследовании за пределами США будут оценивать безопасность и эффективность добавления однократной внутривенной дозы препарата Кевзара® к стандартной поддерживающей терапии в сравнении с поддерживающей терапией, используемой в комбинации с плацебо. У данного исследования адаптивный дизайн с двумя частями. Ожидается, что будет включено приблизительно 300 пациентов. Для участия в клиническом исследовании будут набраны пациенты из нескольких стран с тяжелой или критической формой коронавирусной инфекции COVID-19.
Согласно предварительным научным данным ИЛ-6 может играть ключевую роль в инициации воспалительного иммунного ответа, который приводит к развитию острого респираторного дистресс-синдрома (ОРДС) у пациентов с коронавирусной инфекцией COVID-19, находящихся в критическом состоянии. Предварительные результаты изучения серии клинических случаев у 21 пациента в Китае (без внешнего рецензирования) показали, что у пациентов c коронавирусной инфекцией COVID-19 наблюдалось быстрое снижение температуры тела, а у 75 % пациентов (15 из 20) отмечалось снижение потребности в проведении оксигенотерапии в течение нескольких дней после применения другого антитела к рецептору ИЛ-6 (тоцилизумаб). Согласно этим результатам Китай обновил свои руководства по лечению пациентов с коронавирусной инфекцией COVID-19 и одобрил использование указанного ингибитора ИЛ-6 для лечения пациентов с тяжелой или критической формой течения заболевания.
Кевзара
Показания к применению
В комбинации с метотрексатом показан для лечения ревматоидного артрита умеренной или высокой степени активности у взрослых пациентов при недостаточном ответе на терапию одним или несколькими болезнь-модифицирующими антиревматическими препаратами (БМАРП) или при их непереносимости.
Может назначаться в монотерапии при непереносимости метотрексата или при нецелесообразности терапии метотрексатом.
Возможные аналоги (заменители)
Действующее вещество, группа
Лекарственная форма
Раствор для подкожного введения
Противопоказания
Повышенная чувствительность к активному веществу или любому вспомогательному компоненту препарата.
Активные серьезные инфекционные заболевания.
Дети в возрасте до 18 лет в связи с неустановленными эффективностью и безопасностью у детей с ревматоидным артритом.
У пациентов с хронической или рецидивирующей инфекцией; серьезными или оппортунистическими инфекциями в анамнезе; с сопутствующими заболеваниями, предрасполагающими к развитию инфекций; после контакта с больными туберкулезом; проживавших или посещавших регионы, эндемичные по туберкулезу или микозам (необходимо оценить соотношение пользы и риска перед началом применения, см. раздел ‘Особые указания’).
У пациентов с ВИЧ-инфекцией;
У пациентов с повышенным риском развития перфорации желудочно-кишечного тракта.
У пациентов пожилого возраста (в связи с более высокой частотой развития инфекций у данной категории пациентов).
Ограничения по применению препарата в зависимости от возраста пациента приведены в разделе ‘Способ применения и дозы’.
Как применять: дозировка и курс лечения
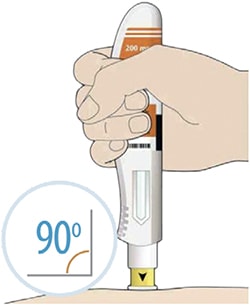
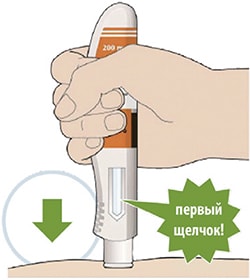
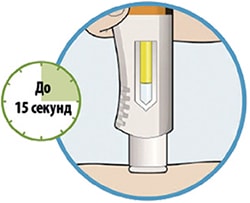
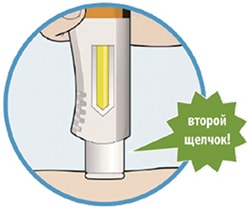
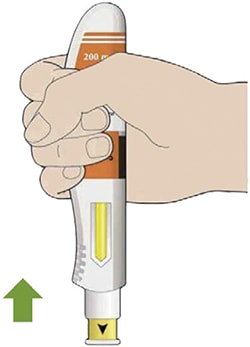
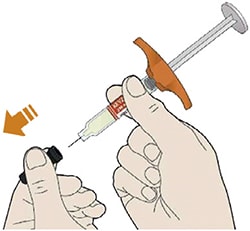
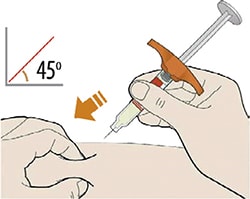
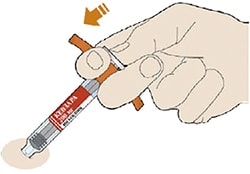
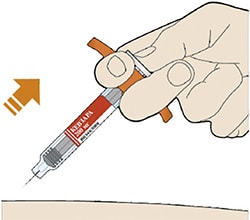
Препарат вводят подкожно.
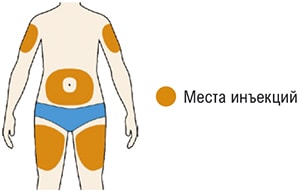
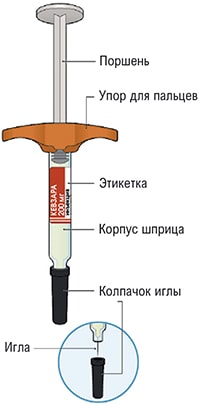
Все содержимое (1,14 мл) предварительно заполненного шприца/предварительно заполненной шприц-ручки следует вводить подкожно. Места инъекций (область живота, наружная поверхность бедра, наружная поверхность плеча) следует чередовать при каждой инъекции. Не следует вводить препарат в болезненную и поврежденную кожу, в места с кровоподтеками и рубцами.
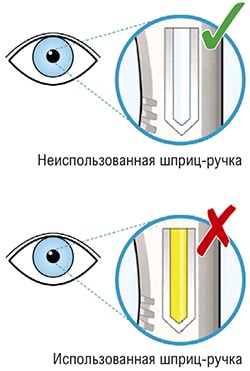
Пациент может самостоятельно выполнять подкожную инъекцию, или ее может выполнять лицо, осуществляющее уход за пациентом. Пациент или лицо, осуществляющее уход за пациентом, до начала применения должны быть обучены подготовке и введению препарата.
Лечение должно назначаться и проводиться под контролем специалистов, имеющих опыт диагностики и лечения ревматоидного артрита.
Рекомендуемая доза составляет 200 мг 1 раз каждые 2 недели. Препарат вводят подкожно.
При развитии нейтропении, тромбоцитопении, повышении активности ‘печеночных’ ферментов рекомендуется уменьшить дозу с 200 мг 1 раз каждые 2 недели до 150 мг 1 раз каждые 2 недели.
Фармакологическое действие
В функциональных исследованиях на человеческих клетках было показано, что сарилумаб способен блокировать сигнальный путь ИЛ-6, измеряемый по степени подавления STAT-3 белков, только в присутствии ИЛ-6.
Побочные действия
Нарушения со стороны обмена веществ и питания: часто гипертриглицеридемия, гиперхолестеринемия.
Особые указания
В период лечения препаратом следует тщательно контролировать пациентов на предмет развития симптомов и признаков инфекций. Поскольку среди пациентов пожилого возраста частота развития инфекций выше, следует с осторожностью проводить лечение данной категории пациентов.
Препарат не следует применять у пациентов с активным течением инфекционного заболевания, включая локализованные инфекции.
Необходимо оценить соотношение пользы и риска перед началом применения препарата у пациентов:
с хронической или рецидивирующей инфекцией;
с серьезными или оппортунистическими инфекциямив анамнезе;
с сопутствующими заболеваниями, предрасполагающими к развитию инфекций;
после контакта с больными туберкулезом;
проживавших или посещавших регионы, эндемичные по туберкулезу или микозам.
Следует прервать лечение препаратом, если у пациента отмечается развитие серьезной или оппортунистической инфекции.
Пациент, у которого в период лечения препаратом развилась инфекция, должен незамедлительно пройти полное диагностическое обследование, предусмотренное для лиц с ослабленным иммунитетом; затем ему должна быть назначена адекватная антибактериальная терапия с последующим тщательным наблюдением.
У пациентов, получавших иммунодепрессивные препараты для лечения ревматоидного артрита, включая препарат, были зарегистрированы серьезные инфекции, иногда с летальным исходом, вызванные бактериальными, микобактериальными, инвазивными грибковыми, вирусными и другими оппортунистическими патогенами. Наиболее часто наблюдавшимися серьезными инфекциями при применении препарата были пневмония и целлюлит (воспаление подкожной жировой клетчатки). Из оппортунистических инфекций при применении препарата были зарегистрированы туберкулез, кандидоз и пневмоцистоз. В единичных случаях наблюдались диссеминированные, а не локализованные инфекции у пациентов, часто получающих сопутствующую терапию иммунодепрессивными препаратами, такими как метотрексат или глюкокортикостероиды, что в сочетании с ревматоидным артритом, может предрасполагать к развитию инфекции.
Реактивация вирусной инфекции.
При применении иммунодепрессивных биологических препаратов сообщалось о реактивации вирусных инфекций. В клинических исследованиях препарата отмечались случаи опоясывающего герпеса. В клинических исследованиях случаи реактивации вируса гепатита В зарегистрированы не были, однако из исследований были исключены пациенты, имеющие риск реактивации инфекции.
До начала лечения препаратом у пациентов необходимо оценить наличие факторов риска туберкулеза и провести обследование на латентную инфекцию. Пациентам с латентным или активным туберкулезом следует до начала лечения препаратом провести стандартную противотуберкулезную терапию. У пациентов с латентным или активным туберкулезом в анамнезе, у которых невозможно подтвердить, проводился ли необходимый курс терапии, и у пациентов с отрицательным результатом анализа на латентный туберкулез, но имеющих факторы риска развития туберкулезной инфекции, следует рассмотреть возможность проведения противотуберкулезной терапии до начала лечения препаратом. При решении вопроса о проведении противотуберкулезной терапии целесообразно проконсультироваться с фтизиатром.
Следует тщательно контролировать пациентов на предмет развития признаков и симптомов туберкулеза, включая пациентов, чей результат обследования на латентный туберкулез до начала терапии был отрицательным.
Применение при беременности и лактации
Женщины детородного возраста должны использовать эффективные методы контрацепции во время терапии препаратом и в течение 3-х месяцев после ее окончания.
Не следует применять во время беременности, за исключением тех случаев, когда потенциальная польза применения для матери превышает потенциальный риск для плода.
Поскольку IgGl в небольших количествах могут экскретироваться в грудное молоко, следует с учетом пользы грудного вскармливания для ребенка и пользы терапии для женщины принять решение либо о прекращении грудного вскармливания, либо об отмене сарилумаба.
Взаимодействие
Одновременное применение с метотрексатом не влияло на экспозицию сарилумаба. Не ожидается также влияния сарилумаба на экспозицию метотрексата при их одновременном применении, клинические данные отсутствуют.
Следует избегать одновременного применения с биологическими БМАРП.
Взаимодействие с препаратами, являющимися субстратами цитохрома Р450
Различные исследования in vitro и ограниченное количество исследований in vivo на человеке показали, что цитокины и модуляторы цитокинов могут влиять на экспрессию и активность специфических изоферментов цитохрома Р450 (CYP) (CYP1A2, CYP2C19, CYP3A4) и, таким образом, имеют возможность изменять фармакокинетику одновременно принимаемых препаратов, являющихся субстратами для этих изоферментов. Повышение концентрации ИЛ-6 может снижать активность цитохрома Р450 у пациентов с ревматоидным артритом, и, следовательно, повышать у них концентрацию препаратов, являющихся субстратами цитохрома Р450, по сравнению с пациентами без ревматоидного артрита. Блокада сигнального пути ИЛ-6 антагонистами рецепторов ИЛ-6Rα, такими как сарилумаб, может устранить ингибирующее действие ИЛ-6 и восстановить активность цитохрома Р450, приводя к изменению концентрации лекарственных препаратов.
Изменение влияния ИЛ-6 на изоферменты цитохрома Р450 под действием сарилумаба может быть клинически значимо для субстратов цитохрома Р450 с узким терапевтическим диапазоном концентраций, для которых доза корректируется индивидуально. После начала применения или отмены препарата пациентам, получающим лечение лекарственными препаратами, являющимися субстратами цитохрома Р450, следует проводить мониторинг терапевтического эффекта (например, для варфарина) или концентрации лекарственного препарата (например, для теофиллина) и корректировать дозу лекарственного препарата по мере необходимости.
Следует соблюдать осторожность при начале терапии у пациентов, принимающих препараты, которые являются субстратами изофермента ЗА4 цитохрома Р450 (CYP3A4) (например, оральные контрацептивы или статины), так как сарилумаб может устранить ингибирующий эффект ИЛ-6 и восстанавливать активность изофермента CYP3A4, приводя к снижению экспозиции и активности субстратов CYP3A4. Взаимодействие сарилумаба с субстратами других изоферментов CYP (CYPP2C9, CYP2C19, CYP2D6) не изучалось.
Условия хранения
При температуре от 2 °С до 8 °С в оригинальной упаковке для защиты от действия света. Не замораживать.
При извлечении из холодильника препарат должен храниться при температуре не выше 25 °С и быть использован в течение 14 дней.
Хранить в недоступном для детей месте.
Срок годности
Препарат не следует применять по истечении срока годности.
Кевзара препарат для чего назначают
Раствор для подкожного введения прозрачный или опалесцирующий, бесцветный или коричневато-желтого цвета.
| 1 мл | 1 шприц/шприц-ручка | |
| сарилумаб | 131.6 мг | 150 мг |
Раствор для подкожного введения прозрачный или опалесцирующий, бесцветный или коричневато-желтого цвета.
| 1 мл | 1 шприц/шприц-ручка | |
| сарилумаб | 175 мг | 200 мг |
× На каждую пачку картонную нанесен антиконтрафактный стикер.
Фармакологическое действие
В функциональных исследованиях на человеческих клетках было показано, что сарилумаб способен блокировать сигнальный путь ИЛ-6, измеряемый по степени подавления STAT-3 белков, только в присутствии ИЛ-6.
После п/к введения сарилумаба в разовых дозах 150 мг и 200 мг у пациентов с ревматоидным артритом наблюдалось быстрое снижение уровня СРБ. Уровень СРБ снижался до нормальных значений уже через 4 дня после начала лечения. У пациентов с ревматоидным артритом после введения разовой дозы сарилумаба АЧН снижалось до минимального значения в течение 3-4 дней, а затем восстанавливалось до исходного уровня. Лечение сарилумабом приводило к снижению уровня фибриногена и сывороточного амилоида А, а также к повышению уровней гемоглобина и альбумина сыворотки крови.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Кевзара были оценены в трех рандомизированных двойных слепых контролируемых многоцентровых исследованиях.
В исследовании MOBILITY принимали участие 1197 пациентов с ревматоидным артритом с недостаточным клиническим ответом на терапию метотрексатом. Пациенты получали препарат Кевзара в дозах 200 мг, 150 мг или плацебо каждые 2 недели одновременно с метотрексатом. В исследовании TARGET принимали участие 546 пациентов с ревматоидным артритом с недостаточным клиническим ответом на терапию одним или несколькими антагонистами ФНОα или в случае их непереносимости. Пациенты получали препарат Кевзара в дозах 200 мг или 150 мг или плацебо в сочетании с традиционными болезнь-модифицирующими антиревматическими препаратами [тБМАРП] каждые 2 недели.
На 24-й неделе терапии в обоих исследованиях у пациентов, получавших препарат Кевзара в дозе 200 мг или 150 мг в сочетании с тБМАРП 1 раз каждые 2 недели частота ответа ACR20, ACR50 и ACR70 была выше, чем у пациентов, получавших плацебо. В открытой продленной фазе исследования эти результаты сохранялись в течение 3 лет терапии.
В исследовании MOBILITY к 52-й неделе большая часть пациентов, получавших препарат Кевзара в дозе 200 мг или 150 мг 1 раз каждые 2 недели в сочетании с метотрексатом, достигла ремиссии, определяемой по DAS28-CPB Рентгенологический ответ
В исследовании MOBILITY эффективность обеих доз препарата Кевзара в сочетании с метотрексатом превосходила эффективность комбинации плацебо и метотрексата в отношении структурных повреждений суставов, оцениваемых по изменению модифицированного счета Шарпа/ван дер Хейде по сравнению с исходным уровнем через 24 и через 52 недели.
Через 52 недели терапии препаратом Кевзара в дозе 200 мг и в дозе 150 мг в сочетании с метотрексатом было отмечено уменьшение прогрессирования структурных повреждений на 91% и 68% соответственно, по сравнению с комбинацией плацебо и метотрексата.
Изменения функционального статуса
В исследованиях MOBILITY и TARGET к 16-й и 12-й неделе неделе терапии соответственно было продемонстрировано более выраженное улучшение функционального статуса по HAQ-DI в группах препарата Кевзара по сравнению с плацебо, которое сохранялось до 52 недели в исследовании MOBILITY.
Исследование с использованием активного препарата в качестве контроля
Препарат Кевзара в дозе 200 мг превосходил адалимумаб в дозе 40 мг в отношении снижения активности заболевания и улучшения функционального статуса.
Фармакокинетика
В равновесном состоянии концентрация сарилумаба в интервалах между введениями, которая измерялась с помощью AUC, увеличивалась в 2 раза при повышении дозы со 150 мг до 200 мг при введении 1 раз каждые 2 недели. Равновесное состояние достигалось через 12-16 недель с 2-3-кратным накоплением по сравнению с концентрацией после введения разовой дозы. При введении в дозе дозы 150 мг 1 раз каждые 2 недели расчетные средние значения (±стандартное отклонение) в равновесном состоянии AUC, C min и С max сарилумаба составили 210±115 мг×сут/л, 6.95±7.6 мг/л и 20.4±8.27 мг/л соответственно.
При введении в дозе 200 мг 1 раз каждые 2 недели расчетные средние значения (±стандартное отклонение) в равновесном состоянии AUC, C min и С max сарилумаба составили 396±194 мг×сут/л, 16.7±13.5 мг/л и 35.4±13.9 мг/л соответственно.
У пациентов с ревматоидным артритом кажущийся V d в равновесном состоянии составил 8.3 л.
У пациентов с ревматоидным артритом наблюдалась более чем дозозависимое увеличение фармакокинетической экспозиции. В равновесном состоянии концентрация в перерывах между введениями препарата измерялась AUC, которая увеличивалась примерно в 2 раза с повышением дозы в 1.33 раза от 150 до 200 мг при введении препарата 1 раз каждые 2 недели.
Метаболизм сарилумаба не изучен. Предполагается, что сарилумаб, как и другие моноклональные антитела, распадается на небольшие пептиды и аминокислоты через катаболизм таким же образом, как и эндогенный иммуноглобулин (IgG).
Симвастатин является субстратом изофермента CYP3A4 и транспортного белка ОАТР1В1. У 17 пациентов с ревматоидным артритом через неделю после разового п/к введения сарилумаба в дозе 200 мг экспозиция симвастатина и симвастатиновой кислоты уменьшилась на 45% и 36 соответственно.
После достижения равновесного состояния при введении последней дозы сарилумаба 150 мг и 200 мг медиана времени до неопределяемых концентраций, составляет 30 и 49 дней соответственно. Моноклональные антитела не выводятся почками и печенью.
Фармакокинетика у особых групп пациентов
Популяционный анализ фармакокинетики у взрослых пациентов с ревматоидным артритом (возраст от 18 до 88 лет; 14% пациентов в возрасте старше 65 лет) показал, что возраст, пол и этническая принадлежность не оказывают значимого влияния на фармакокинетику сарилумаба. У пациентов с массой тела более 100 кг применение сарилумаба в обеих дозах (150 мг и 200 мг) продемонстрировало эффективность; однако пациенты с массой тела более 100 кг получили большую терапевтическую пользу при применении дозы 200 мг.
Каких-либо официальных исследований влияния почечной недостаточности на фармакокинетику сарилумаба не проводилось. Почечная недостаточность легкой и средней степени тяжести не влияет на фармакокинетику сарилумаба. Пациентам с почечной недостаточностью легкой и средней степени тяжести коррекция дозы не требуется. Применение сарилумаба у пациентов с почечной недостаточностью тяжелой степени не изучалось.
Каких-либо официальных исследований влияния печеночной недостаточности на фармакокинетику сарилумаба не проводилось.
Показания
Препарат Кевзара можно применять в качестве монотерапии при непереносимости метотрексата или при нецелесообразности терапии метотрексатом.
Противопоказания
Ограничения по применению препарата в зависимости от возраста пациента приведены в разделе «Режим дозирования».
Дозировка
Лечение препаратом Кевзара должно назначаться и проводиться под контролем специалистов, имеющих опыт диагностики и лечения ревматоидного артрита.
Рекомендуемая доза препарата Кевзара составляет 200 мг 1 раз каждые 2 недели.
При развитии нейтропении, тромбоцитопении, повышении активности печеночных ферментов рекомендуется уменьшить дозу с 200 мг 1 раз каждые 2 недели до 150 мг 1 раз каждые 2 недели.
При развитии серьезных инфекций следует прекратить лечение препаратом Кевзара до установления контроля над инфекционным процессом.
Не рекомендуется начинать лечение препаратом Кевзара у пациентов со снижением абсолютного числа нейтрофилов (АЧН) менее чем 2×10 9 /л.
Не рекомендуется начинать лечение препаратом Кевзара у пациентов со снижением количества тромбоцитов ниже 150×10 3 /мкл.
Рекомендации по коррекции дозы при развитии нейтропении, тромбоцитопении или при повышении активности печеночных ферментов приведены ниже в таблицах.
Таблица 1. Низкое значение АЧН