кислород плюс вода что получится
Кислород плюс вода что получится
Физические свойства кислорода
Воздух — это сложная смесь около 15 различных газов. Содержание азота в воздухе составляет 78 % от объема воздуха, а кислорода — 21 %. Кроме того, в воздухе содержится небольшое количество аргона (0,9 %), углекислого газа (0,03 %), озона, водяного пара и других газов.
Для живых существ важнейшим компонентом воздуха является кислород, поскольку он поддерживает дыхание и горение.
При обычных условиях кислород — газ без цвета, вкуса и запаха. Толстый слой жидкого кислорода — светло-голубого цвета.
Кислород малорастворим в воде. Плотность газообразного кислорода немного больше плотности воздуха.
Для получения кислорода в лаборатории используют гидроген пероксид H2O2. Гидроген пероксид при обычных условиях разлагается, но очень медленно, даже если его подогреть на горелке. Но если в раствор гидроген пероксида внести щепотку манган(ГУ) оксида, то реакция протекает намного быстрее:
В данной реакции манган(^) оксид играет роль катализатора — вещества, которое изменяет скорость химической реакции, но в ней не расходуется.
♦ Реакция получения кислорода является примером реакции разложения.
Реакции разложения — это реакции, в которых из одного сложного вещества образуется несколько других веществ.
В общем виде уравнение реакции разложения можно записать следующим образом:
Химические свойства кислорода
Кислород — химически очень активное вещество. Он взаимодействует почти со всеми простыми веществами и со многими сложными. Множество реакций взаимодействия веществ с кислородом протекают с выделением теплоты и света, т. е. происходит горение.
При взаимодействии простых веществ с кислородом образуются оксиды:
♦ Во всех этих уравнениях в левой части записаны формулы двух веществ, а в правой части — одного вещества. Такие реакции называют реакциями соединения.
Реакции соединения — это реакции, в которых из двух простых или сложных веществ образуется одно сложное вещество.
В общем виде уравнение реакции соединения можно записать следующим образом:
Некоторые сложные вещества также способны гореть. В таких реакциях в большинстве случаев образуется несколько оксидов — оксидов тех элементов, которые входили в состав сложного вещества:
Физические свойства воды
Формула воды (гидроген оксида) — H2O. При комнатной температуре вода находится в жидком состоянии — это бесцветная жидкость, в толстом слое — бледно-голубая.
При атмосферном давлении и температуре 0 °С вода превращается в лед, а при 100 °С — кипит. Плотность воды — 1 г/см 1 (при 4 °С).
Чистая вода почти не проводит электрический ток и плохо проводит теплоту. Она имеет высокую теплоемкость, т. е. медленно нагревается и медленно остывает.
При замерзании вода расширяется, поскольку плотность льда меньше плотности жидкой воды.
Взаимодействие воды с кислотными и основными оксидами
Все кислотные оксиды (за исключением силиций(^) оксида SiO2) вступают в реакции соединения с водой с образованием кислот:
Поскольку гидраты основных оксидов являются основаниями, то при взаимодействии с водой эти оксиды должны образовывать основания. Но большинство основных оксидов с водой не взаимодействуют.
Обратите внимание! В реакцию с водой вступают только оксиды, гидраты которых являются щелочами, в частности:
1. Охарактеризуйте физические свойства кислорода и воды.
2. Почему лед всегда плавает на поверхности жидкой воды?
3. Какие реакции называют реакциями соединения? разложения?
4. Приведите уравнения реакций, характеризующие химические свойства кислорода.
5. Приведите уравнения реакций взаимодействия воды с кислотными и основными оксидами.
Задания для усвоения материала
1. Какие из данных оксидов взаимодействуют с водой? Составьте соответствующие уравнения реакций. 2 1
Кислород плюс вода что получится
Архив статей > Химия > Совершенно секретно: вода плюс атом кислорода
СОВЕРШЕННО СЕКРЕТНО: ВОДА ПЛЮС АТОМ КИСЛОРОДА
Инженер-капитан II ранга Л. С. ШАПИРО
Химия и Жизнь №1, 1972 г., с. 45-49
Немецкая подводная лодка с парогазотурбинными установками, поднятая англичанами после войны
ВАЛЬТЕРА ОСЕНЯЕТ ИДЕЯ
Вещества, подожженные перекисью, не удавалось погасить песком. Против таких вспышек были бессильны и обычные огнетушители, содержимое которых, как и песок, лишь прекращает доступ кислорода к поверхности горения и тем самым душит пламя. Вещества, подожженные концентрированными растворами Н2О2, подобно пороху, продолжали гореть и под изолирующим слоем песка или пены. И горели до тех пор, пока не расходовалась вся перекись. Значит, кислород выделяется в процессе горения, рассуждал Вальтер, а раз так, концентрированные растворы перекиси водорода можно использовать там, где ощущается дефицит кислорода, например на подводных лодках.
Уже в 1933 году Вальтер самостоятельно предпринял исследование энергетических возможностей растворов Н2O2. Он составил график зависимости основных теплофизических характеристик от концентрации раствора. И вот что выяснил.
Когда свои соображения он довел до высших военных кругов, поступило немедленное распоряжение: засекретить все, что так или иначе связано с перекисью водорода. Отныне в технической документации и переписке фигурировали «аурол», «оксилин», «топливо Т», но не общеизвестная перекись водорода.
КОНСТРУКЦИЯ И НАДЕЖДЫ
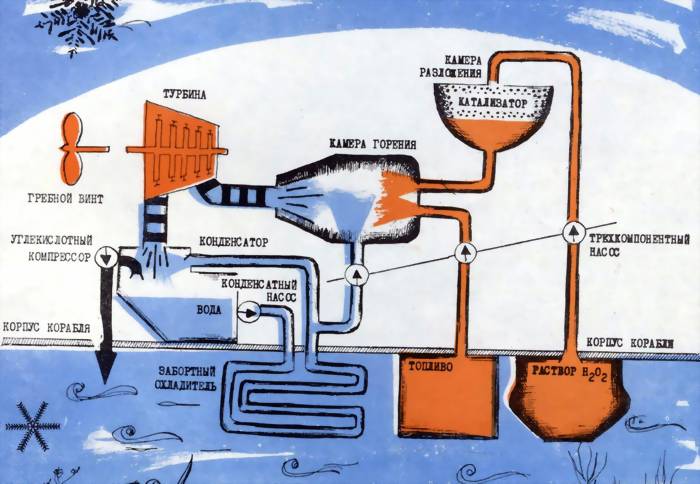
Продукты реакции подавались в турбину, вращали ее, а затем выбрасывались за борт. Так, по «холодному» процессу, работала первая вальтеровская установка. У нее были два очевидных недостатка. Во-первых, кислород слабо растворяется в воде, и лодка с таким двигателем оставляла бы на поверхности пузырьковый след. Во-вторых, выбрасывать за борт неиспользованный кислород, особенно в условиях подводного плавания, было бы непозволительным расточительством. Поэтому логическим продолжением «холодного» процесса стал «горячий».
В продукты разложения подавалось органическое топливо. Сгорая в неиспользовавшемся прежде кислороде, оно поднимало температуру продуктов реакции до 2000°С и выше. В камеру сгорания дополнительно подавали воду, чтобы снизить температуру парогаза до приемлемой для турбин величины (около 500°С). Естественно, мощность двигателя, по сравнению с работавшими по «холодному» процессу, значительно возрастала.
Для подводного флота «горячий» процесс был выгоден еще и потому, что углекислый газ (он теперь занимал место кислорода) значительно лучше растворяется в воде, и лодка теряла «следность».
Еще не имея полноценных боевых подводных лодок с ПГТУ, не имея опыта их боевого использования, гросс-адмирал Дениц вещал: «Придет день, когда я объявлю Черчиллю новую подводную войну. Подводный флот не был сломлен ударами 1943 года. Он стал сильнее, чем прежде. 1944 год будет тяжелым годом, но годом, который принесет большие успехи». Деницу вторил государственный радиокомментатор Фриче. Он был еще откровеннее, обещая нации «тотальную подводную войну с участием совершенно новых подводных лодок, против которых противник будет беспомощен».
Однако успехи Советской Армии диктовали совсем иной ход событий.
Исследования Вальтера не прошли мимо ведомства Геринга. Энергетические установки на перекиси водорода в различных модификациях стали применять на самолетах, а позже и на ракетах Фау-1 и Фау-2. Однако, как и подводные лодки с ПГТУ, они не смогли повлиять на ход войны. Всего немцы успели построить 11 таких подводных лодок. В последние дни рейха все они были взорваны или затоплены.
В дальнейшем ПГТУ не получили распространения в подводном кораблестроении. Успехи атомной энергетики позволили более удачно решить проблему мощных подводных двигателей.
В послевоенные годы перекись водорода продолжала и продолжает приносить пользу людям. Кроме традиционных сфер использования (в качестве дезинфицирующего средства и отбеливателя), для нее нашлись совершенно новые области применения.
Способность этого вещества интенсивно выделять кислород при разложении используется в производстве пористых материалов, в частности резин и легкого бетона. Перекись водорода стали применять как катализатор некоторых технологических процессов. Она повышает скорость образования синтетических каучуков из мономеров, выступая здесь одновременно в качестве инициатора и катализатора полимеризации. В производстве электронной аппаратуры перекись используют для протравки поверхности полупроводниковых германиевых пленок.
В последние годы на перекись вновь обращают внимание как на возможный источник энергии. В ФРГ строят глубоководный исследовательский аппарат «Штинт» («Корюшка»), в котором установят некое подобие ПГТУ. Здесь продукты разложения перекиси будут использоваться для вращения турбогенератора, вырабатывающего энергию, и на нужды исследователей.
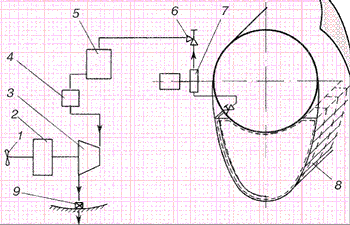
Схема силовой установки подводных лодок с ПГТУ, работающих по «горячему» процессу
ЧТО ВЫ ЗНАЕТЕ И ЧЕГО НЕ ЗНАЕТЕ О ПЕРЕКИСИ ВОДОРОДА
ВПЕРВЫЕ НА ПРАКТИКЕ
ПЕРЕКИСЬ В ПРИРОДЕ
Ученые Кубанского сельскохозяйственного института исследовали, как влияют растворы перекиси водорода на прорастающие семена риса. Рис, как известно, возделывается на затопленных водой полях. Доступ кислорода к семенам и росткам затруднен, а это сказывается на урожае. Решено было компенсировать нехватку кислорода предварительным выдерживанием семян в растворах перекиси водорода. Опыты дали обнадеживающие результаты. Наклюнулись все семена, выдержанные в 1%-ном растворе Н2О2, в то время как из контрольной группы семян, выдержанных в дистиллированной воде, дали ростки лишь две трети. Замачивание семян в перекиси сказалось и на урожае: прибавка составила в среднем около 8 центнеров с гектара.
Перекись водорода использовали в двигателях подводных лодок и ракет, но еще раньше это вещество было взято на вооружение представителями мира насекомых. Жукбомбардир, подвергшись нападению, выбрасывает в сторону противника струйку перекиси водорода, которая вырабатывается в его организме.
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
«Совершенно секретно: вода плюс кислород…» Часть I. Акулы адмирала Деница
Данное исследование автору хотелось бы посвятить одному известному веществу. Веществу, подарившему миру Мэрилин Монро и белые нитки, антисептики и пенообразователи, эпоксидный клей и реагент на определение крови и даже применяемому аквариумистами для освежения воды и чистки аквариума. Речь идет о перекиси водорода, точнее, об одном аспекте ее применения — о ее военной карьере.
Но перед тем, как приступить к основной части, автор хотел бы прояснить два момента. Первое — название статьи. Вариантов было немало, но в конце концов было решено воспользоваться названием одной из публикаций, написанных инженер-капитаном второго ранга Л.С. Шапиро, как наиболее четко отвечающим не только содержанию, но и обстоятельствам, сопровождавшим внедрение перекиси водорода в военную практику.
Второе — почему автора заинтересовало именно это вещество? А точнее — чем именно оно его заинтересовало? Как ни странно, своей совершенно парадоксальной судьбой на военном поприще. Все дело в том, что перекись водорода обладает целым набором качеств, которые, казалось бы, прочили ему блестящую военную карьеру. И с другой стороны, все эти качества оказались совершенно неприменимыми для использования ее в роли военного припаса. Ну, не то чтобы назвать его абсолютно непригодным — наоборот, она использовалась, и достаточно широко. Но с другой стороны, ничего экстраординарного из этих попыток не получилось: перекись водорода не может похвастаться таким внушительным послужным списком, как нитраты или углеводороды. Виной всему оказалась… Впрочем, не будем спешить. Давайте просто рассмотрим некоторые наиболее интересные и драматические моменты военной истории перекиси, а выводы каждый из читателей сделает самостоятельно. А поскольку каждая история имеет свое начало, то познакомимся с обстоятельствами рождения героя повествования.
Открытие профессора Тенара…
За окном стоял ясный морозный декабрьский день 1818 года. Группа студентов-химиков Парижской Политехнической школы торопливо заполняла аудиторию. Желающих пропустить лекцию знаменитого профессора школы и знаменитой Сорбонны (Парижского университета) Жана Луи Тенара не было: каждое его занятие было необычным и волнующим путешествием в мир удивительной науки. И вот, распахнув дверь, в аудиторию легкой пружинистой походкой (дань гасконским предкам) вошел профессор.

— Когда с передней мачты фрегата матрос кричит «Земля!», и капитан впервые видит в подзорную трубу неизвестный берег, это великий момент в жизни мореплавателя. Но разве не столь же велик момент, когда химик впервые обнаруживает на дне колбы частицы нового, доселе никому не известного вещества?
Тенар сошел с кафедры и подошел к демонстрационному столику, на который Лешо уже успел поставить несложный прибор.
— Химия любит простоту, — продолжал Тенар. — Запомните это, господа. Здесь только два стеклянных сосуда, внешний и внутренний. Между ними снег: новое вещество предпочитает появляться при низкой температуре. Во внутренний сосуд налита разбавленная шестипроцентная серная кислота. Сейчас она почти такая же холодная, как и снег. Что же произойдет, если я брошу в кислоту щепотку окиси бария? Серная кислота и окись бария дадут безобидную воду и белый осадок — сернокислый барий. Это всем известно.
— Но теперь попрошу внимания! Мы приближаемся к неизвестным берегам, и сейчас с передней мачты раздастся крик «Земля!» Я бросаю в кислоту не окись, а перекись бария — вещество, которое получается при сжигании бария в избытке кислорода.
В аудитории было так тихо, что отчетливо слышалось тяжелое дыхание простуженного Лешо. Тенар, осторожно помешивая стеклянной палочкой кислоту, медленно, по крупинке, сыпал в сосуд перекись бария.
— Осадок, обычный сернокислый барий, мы отфильтруем, — сказал профессор, сливая воду из внутреннего сосуда в колбу.
— Это вещество похоже на воду, не так ли? Но это странная вода! Я бросаю в нее кусочек обыкновенной ржавчины (Лешо, лучину!), и смотрите, как вспыхивает едва тлеющий огонек. Вода, которая поддерживает горение!
— Это особенная вода. В ней вдвое больше кислорода, чем в обычной. Вода — окись водорода, а эта жидкость — перекись водорода. Но мне нравится другое название — «окисленная вода». И по праву первооткрывателя я предпочитаю это имя.
— Когда мореплаватель открывает неизвестную землю, он уже знает: когда-нибудь на ней вырастут города, будут проложены дороги. Мы, химики, никогда не можем быть уверены в судьбе своих открытий. Что ждет новое вещество через столетие? Быть может, такое же широкое применение, как у серной или соляной кислоты. А может быть, и полное забвение — за ненадобностью.
Но Тенар продолжал:
— И все-таки я уверен в великом будущем «окисленной воды», ведь она содержит большое количество «животворного воздуха» — кислорода. И что самое главное, он очень легко выделяется из такой воды. Уже одно это вселяет уверенность в будущем «окисленной воды». Земледелие и ремесла, медицина и мануфактура, и я даже не знаю еще, где найдет применение «окисленная вода»! То, что сегодня еще умещается в колбе, завтра может властно ворваться в каждый дом.
Профессор Тенар медленно сошел с кафедры.
Наивный парижский мечтатель… Убежденный гуманист, Тенар всегда считал, что наука должна приносить человечеству блага, облегчая жизнь и делая ее легче и счастливее. Даже постоянно имея перед глазами примеры прямо противоположного характера, он свято верил в большое и мирное будущее своего открытия. Иногда начинаешь верить в справедливость высказывания «Счастье — в неведении»…
Впрочем, начало карьеры перекиси водорода было вполне мирным. Она исправно трудилась на текстильных фабриках, отбеливая нитки и полотна; в лабораториях, окисляя органические молекулы и помогая получать новые, несуществующие в природе вещества; начала осваивать медицинские палаты, уверенно зарекомендовав себя в качестве местного антисептика.
Но вскоре выяснились и некоторые отрицательные стороны, одним из которых оказалась низкая устойчивость: существовать она могла только в растворах относительно небольшой концентрации. А как водится, раз концентрация не устраивает, ее надо повысить. И вот с этого и началось…
…и находка инженера Вальтера
1934 год в европейской истории оказался отмечен довольно многими событиями. Некоторые из них взбудоражили сотни тысяч людей, другие прошли тихо и незаметно. К первым, безусловно, можно отнести появление в Германии термина «арийская наука». Что касается второго, то это было внезапное исчезновение из открытой печати всех упоминаний о перекиси водорода. Причины этой странной пропажи стали ясны только после сокрушительного поражения «тысячелетнего Рейха».
Все началось с идеи, пришедшей в голову Гельмуту Вальтеру — владельцу небольшой фабрики в Киле по производству точных инструментов, научно-исследовательской аппаратуры и реактивов для немецких институтов. Человеком он был способным, эрудированным и, что немаловажно, предприимчивым. Он заметил, что концентрированная перекись водорода может довольно долго сохраняться в присутствии даже небольших количеств веществ-стабилизаторов, таких, например, как фосфорная кислота или ее соли. Особенно эффективным стабилизатором оказалась мочевая кислота: для стабилизации 30 л высококонцентрированной перекиси было достаточно 1 г мочевой кислоты. Но внесение других веществ, катализаторов разложения, приводит к бурному разложению вещества с выделением большого количества кислорода. Таким образом, обозначилась заманчивая перспектива регулирования процесса разложения с помощью довольно недорогих и простых химических веществ.
Само по себе все это было известно уже давно, но, кроме этого, Вальтер обратил внимание на другую сторону процесса. Реакция разложения перекиси
процесс экзотермический и сопровождается выделением довольно значительного количества энергии — около 197 кДж тепла. Это очень много, настолько много, что хватит довести до кипения в два с половиной раза больше воды, чем образуется при разложении перекиси. Неудивительно, что вся масса мгновенно превращалась в облако перегретого газа. А ведь это готовый парогаз — рабочее тело турбин. Если эту перегретую смесь направить на лопатки, то получим двигатель, который сможет работать где угодно, даже там, где хронически не хватает воздуха. Например, в подводной лодке…
Киль был форпостом германского подводного кораблестроения, и идея подводного двигателя на перекиси водорода захватила Вальтера. Она привлекала своей новизной, и к тому же инженер Вальтер был далеко не бессребреником. Он отлично понимал, что в условиях фашистской диктатуры кратчайший путь к благоденствию — работа на военные ведомства.
Вальтер сумел увидеть абсолютно новую область применения вещества, известного больше ста лет. И изучил это вещество с точки зрения намеченного применения. Когда свои соображения он довел до высших военных кругов, поступило немедленное распоряжение: засекретить все, что так или иначе связано с перекисью водорода. Отныне в технической документации и переписке фигурировали «аурол», «оксилин», «топливо Т», но не общеизвестная перекись водорода.
В 1936 году Вальтер представил руководству подводного флота первую установку, которая работала на указанном принципе, который, не смотря на довольно высокую температуру, получил название «холодного». Компактная и легкая турбина развила на стенде мощность 4000 л.с., полностью оправдав ожидания конструктора.
Продукты реакции разложения высококонцентрированного раствора перекиси водорода подавались в турбину, вращавшую через понижающий редуктор гребной винт, а затем отводились за борт.
Несмотря на очевидную простоту такого решения, возникли попутные проблемы (а куда же без них-то!). Например, обнаружилось, что пыль, ржавчина, щелочи и другие примеси тоже являются катализаторами и резко (и что гораздо хуже — непредсказуемо) ускоряют разложение перекиси, чем создают опасность взрыва. Поэтому для хранения раствора перекиси применили эластичные емкости из синтетического материала. Такие емкости планировалось размещать вне прочного корпуса, что позволяло рационально использовать свободные объемы межкорпусного пространства и, кроме того, создавать подпор раствора перекиси перед насосом установки за счет давления забортной воды.
Но другая проблема оказалась значительно сложнее. Кислород, содержавшийся в отработанном газе, довольно плохо растворяется в воде, и предательски выдавал местоположение лодки, оставляя на поверхности след из пузырьков. И это при том, что «бесполезный» газ является жизненно необходимым веществом для корабля, призванного находиться на глубине как можно большее время.
Идея использования кислорода, как источника окисления топлива, была настолько очевидна, что Вальтер занялся параллельным проектированием двигателя, работавшего по «горячему циклу». В этом варианте в камеру разложения подавалось органическое топливо, которое сгорало в ранее неиспользовавшемся кислороде. Мощность установки резко возрастала и, кроме того, уменьшалась следность, так как продукт горения — углекислый газ — значительно лучше кислорода растворяется в воде.
Вальтер отдавал себе отчет в недостатках «холодного» процесса, но мирился с ними, так как понимал, что в конструктивном отношении такая энергетическая установка будет несоизмеримо проще, чем при «горячем» цикле, а значит, можно гораздо быстрее построить лодку и продемонстрировать ее достоинства.
В 1937 году Вальтер доложил результаты своих опытов руководству германских ВМС и заверил всех в возможности создания подводных лодок с парогазовыми турбинными установками с невиданной доселе скоростью подводного хода более 20 узлов. В результате совещания было принято решение о создании опытной подлодки. В процессе ее проектирования решались вопросы, связанные не только с применением необычной энергетической установки.
Так, проектная скорость подводного хода делала неприемлемыми ранее применявшиеся обводы корпуса. Здесь морякам помогли авиастроители: несколько моделей корпуса испытали в аэродинамической трубе. Кроме того, для улучшения управляемости применили сдвоенные рули по образцу рулей самолета «Юнкерс-52».
В 1938 году в Киле заложили первую в мире опытную подводную лодку с энергетической установкой на перекиси водорода водоизмещением 80 т, получившую обозначение V-80. Проведенные в 1940 году испытания буквально ошеломили — относительно простая и легкая турбина мощностью 2000 л.с. позволила подлодке развить под водой скорость 28,1 узла! Правда, расплачиваться за такую невиданную скорость пришлось ничтожной дальностью плавания: запасов перекиси водорода хватало на полтора-два часа.
Лодка V-300 (или U-791 — такое литерно-цифровое обозначение она получила) имела две двигательные установки (точнее, три): газовую турбину Вальтера, дизеля и электромоторы. Такой необычный гибрид появился как результат понимания того, что турбина, по сути, является форсажным двигателем. Высокий расход компонентов топлива делал ее просто неэкономичной для совершения длительных «холостых» переходов или тихого «подкрадывания» к судам противника. Но она была просто незаменима для быстрого ухода с позиции атаки, смены места атаки или других ситуаций, когда «пахло жаренным».
U-791 так и не достроили, а сразу заложили четыре опытно-боевые подводные лодки двух серий — Wa-201 (Wa — Вальтер) и Wk-202 (Wk — Вальтер—Крупп) различных судостроительных фирм. По своим энергетическим установкам они были идентичны, но отличались кормовым оперением и некоторыми элементами обводов рубки и корпуса. С 1943 г. начались их испытания, которые проходили тяжело, но к концу 1944г. все основные технические проблемы были позади. В частности, U-792 (серия Wa-201) прошла испытания на полную дальность плавания, когда, имея запас перекиси водорода 40 т, она почти четыре с половиной часа шла под форсажной турбиной и четыре часа поддерживала скорость 19,5 узла.
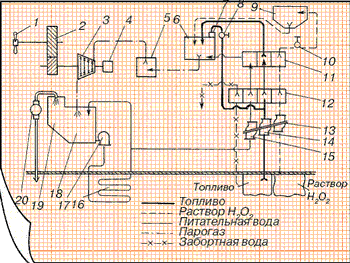
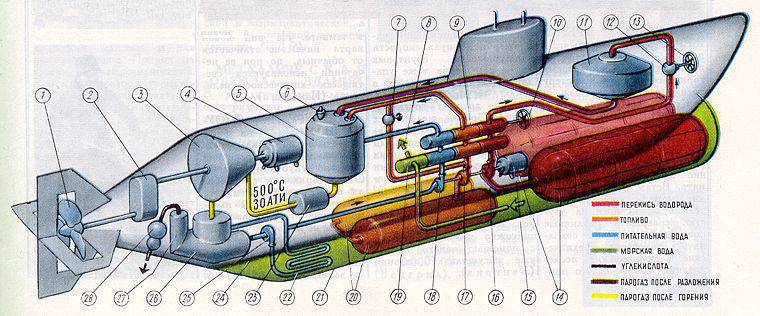
Вкратце работа ПГТУ выглядит таким образом [10]. С помощью насоса тройного действия осуществлялась подача дизельного топлива, перекиси водорода и чистой воды через 4-позиционный регулятор подачи смеси в камеру сгорания; при работе насоса на 24000 об./мин. подача смеси достигала следующих объемов: топливо — 1,845 куб.м/час, перекись водорода — 9,5 куб.м/час, вода — 15,85 куб.м/час. Дозирование трех указанных компонентов смеси производилось с помощью 4-позиционного регулятора подачи смеси в весовом соотношении 1:9:10, который также регулировал и 4-й компонент — морскую воду, компенсирующую различие веса перекиси водорода и воды в регулирующих камерах. Регулирующие элементы 4-позиционного регулятора приводились в действие электродвигателем мощностью 0,5 л.с. и обеспечивали требуемый расход смеси.
После 4-позиционного регулятора перекись водорода поступала в камеру каталитического разложения через отверстия в крышке этого устройства; на сите которого находился катализатор — керамические кубики или трубчатые гранулы длиной около 1 см, пропитанные раствором перманганата кальция. Парогаз нагревался до температуры 485 градусов по Цельсию; 1 кг элементов катализатора пропускал до 720 кг перекиси водорода в час при давлении 30 атмосфер.
После камеры разложения он поступал в камеру сгорания высокого давления, изготовленную из прочной закаленной стали. Входными каналами служили шесть форсунок, боковые отверстия которых служили для прохода парогаза, а центральное — для топлива. Температура в верхней части камеры достигала 2000 градусов по Цельсию, а в нижней части камеры снижалась до 550-600 градусов за счет впрыскивания в камеру сгорания чистой воды. Полученные газы подавались на турбину, после которой отработанная парогазовая смесь поступала в конденсатор, установленный на корпусе турбины. С помощью системы водяного охлаждения температура смеси на выходе опускалась до 95 градусов по Цельсию, конденсат собирался в резервуаре для конденсата и с помощью насоса для отбора конденсата поступал в холодильники морской воды, использующих для охлаждения проточную морскую воду при движении лодки в подводном положении. В результате прохождения по холодильникам температура полученной воды снижалась с 95 до 35 градусов по Цельсию, и она возвращалась по трубопроводу как чистая вода для камеры сгорания. Остатки парогазовой смеси в виде углекислого газа и пара под давлением 6 атмосфер отбирались из резервуара для конденсата газовым сепаратором и удалялись за борт. Углекислый газ относительно быстро растворялся в морской воде, не оставляя заметного следа на поверхности воды.
Как видно, даже в таком популярном изложении ПГТУ не выглядит простым устройством, что требовало привлечения для ее строительства высококвалифицированных инженеров и рабочих. Строительство подводных лодок с ПГТУ велось в обстановке абсолютной секретности. На корабли допускали строго ограниченный круг лиц по спискам, согласованным в высших инстанциях вермахта. На контрольно-пропускных пунктах стояли жандармы, переодетые в форму пожарных. Параллельно наращивались производственные мощности. Если в 1939 году Германия производила 6800 тонн перекиси водорода (в пересчете на 80%-ный раствор), то в 1944 — уже 24 000 тонн, и строились дополнительные мощности на 90000 тонн в год.
Еще не имея полноценных боевых подводных лодок с ПГТУ, не имея опыта их боевого использования, гросс-адмирал Дениц вещал:
Деницу вторил государственный радиокомментатор Фриче. Он был еще откровеннее, обещая нации «тотальную подводную войну с участием совершенно новых подводных лодок, против которых противник будет беспомощен».
Интересно, вспоминал ли Карл Дениц эти свои громкие обещания в течении тех 10 лет, которые ему пришлось коротать в тюрьме Шпандау по приговору Нюренбергского трибунала?
Нацистское наследие в Англии…
Немецкая U-1407 была эскортирована в Англию немецким же экипажем, который предупредили о смертной каре в случае каких-либо диверсий. Туда же доставили Гельмута Вальтера. Восстановленная U-1407 была зачислена в состав ВМС под именем «Метеорит». Прослужила она до 1949 г, после чего была выведена из состава флота и в 1950 разобрана на металл.
Позднее, в 1954-55 гг. англичане построили две однотипные опытовые ПЛ «Эксплорер» и «Экскалибур» собственной конструкции. Впрочем, изменения касались только внешнего облика и внутренней компоновки, что же касается ПГТУ, то она осталась практически в первозданном виде.
Обе лодки так и не стали прародителями чего-то нового в английском флоте. Единственное достижение — полученные на испытаниях «Эксплорера» 25 узлов подводного хода, что дало англичанам повод раструбит на весь мир о своем приоритете на этот мировой рекорд. Цена же этого рекорда тоже была рекордной: постоянные отказы, проблемы, пожары, взрывы приводили к тому, что большую часть времени они проводили в доках и мастерских в ремонте, чем в походах и испытаниях. И это не считая чисто финансовой стороны: один ходовой час «Эксплорера» обходился в 5000 фунтов стерлингов, что по курсу того времени равно 12,5 кг золота. Исключены они были из состава флота в 1962 («Эксплорер») и в 1965 («Экскалибур») годах с убийственной характеристикой одного из британских подводников: «Лучшее, что можно сделать с перекисью водорода — это заинтересовать ею потенциальных противников!»
…и в СССР]
Советскому Союзу, в отличие от союзников, лодки серии XXVI не достались, как не досталась и техническая документация по этим разработкам: «союзнички» остались верными себе, в который раз скрысятничав лакомый кусочек. Но информация, и довольно обширная, об этих неудавшихся новинках Гитлера в СССР имелась. Поскольку русские и советские химики всегда шли в авангарде мировой химической науки, решение об исследовании возможностей столь интересного двигателя на чисто химической основе было принято быстро. Органам разведки удалось найти и собрать группу немецких специалистов, ранее работавших в этой области и выразивших желание продолжить их на бывшего противника. В частности, такое желание высказал один из заместителей Гельмута Вальтера некий Франц Статецки. Статецки и группа «технической разведки» по вывозу из Германии военных технологий под руководством адмирала Л.А. Коршунова, нашли в Германии фирму «Брюнер-Канис-Рейдер», которая была смежником в изготовлении турбинных установок Вальтера.

Задачей бюро было изучение и воспроизводство достижений немцев по новым подводным лодкам (дизельным, электрическим, парогазотурбинным), но основной задачей было повторение скоростей немецких подводных лодок с циклом Вальтера.
В результате проведённых работ удалось полностью восстановить документацию, изготовить (частично из немецких, частично из вновь изготовленных узлов) и испытать парогазотурбинную установку немецких лодок серии XXVI.
После этого было решено строить советскую подлодку с двигателем Вальтера. Тема разработки подлодок с ПГТУ Вальтера получила название проект 617.
Александр Тыклин, описывая биографию Антипина, писал:
При проектировании С-99 (такой номер получила эта лодка) был учтен и советский, и иностранный опыт создания единых двигателей. Предэскизный проект закончили в конце 1947 года. Лодка имела 6 отсеков, турбина находилась в герметичном и необитаемом 5-м отсеке, пульт управления ПГТУ, дизель-генератор и вспомогательные механизмы смонтировали в 4-м, который имел и специальные окна для наблюдения за турбиной. Горючее составляло 103 т перекиси водорода, дизтоплива — 88,5 т и специального топлива для турбины — 13,9 т. Все компоненты находились в специальных мешках и цистернах вне прочного корпуса. Новинкой в отличие от германских и английских разработок было применение в качестве катализатора не перманганата калия (кальция), а оксида марганца MnO2. Будучи твердым веществом, он легко наносился на решетки и сетки, не терялся в процессе работы, занимал значительно меньше места, чем растворы и не разлагался со временем. В всем остальном ПГТУ была копией вальтеровского двигателя.
С-99 считалась опытовой с самого начала. На ней отрабатывалось решение вопросов, связанных с большой подводной скоростью: форма корпуса, управляемость, устойчивость движения. Данные, накопленные при ее эксплуатации, позволили рационально проектировать атомоходы первого поколения.
В 1956 ‒ 1958 годах были спроектированы большие лодки проект 643 с надводным водоизмещением в 1865 т и уже с двумя ПГТУ, которые должны были обеспечить лодке подводную скорость в 22 узла. Однако в связи с созданием эскизного проекта первых советских подлодок с атомными силовыми установками проект был закрыт. Но исследования ПГТУ лодки С-99 не прекратились, а были переведены в русло рассмотрения возможности применения двигателя Вальтера в разрабатываемой гигантской торпеде Т-15 с атомным зарядом, предложенной Сахаровым для уничтожения военно-морских баз и портов США. Т-15 должна была иметь длину в 24 м, дальность подводного хода до 40-50 миль, и нести термоядерную боеголовку, способную вызывать искусственное цунами для уничтожения прибрежных городов США. К счастью, и от этого проекта тоже отказались.
В дальнейшем ПГТУ не получили распространения в подводном кораблестроении ни в СССР, ни за рубежом. Успехи атомной энергетики позволили более удачно решить проблему мощных подводных двигателей, не требующих кислорода.