клещ дерматофаг мучной что это
Клещ мучной
Мучной клещ
Acarus siro
Мучной клещ – микроскопическое членистоногое, опасный вредитель зерна и зернопродуктов, в цикле развития может иметь покоящийся и активный гипопусы.
Наиболее широко распространенный синантропный вид из акариформных клещей. [1]
Присутствие мучных клещей в муке и зерне в складах представляет собою явление вообще не редкое. Иногда клещей бывает так много, что мука, в которой они находятся, представляется местами как бы движущейся. [5]
Нажмите на фотографию для увеличения
Морфология
Имаго. Наблюдается половой диморфизм. Самка овальная 0,35-0,67 мм длины, почти бесцветная, слегка беловатая; гнатосома и ноги по цвету варьируют от бледно-желтого до красновато-коричневого. Самцы мельче (0,32-0,43 мм длины); передняя пара ног утолщена, с крупным коническим зубцом на нижней стороне бедер. [1]
Тело у обоих полов мучного клеща (особенно у самки) к заднему концу округлено; между второй и третьей парой ног проходит поперечная перетяжка. Все четыре пары ножек почти равной длины. Первая пара ног самца заметно утолщена; на втором членике их находится зубцеобразный отросток; у самки подобного отростка нет; нет его также и у других видов клещей этого семейства.
Самка мучного клеща отличается от схожих с нею видов волосками на заднем конце тела: они сравнительно коротки и малочисленны. У обоих полов окраска чуть дымчатая или бесцветная; концы ножек и ротовые органы, вытянутые в виде хоботка, буроватые. У самца снизу, на брюшке, близ заднего конца тела имеются две круглые присоски. [8]
Присоски имеются и на лапках последней пары ног, причем они отстоят одна от другой на расстоянии, равном их диаметру, и расположены ближе к основанию, чем к вершине сегмента. [1]
Яйца белые, овальные, 0,12 мм длины.
Личинка имеет более округлое тело и три пары ног.
Нимфы по форме тела приближаются к взрослым, восьминогие.
При неблагоприятных условиях мучной клещ образует неподвижный или чаще подвижный гипопус. [6]
Активный гипопус по длине тела варьирует от 0,15 до 0,22 мм длины, розовато-коричневый, верх тела умеренно выпуклый, покрыт разбросанными ямками, низ – слегка вогнутый. Щиток проподосомы отчетливо отделен от гистеросомального и выступает вперед, почти полностью прикрывая гнатосому. Тазиковые (коксальные) присоски отсутствуют; генитальные в виде небольшого присасывательного диска расположены между генитальным отверстием и задним концом тела. Большие центральные присоски на диске окружены обычно тремя парами периферических присосок.
Покоящейся гипопус несколько крупнее (0,20-0,25 мм), беловатый, округлоовальной формы со слегка остроконечным передним концом тела. Спинная поверхность сильно выпуклая и почти гладкая, брюшная вогнутая. Гнатосома редуцирована и представлена лишь парой тупых бородавочек. Присасывательный диск не развит; имеется лишь пара присосок. Ноги короткие и толстые. Лишь четыре последних членика первой и три членика второй пары ног выдаются за края тела; две последние пары ног полностью спрятаны под телом. [1]
Фенология развития (в сутках)
Развитие
Имаго. Взрослые клещи в день своего выхода из стадии нимфы или на другой день спариваются. Спаривание продолжается несколько часов, при этом наблюдается так называемая «брачная прогулка»: более крупная и сильная самка влечет за собою самца, идущего задним ходом.
Через 2-3 дня после оплодотворения самка начинает откладывать яички, разбрасывая их непосредственно на продукты по 3-4 штуки в день. [8]
Яйцо. Всего самка откладывает в зависимости от условий среды от 20 до 150 яиц. Продолжительность развития зависит от температуры. [2]
Инкубационный период яйца продолжается 3-4 дня, после чего из яичка вылупляется личинка. Последняя от взрослого клеща отличается тем, что имеет вместо четырех пар ног только три пары.
Личинка. Вылупившееся из яичек личинки вскоре принимаются жадно поедать пищу. Растут они очень быстро и через три дня уже впадают в неподвижное состояние, длящееся 1-2 дня; затем кожа личинки разрывается вдоль спины и из нее выходит молодая нимфа.
Нимфа. Стадия продолжается 6-7 дней, из которых два последних дня она проводит в неподвижном состоянии. По окончании указанного срока кожа у нимфы разрывается так же, как и у личинки, вдоль спины, и из нее выходит вторая нимфа, так же, как это наблюдается у остальных видов. [8]
При неблагоприятных условиях мучной клещ образует неподвижный или чаще подвижный гипопус.
Передвигается мучной клещ со скоростью 1,2 см в минуту.
Оптимальная температура для жизнедеятельности мучного клеща лежит в пределах 21-27°С, оптимальная относительная влажность воздуха 80%, минимальная 65%. Клещи не могут развиваться в зерне влажностью 13% и ниже. [2]
Географическая распространенность
Распространен мучной клещ по всему миру. [8]
О рекомендациях как бороться с клещами домашней пыли
Роспотребнадзор напоминает, что большое значение для развития у людей различных аллергических состояний, имеют бытовые аллергены, в частности, домашняя пыль. Органической составляющей домашней пыли являются кожные чешуйки, перхоть человека и домашних животных, шерсть, волосы, пыльца и зерна растений, хлопковые волокна, частицы пищи, линочные шкурки, экскременты клещей и насекомых. Все эти компоненты служат субстратом для развития грибов, бактерий, членистоногих, в том числе клещей. Главным продуценторм аллергенов домашней пыли являются клещи сем. Pyroglyphidae, или клещи домашней пыли, составляющие ядро акарокомплекса в жилых помещениях — до 98% по численности. Впервые роль клещей как продуцентов аллергенов в жилище человека была показана в 1964 году, когда в пыли обнаружили клещей семейства Pyroglyphidae (Dermatophagoides pteronyssinus) и доказали, что они представляют опасность для лиц с генетической предрасположенностью к атопии (аллергическим реакциям, обусловленным иммуноглобулином Е), поскольку создают сильный аллергизирующий фон в жилище человека. Это открытие послужило началом широкомасштабных исследований пироглифид во всем мире.
Предполагается, что пироглифиды, исходно заселяя гнезда синантропных птиц (ласточек, воробьев), могли перейти к жизни в гнездах домашней птицы, а оттуда вместе с перьевыми и пуховыми постельными принадлежностями проникли в жилище человека и, найдя там благоприятные условия, остались.
Проблема аллергии в течение последних десятилетий становится все более актуальной: по данным ВОЗ, с 2001 по 2010 год число аллергиков в мире увеличилось на 20%. Доля школьников, реагирующих на один или несколько распространённых аллергенов, достигла 40%-50%. Клиническими проявлениями аллергии могут быть аллергический ринит, атопический дерматит (синдром аллергической экземы и дерматита), атопическая бронхиальная астма. Аллергический ринит встречается у 10%- 30% взрослого населения и у 40% детей. 400 миллионов человек в мире страдают от атопического ринита и 300 миллионов от астмы. По данным ВОЗ от бронхиальной астмы ежегодно умирают 250 тыс. человек. Из всех атопических больных 60-70% сенсибилизированы к клещам домашней пыли, т.е. отвечают аллергическими реакциями при контакте с клещевыми аллергенами.
Аллергенными для человека являются живые и мертвые клещи, продукты их жизнедеятельности. Большая часть аллергенов клещей домашней пыли (главным образом, пищеварительных ферментов клещей) содержится в их экскрементах (фекальных шариках размером 10-40 мкн), которые легко поднимаются в воздух и оседают на слизистых оболочках дыхательных путей человека.
В жилище человека клещей можно обнаружит в пыли, собранной с постели, пола около кровати, на мягкой мебели, коврах и т.д. Однако основным местом обитания для клещей домашней пыли служит постель, где их численность может достигать максимально 30 000 экз. на 1 г пыли. Известно, что во время пребывания человека в постели в ней создаются микроклиматические условия, оптимальные для клещей: температура повышается на 8,4°С по сравнению с комнатной, в то время как влажность увеличивается на 2-8%. Кроме того, известно, что в течение недели с человека слущивается в среднем 5 г, а в день — от 0,7 до 1,4 г чешуек эпидермиса. При этом 180 мг чешуек вполне достаточно, чтобы поддержать развитие культуры D. pteronyssinus до 1000 экз. в течение 2—3 месяцев. Плотность популяций клещей, заселяющих матрас, неодинакова. Клещи концентрируются в местах, которые могут служить для них укрытиями и в которых скапливается пищевой субстрат для клещей (слущивающиеся чешуйки эпидермиса человека) — в швах, строчках, петлях, пуговицах. Наибольшая численность клещей отмечена в изголовье кровати, поскольку там скапливается больше всего кожных чешуек. Помимо этого, клещей обнаруживают на шерстяных и стеганых ватных одеялах, мягких игрушках, постоянно находящихся на постелях детей, в перьевых подушках. Некоторыми авторами показано, что численность клещей в подушках и одеялах может быть даже выше, чем в матрасе.
Клещи встречаются как в жилых квартирах, так и в общественных помещениях: гостиницах, общежитиях и в других местах, где складываются благоприятные для клещей микроклиматические условия и имеется пищевой субстрат. Их можно обнаружить также на матрасах в поездах дальнего следования и на одежде.
Профилактика и снижение численности клещей домашней пыли в жилых помещениях
Одна из главных задач профилактики и лечения аллергических заболеваний – снижение численности пироглифидных клещей в домах больных, чувствительных к клещевым аллергенам. Особенно важно уничтожить клещей в жилых помещениях для детей, поскольку контакт с клещевыми аллергенами в раннем детском возрасте провоцирует дальнейшее развитие чувствительности к этим аллергенам.
Для снижения численности клещей создают неблагоприятные для них условия за счет соблюдения ряда профилактических мер и регулярного проведения санитарно-гигиенических мероприятий, дополненных при необходимости элиминацией клещей в окружении больного при помощи акарицидов.
К профилактическим мерам относятся:
• удаление всех ворсистых поверхностей, на которых может скапливаться пыль в доме (ковры, паласы, пледы, мягкие игрушки и т.д.);
• замена перьевых, шерстяных, ватных подушек, одеял, матрасов и на таковые с синтетическим наполнителем;
• отсутствие в квартире домашних животных (кошек и собак), поскольку эпидермис животных не только может быть сильным аллергеном, но также является дополнительным источником пищи для клещей;
• использование специальных чехлов на матрасы и подушки, предотвращающие их заселение клещами домашней пыли;
• смена постельного белья не реже 1 раза в неделю, не рекомендуется сдавать его в прачечную;
• стирка постельных принадлежностей (подушки одеяла, покрывала), мягких игрушек – 1 раз в месяц при температуре воды не ниже 60°С;
• обработка матрасов и мягкой мебели парогенератором;
• просушивание на солнце не подлежащих стирке постельных принадлежностей (не менее 4 часов) или промораживание их (при температуре не выше 18 градусов в течение не менее 2 часов);
• уборка помещения (не реже 2 раз в неделю) при помощи пылесоса (обязательно с HEPA-фильтром), пылесосить необходимо тщательно, затрачивая 1,5-2 мин на 0,5 м2 поверхности, после каждого использования менять (или стирать) пылесборник.
• сохранение в комнате, где спит больной с атопией, относительной влажности воздуха 30-50%, используя для этих целей обогревательные приборы, климатические установки;
• снижение концентрации аллергенов в воздухе помещений с помощью воздухоочистительных приборов с HEPA-фильтром;
• использование средств с акарицидной активностью по показаниям и под контролем врача-аллерголога; обработка акарицидными средствами предметов, где концентрируются клещи — матрас, постельные принадлежности, мягкую мебель, — ковры только в отсутствие больных с атопией, строго следуя инструкции по применению препарата.
Средства для борьбы с клещами домашней пыли
В качестве средств борьбы с клещами домашней пыли в мировой практике медицинской дезинсекции применяется ограниченное число акарицидов. Они должны иметь минимальное аллергизирующее действие, низкую токсичность в отношении человека, высокую эффективность в отношении клещей домашней пыли, удобную для применения препаративную форму.
Среди них наиболее широко применяются препараты на основе бензилбензоата – бензилового эфира бензойной кислоты. Их используют для уничтожения клещей в основных биотопах, которые они заселяют в жилых помещениях – в постельных принадлежностях больного, мягкой мебели и т.д., а также во время стирки белья, не подлежащего кипячению.
Для контроля численности клещей домашней пыли в России зарегистрированы и разрешены препараты преимущественно в аэрозольной упаковке или беспропеллентной аэрозольной упаковке на основе бензилбензоата, пиретроидов (перметрин, эсбиотрин) и масла нима.
Химические средства для борьбы с клещами домашней пыли целесообразно использовать в первую очередь в общественных помещениях — гостиницах, пунктах приема белья в прачечных и т.п., где численность клещей домашней пыли часто достигает очень высокого уровня.
Важно помнить, что применение акарицидных средств в жилых помещениях связано с внесением туда дополнительного аллергеннного фактора, что может привести к ухудшению состояния аллергических больных. Так, у пациентов, которые страдают аллергией на сложноцветные, может развиваться перекрестная аллергическая реакция на питретрины (эфиры хризантемовой кислоты, выделенные из далматской ромашки) и их синтетические аналоги – пиретроиды. В жилых помещениях внесение новых химических веществ может привести к ухудшению здоровья атопического больного, поэтому обработку постельных принадлежностей, мягкой мебели и др. мест обитания клещей необходимо проводить в отсутствии больного и желательно под наблюдением врача.*
*Материал подготовлен на основе информации, предоставленной НИИ Дезинфектологии Роспотребнадзора
Клещ дерматофаг мучной что это
Клещи домашней пыли (HDM, Dermatophagoides sp.) являются одним из самых распространенных источников воздушных аллергенов во всем мире, сенсибилизация HDM затрагивает от 1 % до 2 % населения мира, что эквивалентно 65–130 миллионам человек [1]. С XVII в. известно, что вдыхание домашней пыли может вызвать астму и ринит. Однако только в 1964 г. группа, работающая с Рейндертом Воорхорстом и супружеской парой Фрица Т. Спиксма и Марис И. Спиксма-Боземан, продемонстрировала, что наличие HDM в образцах пыли вызвало симптомы астмы [2]. Экспериментальные доказательства указывают на то, что HDM-специфические Th2-клетки играют центральную роль в аллергическом воспалительном ответе, продуцируя IL-4, IL-5, IL-13: IL-4 важен для аллергической сенсибилизации и продукции IgE; IL-5 обеспечивает выживаемость эозинофилов; IL-13 обусловливает плейотропные эффекты в легких [3].
Цель обзора: предоставить основные данные по содержанию аллергенов в экстракте клещей домашней пыли (HDM, Dermatophagoides sp.), описать возможные микробные компоненты, участвующие в индуцированной HDM поляризации T-клеток по Th2 типу.
Классификация аллергенов HMD по группам [3]
MD-2-подобный липид-связывающий белок
Трипсин-подобная сериновая протеаза
Хемотрипсин-подобная сериновая протеаза
Коллагенолитическая сериновая протеаза
Клещи домашней пыли относятся к семейству Pyroglyphidae, подклассу Acari, классу Arachid, роду Anthropods. Наиболее распространенными видами являются Dermatophagoides pteronyssinus и Dermatophagoides farinae. Существуют три вида экскреторных выделений клещей: личиночные шкурки, секрет латеральных желез и экскременты (фекальные шарики) [4]. Кроме идентифицированных HDM-аллергенов фекалии клеща содержат белковые и небелковые соединения, которые могут участвовать в активации врожденного иммунитета.
HDM рассматривается не только как носитель аллергена, а также как важный транспортер микробных PAMPs (консервативных молекулярных структур (паттернов), ассоциированных со специфическим патогеном), способных вызывать реакции врожденного иммунитета. Домашняя пыль, естественная среда обитания клещей, содержит большое количество ЛПС (липополисахарид, эндотоксин) и/или бактерий, а также β-глюканов и/или грибов, которые могут быть связаны с аллергенами HDM [5, 6]. Хитин, полимер из звеньев β-(1-4)-поли-N-ацетил-D-глюкозамина, входящий в состав экзоскелета клещей и обнаруженный в их фекалиях, поляризует иммунные ответы по типу Th1, Th2 и Th17 [7]. Было показано, что введение хитина in vivo в мышей рекрутирует IL-4-позитивные врожденные иммунные клетки, включая эозинофилы и базофилы [8]. Остальные примеси экстракта, такие как флагеллин и β-глюканы, активируют TLR5 и TLR2 соответственно [9]. Найденная в экстрактах клещей бактериальная рибосомальная РНК свидетельствует о наличии эндосимбионтов [10].
Аллергены HDM были классифицированы в соответствии с системой номенклатуры Линнея, которая поддерживается Всемирной организацией здравоохранения (ВОЗ) и Подкомитетом по номенклатуре Международного союза иммунологических обществ (IUIS). HDM-аллергены называются Der (первые три буквы рода Dermatophagoides), p или f (первая буква вида pteronyssinus или farinae) и число, представляющее порядок, в котором они были очищены или классифицированы [11]. Аллергены D. pteronyssinus и D. farinae гомологичны, имеют аналогичные биологические активности, среди них выделяют четыре класса соединений: протеазы; белки, имеющие сродство к липидам; непротеолитические ферменты и неферментативные компоненты (таблица).
Приблизительно 80–90 % всех людей, страдающих аллергией на клещей, реагируют с частично выраженными аллергическими симптомами на аллергены основных групп – 1 и 2. Der p 23, впервые идентифицированный в 2013 г., также классифицируется как основной аллерген, поскольку он также имеет большое клиническое значение (уровень сенсибилизации около 70 %). Специфичные для Der p 23 уровни IgE у тестируемых пациентов были сопоставимы с уровнями IgE с Der p 1 и Der p 2. Der p 1 и Der p 2 быстро элюируются из фекальных гранул в водных растворах, тогда как Der р 23 элюируется медленно и в меньших количествах [12]. Возможно, что Der p 23 способен напрямую активировать врожденную иммунную систему [13].
Белки первой группы рассматриваются как папаин-подобные цистеиновые протеазы; 3, 6 и 9 группы представляют собой трипсин-подобные, хемотрипсин-подобные и коллагенолитические сериновые протеазы соответственно. Эти протеазы, скорее всего, участвуют в пищеварении клеща, поскольку они были обнаружены в клетках отделенных от стенки кишечника и в фекалиях [14]. Однако в отличие от белков первой группы они играют незначительную роль в связывании с IgE. Протеазы D. pteronissinus активируют эозинофилы и бронхиальные эпителиальные клетки, инициируют высвобождение воспалительных медиаторов тучных клеток [15].
Группы 5, 7 и 21 могут связывать липиды, гликопротеины и гликолипиды для взаимодействия с врожденной иммунной системой и влиять на доставку антигена [16]. Аллергены этих групп выявляются примерно у 30 % пациентов с аллергией на клещей домашней пыли и связаны с началом аллергической астмы [2]. Исследование структуры димеризованного Der p 5 показало наличие большого гидрофобного кармана, который может представлять собой сайт для связывания гидрофобных лигандов, позволяющий, подобно 2-й группе аллергенов HDM, транспортировать PAMPs липидной природы [17]. Der p 5 также стимулирует продукцию IL-6 и IL-8 в эпителиальных клетках дыхательных путей человека [18]. Аллергены группы 7 обладают сходной структурой с ЛПС-связывающим белком (LBP) [19, 20]. В отличие от белков группы 2 они не связывают ЛПС, но могут взаимодействовать с другими лигандами, обеспечивая активацию TLR 2-4 [21].
Согласно структурным гомологиям последовательностей аллергены групп 2, 13 и 14 могут быть отнесены к белкам, связывающим жирные кислоты и липиды [21]. Der p 2 демонстрирует структурную гомологию с корецептором TLR4 MD-2 (11 % идентичности, 29 % сходства), известным также как лимфоцитарный антиген 96 (LY96) [22, 23]. Однако наибольшее сходство последовательностей и трехмерных структур Der p 2 имеет с NPC2 (Niemann-Picktype C2 proteins, белки Нимана – Пика типа С2) – 23,5 % идентичности, 44 % сходства. При помощи анализов связывания липидов и масс-спектрометрии было выяснено, что Der p 2, а также его гомолог Der f 2, аналогично NPC2 связывают холестерин. Аллергены группы 13 связываются с жирными кислотами и другими липидами, такими как эйкозаноиды и ретиноиды. Аллергены HDM 14 группы гомологичны семейству липид-транспортирующих белков LLTP (large lipid transfer protein), включающему аполипофорные или вителлогенин-подобные белки, которые, как предполагается, обладают функциями накопления и транспорта энергии [23].
Другие аллергены HDM проявляют ферментативную активность: группы 4, 8 и 20 – представляют собой амилазы, глутатион-S-трансферазы и аргинин-киназы соответственно, тогда как группы 12, 15 и 18 демонстрируют гомологию с хитиназами [3].
Белки тропомиозина и парамиозина составляют группы 10 и 11 соответственно. Тропомиозин Der p 10 также является второстепенным аллергеном, однако из-за высокой гомологии последовательности с другими тропомиозинами он является важным перекрестным аллергеном к продуктам животного происхождения и иногда связан с тяжелыми реакциями [2]. Der p 11, парамиозин клеща, играет вторичную роль у пациентов с респираторной формой аллергии на HDM, являясь основным аллергеном у пациентов с атопическим дерматитом. Аналогично Der p 14 и Der p 18, тропомиозин и парамиозин клеща не встречаются в фекалиях, что указывает на сенсибилизацию к этим аллергенам при контакте тела клеща с кожей. Было обнаружено, что контакт с кожей может вызывать аллергическую сенсибилизацию и даже может усиливать последующую респираторную аллергию на тот же антиген [24]. Группы 16 и 17 были идентифицированы как гельсолин-подобные и EF- Ca2+ связывающие белки [3].
Исследования подтвердили важность Толл-подобных рецепторов (TLR) в развитии аллергии на клещей домашней пыли [25]. Совместная активация клеток экстрактом из HDM и эндотоксином может стимулировать TLR4-зависимое аллергическое воспаление дыхательных путей при очень низких уровнях ЛПС. Гомология Der p 2 и MD-2 обусловливает активацию TLR4-сигнального пути на клетках бронхиального эпителия через прямое взаимодействие с Der p 2 в отсутствии связывания ЛПС с MD-2 [16]. Модель сенсибилизации дыхательных путей Der p 2+ЛПС вызывала аллергическую астму у мышей дикого типа и MD-2-дефицитных, но не TLR4-дефицитных, что явно подтверждает, что Der p 2 может переносить ЛПС на TLR4. Аллергенность белков 2-й группы является следствием аутоадъювантных свойств, что было подтверждено связыванием Der f 2 и ЛПС (афинность Der p 2 к ЛПС ниже, чем Der f 2) [26]. Der p 2 индуцирует аллергическую астму прямым связыванием с TLR4 или связыванием с TLR4 после взаимодействия с ЛПС [27]. Th2-смещенный ответ на Der p 2 при подкожном введении не зависит от функционального TLR4 (который, возможно, имеет защитную функцию против кожных аллергенов) [28].
Из-за наличия гидрофобного кармана в структуре белков-аллергенов HDM 2-й группы кроме ЛПС с ними также могут связываться другие липидные соединения, которые потенциально могут активировать гетеродимеры TLR1/TLR2 и TLR2/TLR6, проявляющие сродство к бактериальным липопептидам/липопротеинам. Рекомбинантный Der p 2 способен стимулировать гладкомышечные клетки дыхательных путей TLR4-независимым способом, через TLR2 по MyD88-зависимому сигнальному пути. [29]. Это указывает на то, что гидрофобный карман Der p 2 может транспортировать липиды, отличные от ЛПС, являющиеся лигандами TLR2. Der p 2 также способствует активации В-клеток человека через индукцию TLR4/MD-2 и NF-κB-зависимый синтез IL-1β, CXCL10, IL-8 и TNF-α [30]. In vitro показано, что Der p 2 взаимодействует с TLR4 при участии положительно заряженных аминокислотных остатков, индуцирует секрецию IL-6, IL-8 и MCP-1 в нормальных и аллергических лимфоцитах. Секретируемые в ответ на Der p 2 цитокины подавляют спонтанный апоптоз нейтрофилов [31], передача сигнала осуществляется при участии TLR4, Lyn, PI3K, Akt, ERK и NF-κB [32, 33].
Экстракт клещей D. pteronyssinus (DpE) стимулирует продукцию IL-4 и IL-13 в чувствительных к клещам базофилах при астме [34]. Показано, что DpE повышает экспрессию мРНК и секрецию белков MCP-1, IL-6 и IL-8 без участия протеаз, входящих в состав экстракта; в регуляции экспрессии MCP-1, IL-6 и IL-8 участвуют тирозинкиназа Src-семейства PKC δ и ERK, тогда как p38 MAPK участвует в регуляции экспрессии MCP-1 и IL-6 [35]. Следует отметить, что состав коммерческих экстрактов аллергенов из клещей домашней пыли может в значительной степени изменяться в зависимости от способа их подготовки, что приводит к их отличиям по ряду характеристик: содержание эндотоксина; различные количества основных групп аллергенов (Der p 1, Der p 2); отсутствие некоторых групп [14, 36]. Параллельно с исследованиями на экстрактах осуществляется изучение биологической активности рекомбинантных белков клеща (преимущественно исследуются белки 1, 2, 3, 6, 9 группы) [37].
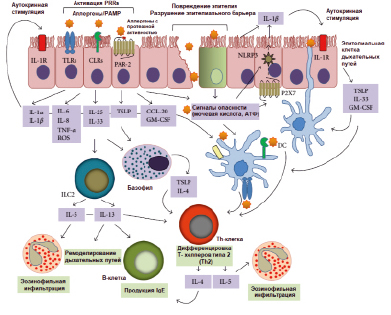
Упрощенная модель иммунной активации при аллергии HDM представлена на рисунке.
Упрощенная модель HDM-индуцированной иммунной активации, приводящей к аллергической астме [Jacquet A., 2013 (с изменениями)]
Джекет предложил заменить классификацию аллергенов согласно их способности стимулировать врожденные иммунные реакции. В таком контексте две группы аллергенов играют решающую роль в HDM-индуцированном врожденном иммунитете: протеазы (группы 1, 3, 6 и 9), которые непосредственно вызывают передачу сигналов через протеолитические атаки и липидсвязывающие белки (группы 2, 5, 7, 13, 14 и 21), которые могут переносить PAMPs на основе микробных липидов. Однако не выяснено, обладают ли липидсвязывающие белки собственной аллергенностью или их способность активировать клетки обусловлена связанными с ними липидами [3].
Клещей домашней пыли следует рассматривать как организм, несущий как собственные аллергены с характерными свойствами, так и содержащий эндосимбиотические и/или загрязняющие микробные компоненты. Собственные аллергены представлены двумя основными группами: белки пищеварительного тракта, выделяющиеся в окружающую среду в составе фекальных шариков, и структурные белки клеща. Фекальные шарики имеют диаметр 10–40 мкм и поэтому могут откладываться не только на слизистой оболочке верхних дыхательных путей, но и попадать в легкие. Следует отметить, что микробные соединения, обнаруженные в клещах домашней пыли, в значительной степени участвуют в индуцированной HDM Th2-поляризации посредством активации PRRs (рецепторов, распознающих молекулярные паттерны). В связи с этим необходимо уделять внимание идентификации микробных соединений, присутствующих в экстрактах или среде. Подробное изучение рецепторов и сигнальных путей, вовлеченных в аллергический ответ, позволит разработать более эффективное лечение для пациентов с аллергией на клещей домашней пыли.