клеточный состав без атипии что это значит
Атипичные клетки – это рак или нет?
Атипичные клетки – это такие клетки, которые под воздействием различных неблагоприятных факторов из обычной нормальной клетки человеческого организма преобразовались в нехарактерную структуру, изменили свой размер и форму. Организм в свою очередь теряет контроль над такими клетками, поэтому существует риск перерождения атипических клеток, что может привести к образованию рака.
Что может повлиять на образование атипичных клеток:
Это некоторые факторы, которые могут привести к образованию атипичных клеток. К сожалению, точной причины их возникновения сказать никто не может. Даже какой-то незначительный сбой в организме может привести к возникновению не одной и даже не двух таких клеток, а тысяч.
Как происходит перерождение атипичных клеток в рак
Давно известно, что образование клеток с измененной ДНК появляются постоянно. Но появление атипичных клеток не всегда приводят к раку. В нашем организме есть защитный механизм, процесс старение и уничтожение клеток, так называемый апоптоз. Он отвечает за то, чтобы аномальные клетки исчезали из организма. Но любая система может дать сбой, и в результате атипичные клетки затаятся в организме. При таком раскладе есть вероятность их перерождения в раковые клетки.
Что делать, если обнаружили атипичные клетки во время биопсии? Рак это или нет?
В такой ситуации лучше перестраховаться, чем что-то пропустить. Ведь ранняя диагностика рака может спасти вам жизнь.
Иногда врач назначает какое-то конкретное лечение, чтобы постараться остановить образование атипичных клеток. Либо может понадобиться еще один образец ткани – дополнительная биопсия, чтобы быть уверенным в отсутствии рака или какого-то другого заболевания.
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
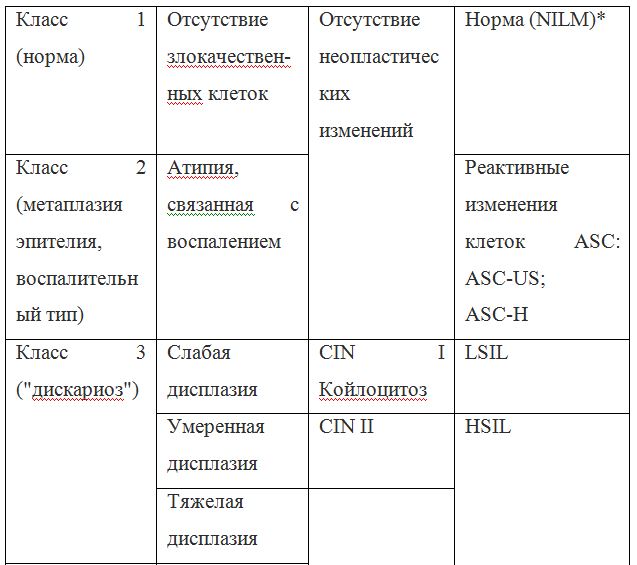
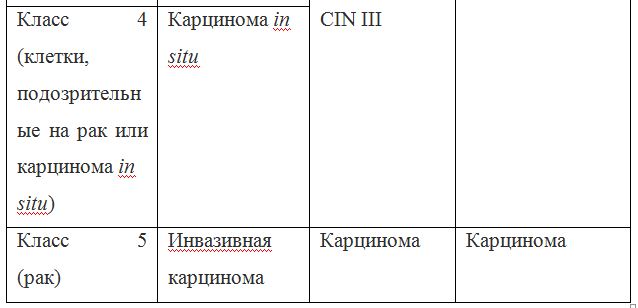
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Цитология шейки матки
Хоперская Ольга Викторовна
Акушер-гинеколог кандидат медицинских наук
Подписаться на email-рассылку
Спасибо за подписку!
Запись на онлайн-консультацию
Ваша заявка будет обработана в течение часа. С Вами свяжется специалист колцентра клиники и согласует время онлайн консультации
Что такое цитология шейки матки? Как осуществляется взятие мазка на цитологическое исследование? Как правильно расшифровать результаты анализа? Что такое nilm,ASC-US, LSIL, HSIL, CIS, AGC, AIS в результатах цитологии? На эти и другие вопросы отвечает кандидат медицинских наук акушер-гинеколог Хоперская Ольга Викторовна.
Цитологическое исследование (цитология) является основным методом скрининговой оценки состояния эпителия шейки матки. Основная задача цитологического скрининга заключается в поиске измененных эпителиальных клеток (атипичных, имеющих отличное от нормальных эпителиальных клеток строение).
Термин «атипичные клетки» подразумевает как клетки с признаками дисплазии – легкой, умеренной или тяжелой (предраковые клетки), так и собственно раковые клетки. Разница между ними – в степени выраженности изменений в строении клеток.
Цитологический скрининг необходимо выполнять всем женщинам (исключая девственниц и пациенток, перенесших экстирпацию (удаление) матки), начиная с 21 года, заканчивая в 69 лет (при отсутствии в исследованиях изменений), регулярность сдачи анализа – 1 раз в год, согласно приказу 572н (1 ноября 2012), однако допустимо сдавать анализ 1 раз в три года (приказ МЗРФ №36 ан, от 3 февраля 2015).
В настоящее время существует две альтернативных методики фиксации и исследования биологического материала, ключевым отличием которых для пациентов является их эффективность.
ПАП-тест и жидкостная цитология
Забор материала осуществляется однотипно (стандартизированный забор): комбинированной щеткой или двумя цитологическими щеточками (рисунок 1), так как эпителий должен быть взят как с наружной вагинальной поверхности шейки матки (эктоцервикса), так и с внутренней – из цервикального канала (эндоцервикса). Необходимость забора клеточного материала из цервикального канала обусловлена тем, что зона стыка эпителиев (цилиндрического и многослойного плоского неороговевающего –места, где чаще всего начинаются «нехорошие» процессы (90-96%случаев)) с возрастом смещается ближе к центру и внутрь цервикального канала.
Рисунок 1 – Цитологические щетки (слева – комбинированная, справа – 2 цитологические щетки)
Рекомендуют осуществлять забор цитологического материала до бимануального (двуручного) вагинального обследования, кольпоскопии и ультразвукового исследования. Не следует сдавать мазки при наличии вагинита (воспалительного процесса во влагалище), в период его лечения, во время менструации. Также за двое суток необходимо половое воздержание.
Техника забора биоматериала:
Отличия ПАП-теста и жидкостной цитологии
В 99% случаев результат, полученный при использовании жидкостной цитологии, совпадает с результатами гистологического исследования.
Единственный недостаток метода – он не включен в систему обязательного медицинского страхования, т. е. анализ платный.
Результаты цитологии шейки матки
Согласно действующим клиническим рекомендациям от 2017 года, расшифровка результатов анализа должна проводиться по системе Бетесда, хотя можно встретить цитологическое заключение по системам Папаниколау, ВОЗ и CIN (гистологическая классификация). Сравнение систем приведено в таблице 1.
Клиническое значение будут иметь состояния определенные по терминологической системе Бетесда, поэтому, к примеру, умеренная дисплазия, тяжелая дисплазия и карцинома in situ = CIN II и CIN III = HSIL, и тактика ведения всех перечисленных состояний многослойного плоского эпителия будет одинакова (категория HSIL).
Расшифровка результатов
Итак, Вы держите в руках онкоцитологическое заключение. Расшифровка результата, а также выбор тактики ведения на его основании (с учетом возраста и особенностей образа жизни), должны проводиться не Вами, а Вашим лечащим врачом! Именно он направляет Вас на необходимые дополнительные исследования и выбирает тактику лечения, в случае необходимости. Но, кто из нас не заглянет в интернет, чтобы посмотреть, что же все-таки обозначают вынесенные в цитологическом заключении аббревиатуры и к чему готовиться? Думаю, любой переживающий о своем здоровье человек.
Ниже рассмотрим расшифровку аббревиатур терминологической системы Бетесда с ориентировочной (согласно действующим клиническим рекомендациям (2017) тактикой ведения.
Если изменены клетки плоского эпителия:
ASC-US
ASC-Н (atypical squamous cells, cannot exclude HSIL, клетки плоского эпителия с атипией неясного значения не исключающие HSIL) – здесь также обнаружены измененные клетки, но вероятная причина их появления – дисплазия. Врач назначит Вам и кольпоскопию с биопсией и ВПЧ – тестирование, дальнейшая тактика будет определена в зависимости от полученных результатов.
HSIL (high grade squamous intraepitelial lesion, плоскоклеточное интраэпителиальное поражение высокой степени) – в мазке обнаружены атипичные клетки, соответствующие диспластическим изменениям тяжелой степени. Врач направит Вас на кольпоскопическое исследование и эксцизию (иссечение участка измененной ткани петлей) / конизацию (удаление конусовидного участка шейки матки включая влагалищную поверхность и нижнюю часть цервикального канала) с последующим гистологическим исследованием полученного биоматериала. К категории HSIL по классификации Бетесда относится и карцинома in situ (см. таблицу 1, описательная система ВОЗ).
Однако цитологическое исследование не дает представления о пространственном расположении клеток с признаками атипии, установить глубину проникновения патологического процесса в ткани позволяет только гистологическое исследование.
Если изменены клетки цилиндрического эпителия:
Вышеприведенные тактики ведения в зависимости от результатов цитологических исследований ориентировочны. Тактику ведения в каждом конкретном случае определяет лечащий врач, учитывая индивидуальные характеристики пациента (возраст, наличие или отсутствие детей, сопутствующие заболевания, факт инфицирования ВПЧ, личные качества).
Дорогие девушки, женщины, призываю Вас регулярно проводить цитологическое исследование и желаю получать исключительно «NILM» в заключении.
Онкологические аспекты гиперпластических процессов эндометрия
Гиперплазия — это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия — одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
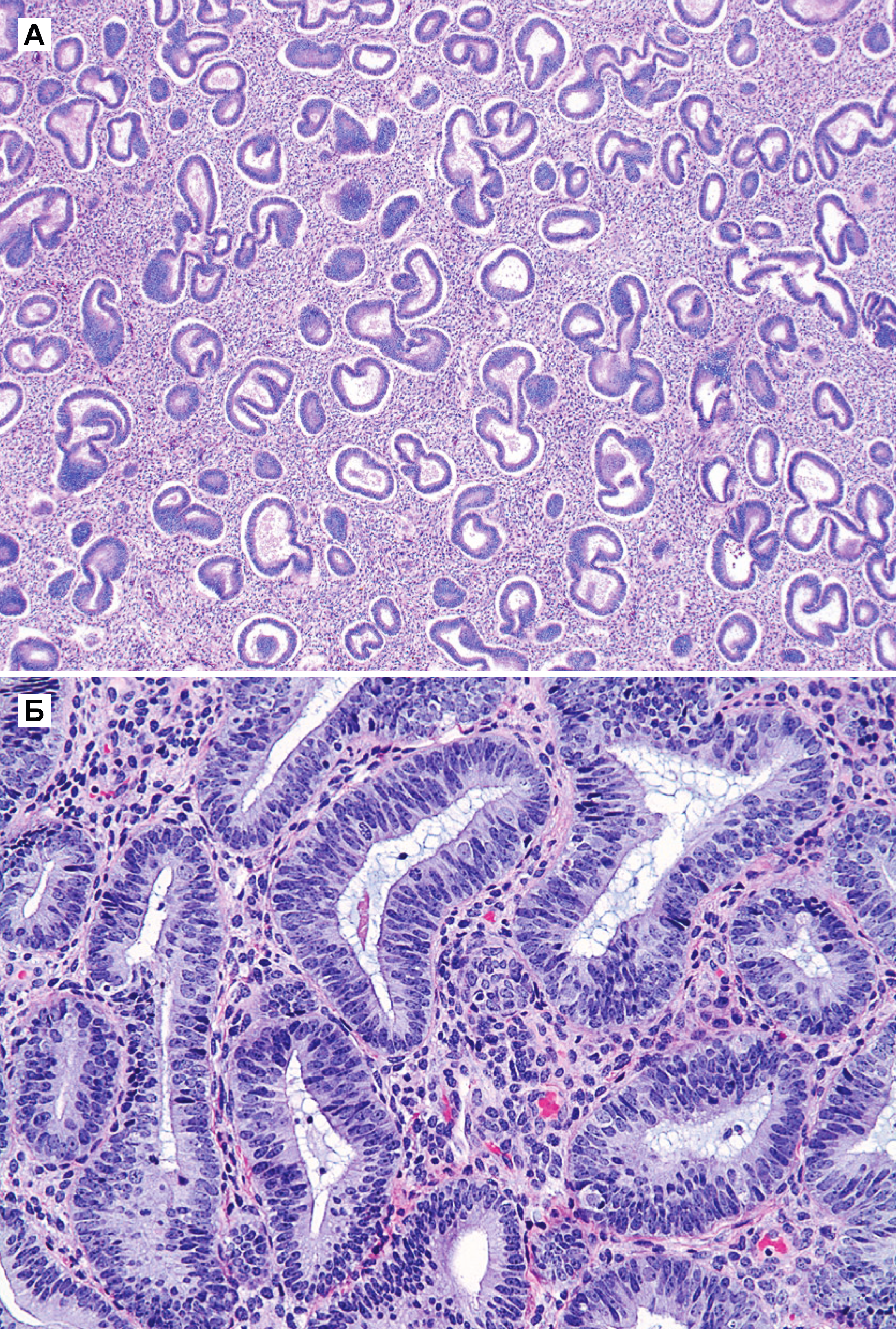
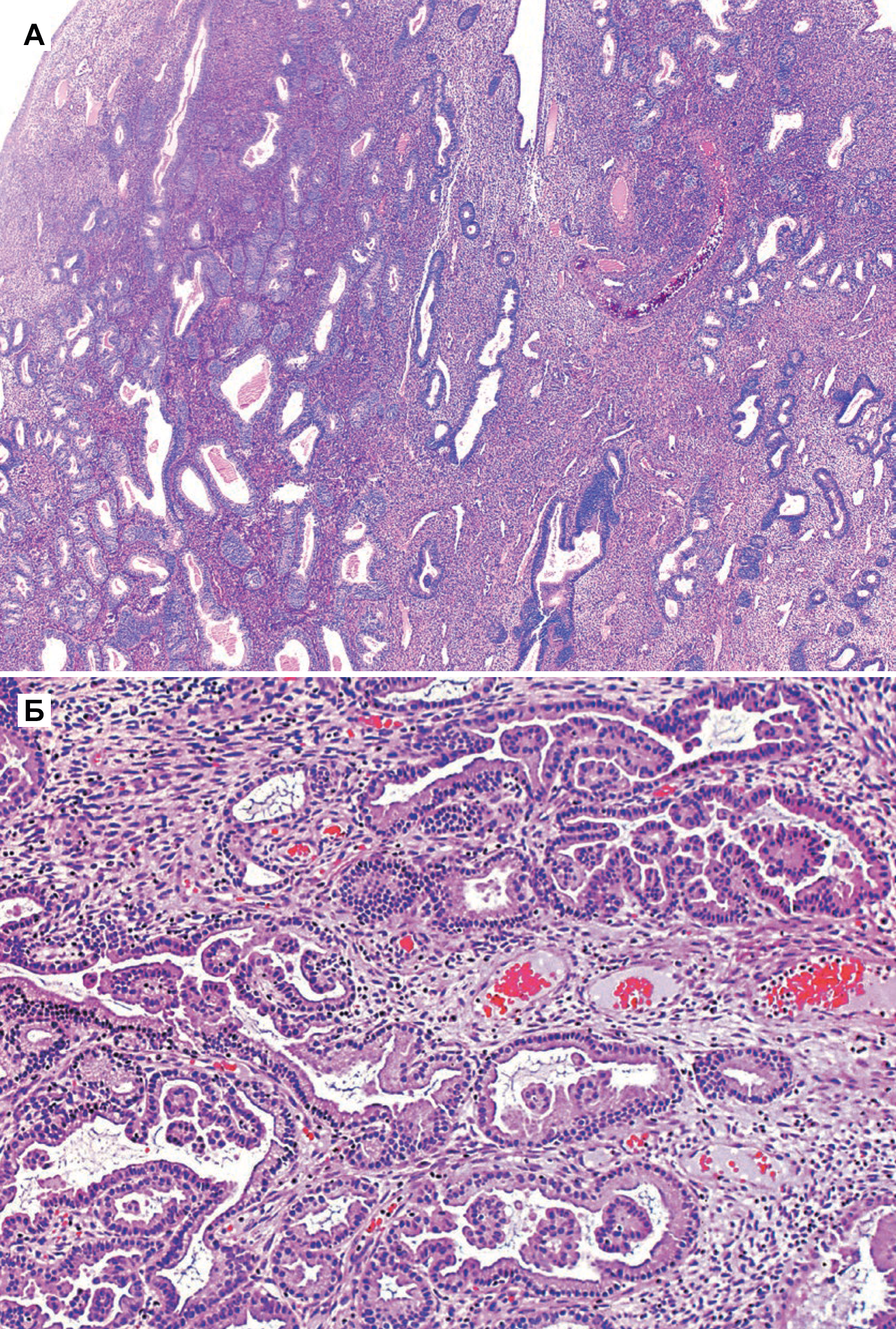
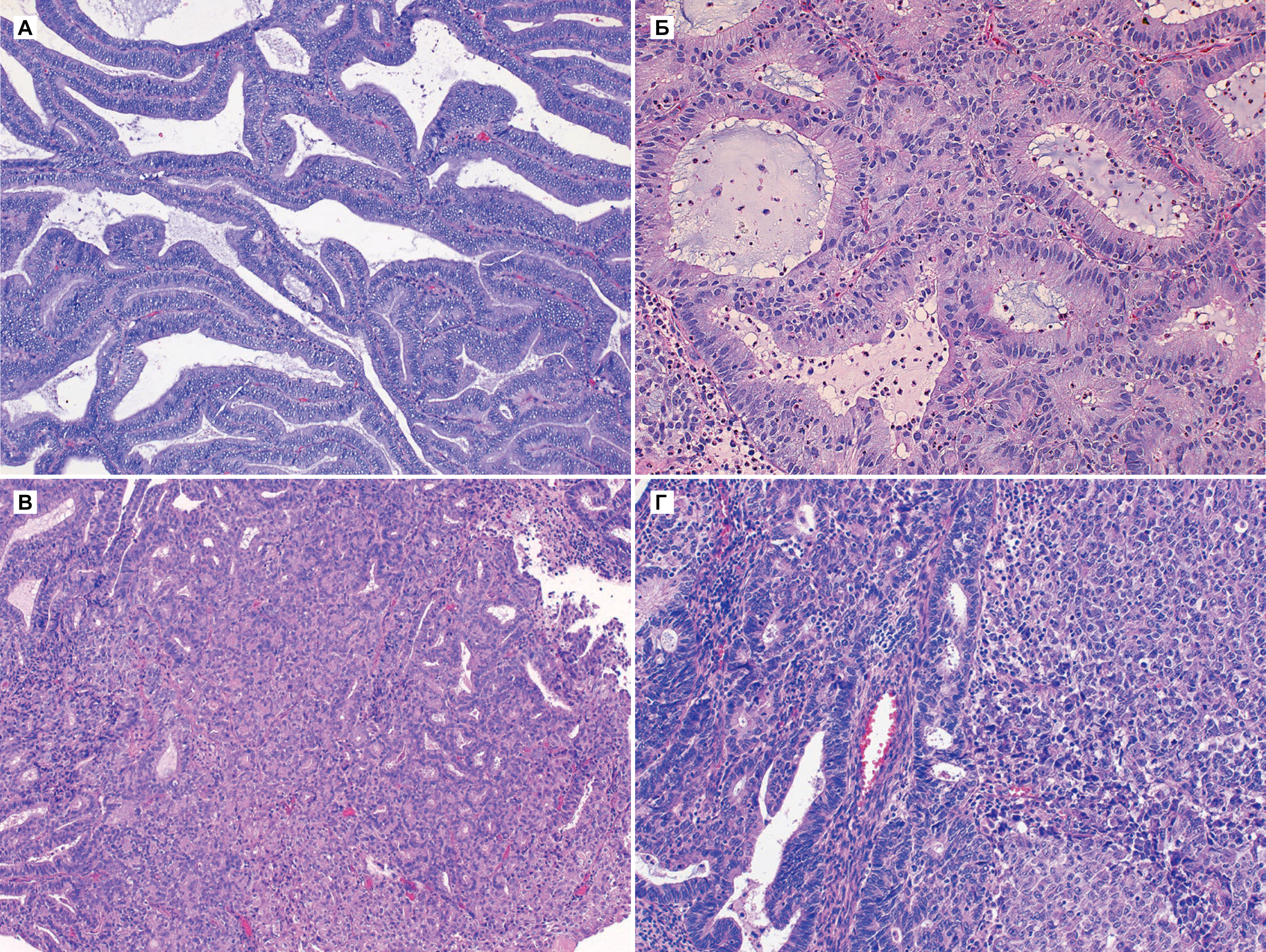
Гиперплазия эндометрия без атипии — это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации — это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].
К предраковым заболеваниям эндометрия относятся [2]:
Эндометрий — мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2–4 слоя), и потеря ориентирования к базальной мембране [5].
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) — это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
РТМ — самая частая злокачественная опухоль женских половых органов в развитых странах и вторая по частоте после рака шейки матки злокачественная опухоль женских половых органов в мире. В США в 2015 г. зарегистрировано более 54800 новых случаев заболевания РТМ, и более 10150 смертей от этого заболевания. В России ежегодно регистрируется более 21 тысячи больных РТМ. В структуре заболеваемости женского населения в России в 2016 г. РТМ занимал 3-е ранговое место (7,7 %). Средний возраст заболевших РТМ в России составляет 62,6 года [3,4].
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 — высоко дифференцированная;
G2 — умеренно дифференцированная;
G3 — низко дифференцированная или недифференцированная.
Клиника
Ранний симптом прогрессирования рака эндометрия — появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки — гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Список литературы:
Предраковые поражения и опухоли щитовидной железы
Рак щитовидной железы считается очень серьезной и тяжелой болезнью, которая может привести к летальному исходу. Чаще всего он выявляется у людей в возрасте старше сорока лет, но в последнее время заболевание особенно «помолодело». Рак является серьезной патологией щитовидной железы, поэтому в последнее время постоянно оказывается в фокусе внимания онкологов и эндокринологов. Более, чем в 30 % случаев, рак щитовидной железы преодолевает пределы данного органа, и появляются отдаленные метастазы. Чтобы избежать риск заболеть раков щитовидной железы, необходимо вовремя отследить предраковую стадию. Важно понимать, что опухоли щитовидной железы — самые внешне благополучные и «коварные» заболевания. В 10% случаев после операции в гистологическом материале находят признаки злокачественной опухоли, в связи с чем возникает необходимость в проведении повторной расширенной операции с удалением прилежащих лимфатических узлов.
Сегодня предраковые изменения щитовидной железы определяются в 15-20% случаев при иммуногистохимическом изучении послеоперационного материала. Если высокодифференцированные опухолевые образования своевременно выявить и начать качественное хирургическое лечение, можно забыть о данном заболевании.
Предраковые заболевания щитовидной железы представлены третьей степенью дисплазии, которую сложно отличить от рака. Это можно сделать только после получения иммуногистохимических анализов, определяющих наличие онкомаркеров. Для этого проводится пункционная тонкоигольная биопсия узлов щитовидной железы.
Предраковые заболевания щитовидной железы представлены узловым и эндемическим зобом, доброкачественным новообразованием — аденомой, кистой. Стоит отметить наличие наследственной предрасположенности к заболеваниям, в том числе и злокачественным.
Атипия щитовидной железы при эндемическом зобе
Эндемический зоб считается предраковым заболеванием щитовидной железы, возникающим по причине воздействия внешних факторов и требующим постоянного контроля. Именно данная патология опасна по вероятности озлокачествления. В регионах, относящихся к эндемическим по зобу, зафиксировано значительное число случаев рака щитовидной железы. Внешние факторы, повышающие риск формирования предракового состояния в рак щитовидной железы обусловлены радиационным воздействием, несбалансированным питанием, вредом от бытовой химии. Например, после аварии на Чернобыльской АЭС произошло увеличение частоты заболеваемости раком щитовидной железы.
Атипия щитовидной железы при узловатом зобе
Диагностика рака щитовидной железы чаще всего происходит у пациентов с узловатыми формами зоба. Если фиксируют резкий и значительный рост узла, надо серьезно отнестись к этому. Это может быть свидетельством перехода в злокачественную форму заболевания.
Атипия щитовидной железы при кисте и аденоме
Под кистой понимается образование, возникшее в щитовидной железе и достигающее в размерах более 15 миллиметров. Кисту, саму по себе, нельзя относить к причинам рака, так как к нему приводят причины, из-за которых образовалась киста. Согласно статистике, озлокачествление кист приходится только на 10 % всех случаев.
Аденома считается зрелой, доброкачественной опухолью щитовидной железы. Сложно прощупать переход доброкачественного поражения в злокачественное, в связи с чем стараются удалить аденому хирургическим путем до того, как произойдет атипия клеток щитовидной железы.
Атипия щитовидной железы: признаки озлокачествления
В начале перехода атипии щитовидной железы в стадию рака не наблюдаются никакие характерные симптомы, и у врача есть возможность лишь прощупать уплотнение с достаточно четкими границами. Соответственно в случае обнаружения узла в щитовидной железе врач обязан исключать процесс озлокачествление и решать вопрос, касающийся удаления узлов.
Следует обратить пристальное внимание на самочувствие пациентов, жалующихся на общую нарастающую слабость, отсутствие или снижение аппетита, потерю веса. Как правило, опухолевидное образование разной плотности и размеров определяется на передней поверхности шеи в месте расположения щитовидной железы. Помимо этого, у пациента может возникнуть ощущение «тугого воротничка» — чувства сдавления в области шеи больного.
Запишитесь на прием, позвонив по номеру телефона Волгограда +7 (8442) 52-03-03 или онлайн.