клиновидная резекция желудка что это
Резекция желудка для похудения
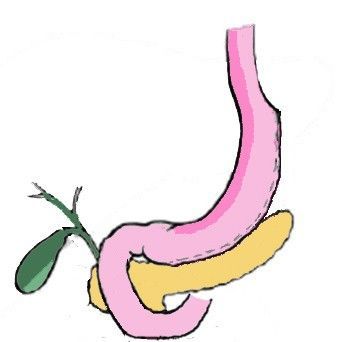
Резекция желудка (или рукавная гастропластика, рукавная резекция желудка, «слив»-резекция желудка) — это особый вид бариатрической хирургической операции, при которой большая часть желудка удаляется (резецируется). В результате он становится похож на трубку или рукав, поэтому операция и называется «рукавной» или «трубчатой» резекцией.
Резекция затрагивает около 75% поверхности органа, соответственно уменьшается объем потребляемой пищи до 100мл за прием. Однако при этом сохраняются основные «рабочие» части желудка — кардиальный сфинктер и привратник, то есть функциональность желудка не изменяется, он работает так же, как до операции.
Еще одно важное преимущество данного вида хирургического вмешательства — это удаление той части желудка, в которой вырабатывается гормон, стимулирующий аппетит — грелин. После операции человек не испытывает чувство голода, перестает переедать.
Узнать полную цену операции рукавной резекции в Москве для уменьшения желудка и похудения можно после оценки имеющихся показаний и противопоказаний. Ориентировочная стоимость указана в таблице ниже.
Почему стоит сделать операцию по резекции желудка в ФНКЦ ФМБА?
ФНКЦ ФМБА — одна из ведущих многопрофильных клиник России, где можно пройти все необходимые предоперационные и послеоперационные обследования, чем значительно сэкономить время и средства. Благодаря комплексному подходу, в клинике доступна оптимальная цена на операцию по уменьшению желудка в Москве.
С 2011 года в отделении бариатрической хирургии ФНКЦ ФМБА России проводятся операции пациентам с высоким индексом массы тела. Многолетний опыт борьбы с ожирением позволил нам:
В зависимости от программы, минимум в течение года после операции пациентам ФНКЦ ФМБА доступны консультации бариатрического хирурга и врачей других специальностей, которые облегчают прохождение реабилитационного периода. К данной программе также могут подключиться пациенты, перенесшие резекцию желудка в других клиниках.
Показания к резекции желудка
Резекция желудка проводится лапароскопическим методом и считается одной из основных методик хирургического снижения веса. Показания к этому способу:
Какого эффекта можно ожидать после продольной резекции желудка?
Снижение массы тела после продольной резекции желудка начинается непосредственно после операции. Небольшой объем желудка позволяет сразу сократить количество съедаемой пищи. Быстрое снижение веса положительно влияет на психологический настрой пациента, решившего уменьшить размер желудка. Операция дает стабильный долгосрочный эффект: потеря массы тела составит около 60-70% от избыточной массы тела.
Из-за уменьшенного потребления пищи нормализуются показатели глюкозы, липидов крови, стабилизируется уровень холестерина. Это позволяет снизить риск развития атеросклеротических изменений в сосудах, сахарного диабета, у пациентов, у которых еще нет данных заболеваний.
Подготовка к операции
Данный этап не отличается от предоперационных обследований и режима подготовки к другим бариатрическим операциям. Подготовка включает:
Реабилитация после резекции
В первые дни возможно появление болей в области разрезов. При необходимости врач может назначить обезболивающий препарат в виде инъекций.
Вечером после операции разрешается сидеть в кровати и ходить по палате. Ранняя активизация необходима, чтобы не формировался застой крови в венах ног и активнее расправлялись легкие при дыхании. Эти простые действия значительно снижают риск послеоперационных тромбоэмболических осложнений и пневмонии. Со второго дня пациенту рекомендуется двигаться больше – ходить по отделению, а в теплое время года и в хорошую погоду выходить на территорию клиники в сопровождении родственников.
В первые сутки после операции разрешается пить малыми глотками. На следующий день будет проведено рентгенологическое исследование резецированного желудка, и только после этого будет решен вопрос о приеме жидкой пищи: протеиновые коктейли, бульон.
Перед выпиской (как правило, на 3-4 день) даются индивидуальные рекомендации по питанию, физической активности, уходу за швами. Затем необходимо пройти контрольные осмотры и консультации в соответствии с программой «Послеоперационное обследование бариатрического пациента». Узнать больше о программе вы можете у наших специалистов по телефону.
Продольная резекция желудка при ожирении – о чем должен знать пациент
Структура статьи
 |
Насколько нова эта операция?
Многих пациентов пугает словосочетание «резекция желудка». Насколько обоснованны эти опасения?
Продольная резекция желудка – это совсем не та резекция, которая выполняется при онкологических заболеваниях или язвенной болезни. При ПРЖ удаляется боковая часть желудка, при этом важные физиологические клапаны желудка (кардиальный сфинктер и привратник) сохраняются, и, таким образом, желудок после ПРЖ остается физиологически вполне функциональным. Из объемного мешка желудок превращается в узкую трубку, где пища долго не задерживается и довольно быстро уходит в кишечный тракт. Секреторная активность желудка, при этом, конечно, уменьшается, но это тоже играет на руку задаче снижения веса.
В каких ситуациях продольная резекция желудка может быть операцией выбора?
Продольную резекцию желудка вполне можно рассматривать как операцию выбора у пациентов с относительно умеренным избытком веса (при индексе массы тела от 35 до 45), у пациентов с тяжелыми сопутствующими заболеваниями, а также в других ситуациях, когда выполнение более сложных операций рискованно по тем или иным причинам. ПРЖ может быть предложена пациентам вне зависимости от возраста, в том числе подросткам и лицам пожилого возраста. ПРЖ у нас хорошо зарекомендовала себя и в тех случаях, когда бандажирование желудка не дало желаемых результатов.
Можно ли рассматривать ПРЖ как альтернативу, например бандажированию желудка?
Да, вполне. В отличие от бандажирования желудка, после ПРЖ в организме не остается инородного материала (силикона). При ПРЖ снижение веса начинается сразу после операции, завершается раньше, чем после бандажирования и не зависит от дополнительных манипуляций с регулируемой системой, а фактически определяется новой анатомией желудка. При бандажировании желудка результат лечения наступает не сразу, а лишь по мере наполнения системы, и в дальнейшем будет зависеть от того, как функционирует система бандажа. Со временем желудочный бандаж, как и любая техника, может выйти из строя, потребовать устранения неисправности, а то и вовсе замены. При ПРЖ это невозможно, т.к. никаких имплантатов здесь не используется. Хотя, надо признаться, что операция ПРЖ технически сложнее и несколько более рискованнее, чем бандажирование желудка. Операцию можно выполнять как открытым способом, так и лапароскопически. Сроки пребывания в стационаре на 1-2 дня больше, чем при бандажировании.
В чем отличие ПРЖ от более сложных операций?
Если сначала планировать ПРЖ, а затем, в случае необходимости, гастрошунтирование или билиопанкреатическое шунтирование, будет ли выше стоимость такой, двухэтапной операции?
Да, поскольку стоимость ПРЖ сопоставима как с бандажированием желудка, так и с гастрошунтированием и билиопанкреатическим шунтированием (см. прейскурант). Дело в значительной стоимости расходных материалов, используемых для этой операции. Выполнение второго этапа также потребует определенных затрат, связанных с пребыванием в клинике, наркозом, использованием расходных материалов.
На какую потерю веса можно рассчитывать после ПРЖ?
Средний процент находится на уровне 60 % от лишнего веса, имевшегося у пациента перед операцией. Это показатель может значительно варьировать в ту или другую сторону у каждого пациента. Средняя потеря веса при ПРЖ несколько выше, чем при бандажировании желудка, сопоставима с вертикальной гастропластикой, но меньше, чем после гастрошунтирования и билиопанкреатического шунтирования.
Какова вероятность второго этапа лечения?
К 2008 году ответа на этот вопрос пока еще не знает никто, поскольку нет больших статистик 5 – летних результатов ПРЖ. Тем не менее, по оценке специалистов, примерный процент пациентов, которые будут нуждаться во втором этапе лечения, может находиться где-то на уровне 30 %. Для остальных пациентов ПРЖ может быть вполне самодостаточной операцией.
Некоторые пациенты интересуются, не является ли ПРЖ аналогом ранее применявшейся вертикальной гастропластики (ВГП) или других модификаций гастропластики.
Некоторые пациенты прямо спрашивают, не станут ли они инвалидами после ПРЖ.
При неосложненном послеоперационном течении ПРЖ не приводит к инвалидности. Наоборот, по мере потери массы тела пациенты получают возможность нормально жить и работать, избавляются от многих сопутствующих ожирению заболеваний, переходят в новое качество жизни. Это верно для любой бариатрической операции. Здесь уместно напомнить, что само ожирение при неэффективном лечении является инвалидизирующим заболеванием.
Возможны ли послеоперационные осложнения? Какова их вероятность?
Гарантировать отсутствие осложнений невозможно ни при какой операции. При ПРЖ накладывается скрепочный шов по ходу всего желудка. Хотя эти швы выполняются с помощью высококачественных сшивателей и всегда укрепляются дополнительно, все же имеется небольшой риск послеоперационных кровотечений, а также недостаточности (прорезывания) некоторых швов, что в редких случаях может потребовать лапароскопической или хирургической ревизии. Для профилактики недостаточности швов в первые две недели после ПРЖ питание должно быть в жидком виде, без излишней нагрузки на швы желудка. Поскольку операция проходит в зоне ворот селезенки, мы всегда предупреждаем, что в случае возникновения значительного кровотечения из селезенки она может быть удалена. Об этом мы предупреждаем и при других операциях на желудке, выполняемых в связи с ожирением.
Нуждаются ли пациенты в приеме дополнительных препаратов после ПРЖ?
Помимо упомянутых противоязвенных препаратов в первые 2-3 месяца, может понадобиться назначение поливитаминов (центрум, витрум) в период интенсивной потери массы тела. Необходимость назначения других препаратов будет определяться результатами анализов крови, которые необходимо будет периодически выполнять. Пациентки, которые планируют беременность (возможна только после завершения потери веса) нуждаются в приеме фолиевой кислоты в течение всего периода беременности.
Какое, на Ваш взгляд, место может занять ПРЖ в ряду других известных операций при ожирении? Какие у нее перспективы?
По всей вероятности, ПРЖ может стать вполне разумной альтернативой бандажированию желудка и вертикальной гастропластике. Операция может найти достойную область применения у подростков, людей пожилого возраста и у лиц с умеренным избытком массы тела. Может быть ряд и других конкретных ситуаций, при которых ПРЖ может стать операцией выбора. При сверхожирении (индексе массы тела свыше 50 кг/м2), ПРЖ следует рассматривать скорее как первый этап лечения. Вопрос, насколько стабилен эффект ПРЖ и в какой мере эта операция сопоставима по эффективности с гастрошунтированием и билиопанкреатическим шунтированием, покажет только время.
Лапароскопическая резекция желудка
Рис. 1. Точки введения троакаров при лапароскопической резекции желудка.
Рис. 2. Мобилизация большой кривизны желудка при лапароскопической резекции
Рис. 3. Прошивание и пересечение ДПК эндоскопическим сшивающим аппаратом
Рис. 4. Прошивание и отсечение препарата желудка от культи эндоскопическим сшивающим аппаратом Endo GIA – 30/
Рис. 5. Временная фиксация культи желудка иглой «Эндоклоуз»
Рис. 6. Временная фиксация культи желудка к передней брюшной стенке и выполнение гастро- и энтеротомии.
Рис. 7. Формирование продольного гастроэнтероанастомоза эндоскопическим сшивающим аппаратом Endo GIA – 30.
Рис. 8. Ушивание гастротомического отверстия инструментом «Эндостич»
Рис. 9. Прошивание приводящей петли аппаратом Эндо ТА-30.
Рис. 10. Извлечение препарата желудка из брюшной полости.
Рис. 11. Выведение через умбиликальный доступ отводящей и приводящей петель тонкой кишки для экстракорпорального формирования межкишечного анастомоза.
Рис. 12. Экстракорпоральное формирование межкишечного анастомоза.
Рис. 13. Окончательный вид операции: расположение анастомозов и уровень прошивания приводящей кишки после лапароскопической резекции желудка в оригинальной методике
На первом этапе, с помощью электрохирургических монополярных ножниц и аппарата LigaSure, мобилизовывается большая кривизна желудка с электролигированием левой желудочно-сальниковой артерии (рис. 2).
Затем выделяется и лигируется правая желудочная артерия и окончательно мобилизовывается пилородуоденальная зона. В случае стеноза привратника этот этап операции считается самым трудным этапом из-за наличия большого количества спаек и рубцов, однако диссекция данной области с использованием 5 или 10 мм инструмента LigaSure значительно упрощает манипуляции. Далее из доступа в правом подреберье вводится сшивающий аппарат Эндо GIA-30 компании «Covidien» и отсекается желудок от двенадцатиперстной кишки (Рис. 3).
Далее, если в области малого сальника нет избыточных жировых отложений и нисходящая ветвь левой желудочной артерии может быть легко выделена, на нее накладывается аппарат LigaSure, и препарат окончательно освобождается. Препарат желудка временно помещается в правое поддиафрагмальное пространство. Затем для облегчения формирования гастроэнтероанастомоза, уменьшения травматизации культи желудка и лучшей визуализации операционного поля культя желудка временно фиксируется к передней брюшной стенке, используя иглу «Endo close» компании «Covidien» (рис. 5).
Следующим этапом формируется впередиободочный гастроэнтероанастомоз на длиной петле с межкишечным соустьем. Нами используется оригинальная методика реконструктивного этапа операции, которая позволяет добиться полной арефлюксности в послеоперационном периоде. Для этого находится участок тощей кишки на расстоянии 30-40 см от связки Трейца и электрохирургическим способом выполняется гастротомия (1 см) на задней стенке желудка и энтеротомия (1 см) на противобрыжеечном крае тощей кишки (Рис 6).
Отверстия ушиваются однорядным непрерывным швом инструментом нитью «ПОЛИСОРБ» 2/0 ручным эндоскопическим однорядным швом. (Рис.8). Для предотвращения рефлюкса желчи в культю желудка в 5-10 см от анастомоза приводящая петля кишки прошивается аппаратом Эндо TA – 30 (Рис.9).
Далее извлекается препарата желудка из брюшной полости, путем небольшого (до 4 см) расширения умбиликального доступа (Рис. 10).
Окончательный вид операции представлен на рис. 13. При выполнении резекции желудка по поводу рака или малигнизации язвы обязательно дополнительно выполняется лимфодиссекция в необходимом объеме. Использование аппарата LigaSure на этапах мобилизации желудка и электролигирования желудочных сосудов значительно упрощает и ускоряет выполнение оперативного вмешательства (включая лимфаденэктомию) и повышает надежность гемостаза.
Список работ опубликованных профессором Пучковым К.В. по теме хирургия желудка и двенадцатиперстной кишки
Отзывы пациентов
06.07.2020 09:25:00 Владимир и Ольга Литовченко
Клиновидная резекция желудка что это
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»
Российский национальный исследовательский медицинский университет имени Н.И. Пирогова; Городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского национального исследовательского медицинского университета им. Н.И. Пирогова
Кафедра госпитальной хирургии №2 и научно-исследовательская лаборатория хирургической гастроэнтерологии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова
ФГБНУ «Научно-исследовательский институт морфологии человека», Москва, Россия
Российский национальный исследовательский медицинский университет имени Н.И.Пирогова, научно-исследовательская лаборатория хирургической гастроэнтерологии и эндоскопии на базе городской клинической больницы № 31 г. Москва
ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, Москва, Россия
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»; ГБУЗ «Городская клиническая больница №31» Департамента здравоохранения Москвы, Москва
Оперативное лечение больных с гастроинтестинальной стромальной опухолью желудка (с комментарием)
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(7): 23-29
Шаповальянц С. Г., Плахов Р. В., Михалев А. И., Федоров Е. Д., Михалева Л. М., Галкова З. В., Эрназаров Э. Э., Горбачев Е. В. Оперативное лечение больных с гастроинтестинальной стромальной опухолью желудка (с комментарием). Хирургия. Журнал им. Н.И. Пирогова. 2016;(7):23-29.
Shapoval’yants S G, Plakhov R V, Mihalev A I, Fedorov E D, Mikhaleva L M, Galkova Z V, Ernazarov E E, Gorbachev E V. Surgical treatment of patients with gastrointestinal stromal tumor of the stomach. Khirurgiya. 2016;(7):23-29.
https://doi.org/10.17116/hirurgia2016723-29
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»
Цель. Оценить эффективность используемых лечебно-диагностических подходов у больных с гастроинтестинальными стромальными опухолями желудка. Материал и методы. Представлен анализ непосредственных и отдаленных результатов лечения 49 пациентов с гастроинтестинальной стромальной опухолью желудка, при этом у 20 (40,8%) пациентов течение опухоли усугубилось желудочно-кишечным осложнением. Из указанной группы больных оперированы 43 (87,7%). В 24 (55,8%) наблюдениях выполнены традиционные хирургические вмешательства, в 12 (28%) — лапароскопические операции, в 7 (16,2%) — эндоскопические внутрипросветные операции. В 6 случаях оперативное вмешательство не проводилось. Результаты. Интраоперационные осложнения отмечены у 2 (4,65%) больных, послеоперационные осложнения также у 2 (4,65%) больных. В отдаленном периоде у 3 (8,3%) больных выявлено прогрессирование гастроинтестинальной стромальной опухоли, рецидив заболевания отмечен у 2 (5,6%) пациентов.
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»
Российский национальный исследовательский медицинский университет имени Н.И. Пирогова; Городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского национального исследовательского медицинского университета им. Н.И. Пирогова
Кафедра госпитальной хирургии №2 и научно-исследовательская лаборатория хирургической гастроэнтерологии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова
ФГБНУ «Научно-исследовательский институт морфологии человека», Москва, Россия
Российский национальный исследовательский медицинский университет имени Н.И.Пирогова, научно-исследовательская лаборатория хирургической гастроэнтерологии и эндоскопии на базе городской клинической больницы № 31 г. Москва
ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, Москва, Россия
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»; ГБУЗ «Городская клиническая больница №31» Департамента здравоохранения Москвы, Москва
Длительное время гастроинтестинальные стромальные опухоли (ГИСО) расценивались как лейомиомы и лейомиосаркомы, и истинный показатель их распространенности был искажен. В 1983 г. Маzur и Clark, годом позже Shaldendrand и Appelman впервые использовали термин «гастроинтестинальная стромальная опухоль». Только в 2000 г. ГИСО были выделены как отдельная нозологическая группа. На сегодняшний день известно, что ГИСО являются наиболее распространенными среди неэпителиальных опухолей пищеварительного тракта. В развитых странах мира на 1 млн населения обнаруживается до 20 случаев ГИСО в год, 20—45% из них являются злокачественными, остальные 55—80% имеют злокачественный потенциал. Следует отметить, что ГИСО составляют около 80% всех сарком желудочно-кишечного тракта и 1% всех злокачественных новообразований пищеварительного тракта [6, 7]. ГИСО развиваются в любом отделе желудочно-кишечного тракта, чаще всего в желудке — 60—70%, реже в тонкой кишке — 15—30%, в толстой кишке — 5—8%, в прямой кишке — 5%, в пищеводе — 2—5%, в червеобразном отростке — в единичных наблюдениях. Имеются сведения о выявлении ГИСО в поджелудочной железе, желчном пузыре, предстательной железе, мочевом пузыре, большом и малом сальнике, брыжейке тонкой и толстой кишки, забрюшинном пространстве [1].
В связи с относительной редкостью этого заболевания, отсутствием специфических и патогномоничных симптомов, характерных для ГИСО небольшого размера, диагностика и особенно дифференциальная диагностика опухоли нередко являются непростой задачей. Основными методами диагностики ГИСО желудка служит эзофагогастродуоденоскопия (ЭГДС), рентгенологическое исследование, компьютерная томография (КТ), магнитно-резонансная томография (МРТ). Важнейший диагностический метод — эндосонография, позволяющая оценить точную локализацию, размер и эхоструктуру опухоли.
В последние годы у большинства специалистов сформировалась точка зрения о необходимости оперативного лечения всех пациентов с верифицированной ГИСО желудочно-кишечного тракта [2, 3, 6—8, 10]. Это связано с риском агрессивного роста новообразования и возможным развитием осложнений, прежде всего желудочно-кишечного кровотечения.
Вопрос о выборе метода и объема оперативного вмешательства при лечении больных с ГИСО по-прежнему остается предметом дискуссий. Некоторые сторонники традиционной хирургии считают миниинвазивные вмешательства при ГИСО нежелательными [6, 7], хотя многим отечественным и зарубежным специалистам, рассматривающим миниинвазивную хирургию в качестве реальной альтернативы хирургической резекции, представляется возможным удаление ГИСО эндоскопическим или лапароскопическим способом [2, 5, 9].
К настоящему времени в литературе накопилось немало исследований, посвященных клинико-диагностическим аспектам, тактическим лечебным подходам в отношении больных с ГИСО, имеется достаточно работ, авторы которых изучали эффективность тех или иных способов оперативного лечения, а также непосредственные результаты их применения [2, 5, 6, 8, 10]. Лишь единичные исследования касаются оценки отдаленных результатов лечения больных с ГИСО [2, 10], что требует дальнейшего изучения этого вопроса.
Таким образом, к настоящему времени в литературе имеется недостаточно данных об отдаленных результатах лечения больных с ГИСО, отсутствует анализ результатов применения малоинвазивных оперативных вмешательств. Подобные исследования актуальны, поскольку позволяют объективно оценить эффективность используемых в настоящее время лечебно-диагностических подходов у этой категории больных.
Материал и методы
В нашей клинике за период с января 2001 г. по сентябрь 2015 г. находились на обследовании и лечении 49 пациентов с ГИСО желудка. Среди больных было 13 (26,6%) мужчин и 36 (73,4%) женщин. Возраст пациентов от 44 до 80 лет (в среднем 62±7,8 года). Из 49 пациентов у 40 (81,6%) имелись сопутствующие заболевания: у 33 — компенсированные, у 6 субкомпенсированные, у 1 — декомпенсированные. У 20 (40,8%) пациентов при поступлении были выявлены признаки желудочно-кишечного кровотечения, осложнившего течение заболевания. Кровотечение легкой степени отмечено у 9 (45%) пациентов, средней степени — у 3 (15%), тяжелой степени — у 8 (40%) пациентов. Остальные 29 (59,2%) больных поступили с жалобами на боли и тяжесть в эпигастральной области, похудание и снижение аппетита. Всем пациентам была выполнена ЭГДС, позволившая во всех наблюдениях обнаружить новообразование. У 25 (51%) пациентов дополнительно проведена рентгенография пищевода, желудка и двенадцатиперстной кишки с контрастированием, у 20 (40,8%) пациентов — КТ брюшной полости. В 41 (83,6%) наблюдении выполнена эндосонография желудка. Следует отметить, что у 5 (10,2%) пациентов под контролем ЭУС произведена тонкоигольная пункция опухоли для гистологического и иммуногистохимического исследований. Диаметр ГИСО желудка варьировал от 1,5 до 15 см (в среднем 5,2±2,3 см).
Внутрипросветные эндоскопические диагностические и лечебные вмешательства выполняли на эндоскопическом оборудовании компании «Olympus» (Япония). Использовали видеоэндоскопическую стойку EVIS EXERA CLV-160, видеоэндоскопы EVIS GIF-1Т140R, EVIS GIF-2Т160, EVIS GIF-H180.ЭУС выполняли на ультразвуковом блоке EUS EXERA EU-M60, использовали радиальный эхоэндоскоп GF-UM160 и линейный эхоэндоскоп GF-UMD140Р, а также ультразвуковые миниатюрные зонды UM-DP20−25R и UM-2R. Все видеолапароскопические операции производили на видеолапароскопическом оборудовании «Karl Storz» (Германия).
Результаты и обсуждение
Учитывая высокий злокачественный потенциал ГИСО, мы считаем, что все подобные новообразования подлежат оперативному удалению. Абсолютным показанием к операции является осложненное течение заболевания.
Из 49 больных с ГИСО желудка оперированы 43 (87,7%) больных. Остальным 6 (12,3%) пациентам оперативное вмешательство не выполняли, в том числе у 4 (66,7%) из-за выраженных сопутствующих заболеваний и 2 (33,3%) из-за категорического отказа от предложенного им оперативного лечения.
Больным с ГИСО диаметром более 5 см, а также с осложненным течением заболевания выполняли традиционные хирургические вмешательства. Лапароскопические операции осуществляли при диаметре опухоли не более 5 см и локализации в мышечном слое. Эндоскопические внутрипросветные операции выполняли при росте опухоли из мышечной пластинки слизистой оболочки или из подслизистого слоя и ее диаметре не более 5 см. Указанные условия успешного и безопасного удаления ГИСО объясняются тем, что эндоскопическое иссечение и извлечение опухолей большего диаметра технически сложно, а при локализации опухоли в мышечном слое существует высокий риск перфорации стенки органа. В послеоперационном периоде осуществляли гистологическое и иммуногистохимическое исследования макропрепарата.
Осложнения, связанные с оперативным вмешательством, зафиксированы у 4 (9,3%) из 43 оперированных пациентов.
Интраоперационные осложнения отмечены у 2 больных. У одной пациентки 62 лет во время удаления ГИСО желудка диаметром 5 см методом эндоскопической диссекции подслизистого слоя развилось кровотечение, успешно остановленное методом комбинированного эндоскопического гемостаза. У одного пациента 60 лет во время субтотальной резекции желудка по поводу ГИСО желудка диаметром 10 см была повреждена селезенка, что потребовало выполнения спленэктомии.
В послеоперационном периоде у 2 больных возникли осложнения. У одного пациента 53 лет на 7-е сутки после субтотальной резекции желудка по поводу крупной ГИСО желудка с кровотечением диагностирована перфорация острых язв тонкой кишки, что потребовало выполнения лапаротомии и резекции тонкой кишки. Пациент на 20-е сутки выписан в удовлетворительном состоянии. У одной пациентки 70 лет, на 5—6-е сутки после лапароскопической клиновидной резекции желудка по поводу ГИСО желудка диаметром 4 см, выявлены признаки несостоятельности желудочного шва с развитием распространенного перитонита, что привело к летальному исходу. Других осложнений не наблюдалось.
Из 49 (100%) леченных больных в сроки от 1 года до 14 лет обследованы 42 (85,7%), в том числе 10 (23,8%) мужчин и 32 (76,2%) женщины. Из этих больных 36 (85,8%) перенесли оперативное вмешательство, 6 (14,2%) пациентов оперированы не были. Остальные 7 (14,3%) пациентов контакту недоступны.
Методика контрольного обследования пациентов включала физикальный осмотр, УЗИ брюшной полости, ЭГДС. При подозрении на рецидив заболевания и у больных, оперированных по поводу ГИСО большого размера, выполняли ЭУС и КТ.
В результате анализа отдаленных результатов лечения удалось установить следующее: из 36 (85,7%) оперированных пациентов рецидив заболевания обнаружен у 2. У одного пациента через 1 год после лапароскопической клиновидной резекции желудка по поводу ГИСО диаметром 4 см был выявлен рецидив заболевания, в связи с чем была произведена повторная операция — субтотальная резекция желудка. Причиной рецидива опухоли, вероятнее всего, послужили экономная клиновидная резекция желудка из-за сложностей доступа к его задней стенке, а также отсутствие приема препарата гливек. У одной пациентки через 7 лет после клиновидной резекции желудка по поводу злокачественной ГИСО желудка диаметром 4 см, осложненной желудочно-кишечным кровотечением, выявлен рецидив ГИСО, приведший к смерти. Вероятно, одной из причин рецидива заболевания явилось отсутствие приема препарата гливек.
От прогрессирования заболевания на фоне приема препарата гливек умерли 3 оперированных пациента, операции этим пациентам были выполнены в неотложном порядке с учетом высокого риска рецидива желудочно-кишечного кровотечения. Одна пациентка умерла через год после неотложной гастрэктомии, выполненной по поводу крупной кровоточащей злокачественной ГИСО желудка. Следует отметить, что на момент операции имелись признаки генерализации опухолевого процесса в брюшной полости. Через 2 года и 6 лет умерли 2 пациента после клиновидной резекции желудка по поводу злокачественной ГИСО желудка диаметром 10 и 15 см, осложненной желудочно-кишечным кровотечением.
Вследствие острого инфаркта миокарда через 5 лет после субтотальной резекции желудка умерла одна пациентка с ГИСО желудка, осложненной кровотечением. Из неоперированных пациентов у 3 были отмечены неоднократные рецидивные желудочно-кишечные кровотечения, источником которых послужила ГИСО желудка, по поводу чего проводили консервативную гемостатическую терапию.
Итак, признаки прогрессирования ГИСО в отдаленные сроки после перенесенного оперативного вмешательства выявлены у 3 (7,1%) пациентов с исходными генерализованными формами заболевания. Рецидив ГИСО отмечен у 2 (4,7%) пациентов, из них у одного с неблагоприятным исходом. Вследствие острого инфаркта миокарда умерла одна ранее оперированная пациентка. Среди неоперированных пациентов у 3 отмечены неоднократные рецидивы желудочно-кишечного кровотечения на фоне незначительного роста опухоли. Остальные 33 (78,5%) пациента находятся под наблюдением онколога и ежегодно проходят обследование, чувствуют себя удовлетворительно, при обследовании данных о рецидиве или прогрессировании заболевания не выявлено.
Таким образом, важнейшим методом диагностики гастроинтестинальных стромальных опухолей (ГИСО) желудка является эндосонография, позволяющая определить точный размер и локализацию опухоли, предположительно охарактеризовать природу новообразования и выбрать оптимальный метод операции.
Больные с ГИСО подлежат оперативному лечению. Абсолютным показанием к оперативному вмешательству является осложненное течение заболевания, наблюдавшееся нами у 40,8% пациентов. Выбор метода операции должен определяться дифференцированно в зависимости от размера, локализации опухоли и ее клинического течения.
У 41,6% пациентов с ГИСО желудка возможно безопасное и успешное выполнение миниинвазивных операций в полном объеме.
В группе оперированных больных в отдаленном периоде у 3 (8,3%) выявлено прогрессирование ГИСО, у 2 (5,6%) пациентов — рецидив заболевания. У оставшегося 31 (86,1%) больного рецидив заболевания не зафиксирован, что доказывает высокую эффективность оперативного лечения по поводу этого заболевания. В группе неоперированных у 50% пациентов в различные сроки развился рецидив желудочно-кишечного кровотечения, что доказывает целесообразность оперативного лечения пациентов с ГИСО желудка.