клостридиум спп что это
Clostridium difficile
Разговор о клостридиях был бы неполным без самого внутрибольничного представителя оных — Clostridium difficile.
Автор: Трубачева Е.С., врач – клинический фармаколог
Разговор о клостридиях был бы неполным без самого внутрибольничного представителя оных — Clostridium difficile. К тому же сейчас самый подходящий случай о нем вспомнить, так как всевозможные схемы, в том числе и антибактериальной терапии, в лечении вирусных пневмоний, вызванных SARS-CoV-2, в перепрофилированных больницах могли еще сильнее натренировать внутрибольничную микрофлору, в состав которой и входит вышеупомянутая клостридия.
В настоящее время токсигенные штаммы C.difficile рассматриваются как однозначные возбудители внутрибольничных инфекций. То есть вызываемый ими псевдомембранозный колит является заболеванием, связанным с оказанием медицинской помощи, то есть ятрогенным. А все мы знаем, как Следственный Комитет к этому относится и, что самое главное, останавливаться не собирается (согласно последнему интервью председателя СК А. Бастрыкина). Поэтому необходимо максимально подробно разораться, как данное заболевание вызывается, что его провоцирует и как этого если не избежать, то максимально эффективно пролечить. Об этом и будет нынешний разговор.
Микробиологические аспекты
C.difficile, как и остальные клинически значимые клостридии, является строгим анаэробом. Основным поражающим фактором для нее, так же как и для остальных клостридий, являются токсины, и так же, как и другие клостридии, C.difficile умеет образовывать споры. Заболевание, вызываемое токсигенной C.difficile, именуется псевдомембранозным колитом.
Теперь отметим частности:
Эпидемиологические аспекты
Основным источником токсигенных C.difficile является либо больной, либо здоровый носитель. Путь распространения — фекально-оральный либо контактный. Так как споры C.difficile благополучно сохраняются до 180 суток, то некоторые вспышки могут происходить без видимо определяемого источника — достаточно плохо убранных туалетных помещений стационаров, а также давно или неправильно обработанных матрасов. Кроме того, если вдруг в отделении оказался бессимптомный носитель C.difficile из числа медицинского персонала, а остальные не особенно привыкли мыть руки, то эти самые споры будет разносить каждый второй сотрудник уже не отделения, а всей больницы — на руках, халатах, смартфонах, рассаживая ее по столам, перилам и клавиатурам, совершенно бессимптомно для себя, но с катастрофическими последствиями для больных.
Почему именно стационары? Потому что именно здесь используется самое большое количество антибактериальных препаратов, в том числе не всегда обоснованно, и C.difficile может получить селективное преимущество ввиду уменьшения количества бактерий-антагонистов, ранее сдерживавших ее размножение и токсиновыделение.
В каких отделениях чаще всего возможны случаи (или даже целые вспышки) псевдомебранозных колитов?
Поэтому если ваш пациент в течение недавнего прошлого оказывался по какой-либо причине в одном из таких отделений, то надо иметь в виду риск возможного носительства токсигенных C.difficile и развития ПМК в случае назначения антибиотиков.
Какие антибиотики чаще всего провоцируют рост количества тоскигенных C.difficile и развитие псевдомембранозного колита?
Проще говоря, то, что выбивает из толстой кишки основных конкурентов C.difficile, то и обеспечивает высокие риски развития ПМК. Но, помимо антибиотиков, ПМК провоцируют и цитостатические препараты, такие, как, например, препараты платины и метотрексат.
Какие пациенты подвергаются риску заражения токсигенной C.difficile и развитию ПМК? Чаще всего это изначально тяжелые пациенты с ожогами, после операций на толстом кишечнике, пациенты с почечной недостаточностью и любые пациенты, находящиеся в отделениях реанимации и интенсивной терапии. А пациенты с ВИЧ почему-то показывают статистику, аналогичную основной популяции — не больше и не меньше.
Исходя из всего сказанного, главным в деле сдерживания C.difficile является профилактика, краеугольным камнем которой стоит эпидемиологический надзор. Только тотальная чистота рук, туалетных комнат, как у пациентов, так и персонала, а также строжайшее выполнение требований СанПина, особенно в лечебных учреждениях, уже столкнувшихся с этим зверем, способна предотвратить новые случаи. Напомню, что летальность при псевдомембранозном колите — более 50%, а при развившемся токсическом мегаколоне — 100%.
Клинические аспекты
Основная проблема, связанная с C.difficile, — это ее диагностика. С одной стороны, все просто — давно есть коммерческие тест-системы, позволяющие проведение экспресс-тестов для обнаружения токсинов, с другой — ну и кто, положа руку на сердце, хоть раз в живую их видел? Автор за 15 лет работы не видела ни разу. Микробиологическая же диагностика требует наличия в лаборатории не только анаэробного анализатора, но еще и специально обученного бактериолога. И где всю эту роскошь взять? Вот и приходится практическому врачу ставить диагноз исходя из клинических проявлений, не забывая о дифдиагностике с другими возможными инфекционными заболевания толстого и тонкого кишечника (про которые мы уже написали в более ранних статьях: см. здесь, здесь и здесь). Кроме того необходимо думать о внутрибольничных кишечных инфекциях, которые тоже никто не отменял (хотя и давно не видел).
При этом нужно помнить и об антибиотик-ассоциированных диареях, ничего общего с ПМК и C.difficile не имеющими и объясняющимися исключительно фармакодинамикой назначенных препаратов. Например, диарея, связанная с приемом амоксициллина/клавуланата вызвана тем, что метаболиты оного стимулируют моторику толстой кишки, или макролиды, действующие на мотилиновые рецепторы и вызывающие точно такую же диарею. А уж когда эти два препарата назначены в комбинации, как любят делать в амбулаторной практике, то антибиотик-ассоциированная диарея не прилетит только к самым стойким пациентам. Кстати, если до сих пор не предупреждаете пациентов об этом чрезвычайно слабительном эффекте — то начинайте. Но, повторимся, к C.difficile это все не имеет совершенно никакого отношения. Почти всегда амбулаторные состояния решаются заменой препарата на что-то менее агрессивное в отношении кишечника и пересмотром сопутствующей терапии (например, там могут оказаться еще и НПВС, которые тоже способны провоцировать диарею).
Чем же диарея при инфицировании C.difficile отличается от всего остального? Четкой связью с госпитализацией и началом приема антибиотиков, особенно если пациент за пару месяцев до попадания к нам в руки побывал на госпитализации в ранее указанных отделениях. Если на третий день после назначения, например, цефтриаксона у такого пациента развилась диарея, тут же должен прозвучать тревожный звоночек. Если есть доступ к экспресс-тестам — определить наличие токсинов, если нет, то сразу отменять антибиотик. Если необходимость в антибактериальной терапии все еще существует, менять его на препарат из безопасного перечня. Бета-лактамы не назначать! Никакие! До выяснения происходящего с пациентом. За самим пациентом в это время (сутки, максимум двое) необходимо очень внимательно наблюдать и ни в коем случае не назначать никаких препаратов, снижающих моторику кишечника.
Если смена антибактериального препарата ничего в состоянии пациента не изменила, количество эпизодов диареи тоже нарастает или начинает пальпироваться напряженная толстая кишка, то речь может идти уже о псевдомембранозном колите, подтвердить который можно эндоскопическими методами, где в заключении будет указано наличие характерных псевдомембран на отдельных участках или всем протяжении толстой кишки, доступной к осмотру.
Чем и как лечить?
В чем преимущество метронидазола? Он не вызывает селекции резистентных штаммов энтерококков (об энтерококках мы рассуждали здесь), более доступен и в разы дешевле даже самого дешевого ванкомицина. При этом в связи с бесконтрольным его использованием на любой случай диареи образовал уже довольно приличный пул штаммов C.difficile, к нему устойчивых, поэтому метронидазол не стоит назначать пациентам, у которых уже наблюдались эпизоды внутрибольничных диарей, им же леченные, так как не факт, что перед вами не окажется пациент с уже перенесенным эпизодом ПМК, которому вегетативные C.difficile выбили, а споры устойчивых форм именно сейчас дождались своего часа.
Клостридиум спп что это
Инфекция, вызываемая Clostridium difficile, в настоящее время является серьезной угрозой госпитальной среде, удлиняет время пребывания многих больных в стационаре, а также становится причиной смерти некоторых из них.
а) Причины и механизмы развития. Носительство С. difficile как коменсалов отмечается у 2-3% взрослых и достигает 10-20% у лиц пожилого возраста.
Заражение этим микроорганизмом происходит контактным путем через руки и другие загрязненные поверхности. С. difficile представляет собой анаэробную спорообразующую грамположительную палочку. Это очень жизнестойкая бактерия, которая резистентна ко многим дезинфицирующим средствам, включая спиртсодержащий гель, но гибнет при воздействии дезинфектантов, выделяющих хлор.
Последовательность событий, лежащих в основе заболевания, состоит в колонизации кишечника госпитализированного больного токсигенным штаммом С. difficile, который при назначении больному антибиотиков, нарушающих нормальное микробное равновесие, трансформируется из спор в вегетативные формы.
б) Факторы риска. Некоторые антибиотики, в частности антибиотики широкого спектра действия и клиндамицин, особенно склонны вызывать описанную последовательность событий.
Поэтому перечень предпочтительных для применения антибиотиков рекомендует микробиолог лечебного учреждения. а антибиотики, которые склонны вызывать клостридиальную инфекцию, назначают лишь при крайней необходимости.
Нередко больным до госпитализации назначают ингибиторы протонной помпы по поводу рефлюкс-эзофагита. Эти препараты способствуют росту С. difficile и потому являются серьезным фактором риска клостридиальной инфекции. Из других факторов риска следует отметить возраст больного старше 65 лет, лечение антибиотиками в последние 3 месяца до госпитализации, госпитализация в анамнезе, воспалительные заболевания кишечника, лечение цитотоксическими препаратами.
в) Симптомы и клиника. Критериями диагностики клостридиальной инфекции являются жидкий стул или токсический мегаколон и положительные результаты исследования кала на клостридиальный токсин иммуноферментным методом. При легкой форме инфекции отмечается лишь жидкий стул, но при среднетяжелой форме появляются также гипертермия, интенсивная боль в животе, кровотечение из нижних отделов ЖКТ и нейтрофилия.
Тяжелая форма характеризуется усугублением перечисленных симптомов. Диарея становится профузной, снижается уровень альбумина в сыворотке крови, повышается концентрация в ней лактата, нарушается функция почек.
г) Лечение инфекции Clostridium difficile. Важное значение имеют ранняя диагностика и своевременное лечение.
Инфекцию, вызванную Clostridium difficile, следует заподозрить при появлении у госпитализированного больного диареи, особенно если она повторилась более 3 раз в течение 24 ч. Больного следует перевести в изолированную палату в течение 4 ч и соблюдать меры, направленные на профилактику заражения и распространения инфекции (мытье рук после каждого контакта с больным, использование перчаток и фартука. Палату, где лежал больной, дезинфицируют раствором гипохлорита.
В течение 4 ч два образца кала больного направляют на микробиологическое исследование и анализ на энтеротоксин и консультируются с инфекционистом.
Лечение включает внутривенное возмещение потери жидкости. Назначают метронидазол или ванкомицин внутрь в течение 10 дней. При тяжелой форме инфекции препаратами выбора являются ванкомицин, назначаемый внутрь, и вводимый внутривенно метронидазол. Всем больным с подозрением на тяжелую форму клостридиальной инфекции следует незамедлительно выполнить рентгенологическое исследование брюшной полости и вызвать ответственного гастроэнтеролога, хирурга и микробиолога.
После консультации микробиолога ингибиторы протонной помпы и антибиотики следует отменить.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клостридии вызывают острые кишечные инфекции.
Бактерии рода Клостридий вырабатывают наиболее сильные из известных ядов – ботулотоксин, тетаноспазмин и другие.
Клостридии – бактерии в составе постоянной собсвтенной микрофлоры кишечника. Растут строго без доступа воздуха и их очень трудно идентифицировать.
В организме человека клостридии являются стимуляторами Т-регуляторных клеток, которые снижают аллергическую настроенность организма. Один из клостридиальных метаболитов – бутират –защищает нас через интерлейкин 10. к
Кроме того, клостридии учавствуют в обмене липидов, в обмене желчных кислот и их частичном выведении из организма, подавляют рост и развитие в ЖКТ болезнетворных бактерий, расщепляют до молекулярного состояния белки.
В кишечнике новорожденных детей клостридии появляются к 6-7 дню жизни.
У детей на грудном вскармливании уровень клостридий держится в норме.
У детей при раннем введении смешанного или искусственного вскармливании клостридий превышает норму.
Анализ на дисбактериоз
Количество клостридий у взрослых:
Повышенное содержание клостридий часто наблюдается у людей старшего возраста на фоне физиологического снижения бифидобактерий.
Также повышенное содержание мясных продуктов в диете может спровоцировать рост клостридий с превышением естественной нормы.
При дисбактериозах надо регулировать эубактерии, клостридии, бифидо- и лактобактерии.
Лечшими препаратами для коррекции микрофлоры в сторону нормы являются жидкие синбиотики бифидум баг и трилакт. В них запредельное количество живых бактерий плюс жидкая среда в качестве пребиотика.
Живые культуры бифидо- и лактобактерий вместе с частью культуральной среды работают как биокатализаторы, стимулирующие восстановление кишечного гомеостаза в сторону нормы.
Людям старшего возраста необходимо 2 раза в год проводить профилактические курсы бифидум баг+трилакт для восстановления бифидобактерий, латофлоры, клостридий и др. А также регулярно употреблять в пищу кисломолочные продукты.
Трилакт и Бифидум БАГ – это безопасная микробиологическая профилактика и терапия дисбиотических нарушений ЖКТ.
Клостридия клостридии волк: С. difficile vs С. scindens
Клостридия клостридии волк: С. difficile vs С. scindens
Автор
Редактор
Тело человека населено триллионами микроорганизмов, совокупность которых называют микробиомом. Микробиом выполняет множество важных функций — от синтеза витаминов до расщепления сложных компонентов пищи. «Здоровая» микрофлора постоянно конкурирует за ограниченные питательные ресурсы с патогенными микроорганизмами, тем самым подавляя их рост. Однако из-за приема антибиотиков или других причин нормальный состав микробиома может нарушаться, и тогда патогены получают возможность размножаться неконтролируемо, вызывая болезни. Один из таких патогенов — бактерия Clostridium difficile, возбудитель псевдомембранозного колита. Борьба с С. difficile осложняется ее устойчивостью к большинству известных антибиотиков. Но недавно было показано, что рост С. difficile можно успешно подавлять не лекарствами, а при помощи родственного ему вида — С. scindens. Это открытие послужит основой для создания «умных» лекарств-пробиотиков: эффективных против С. difficile, но безопасных для полезной микрофлоры.
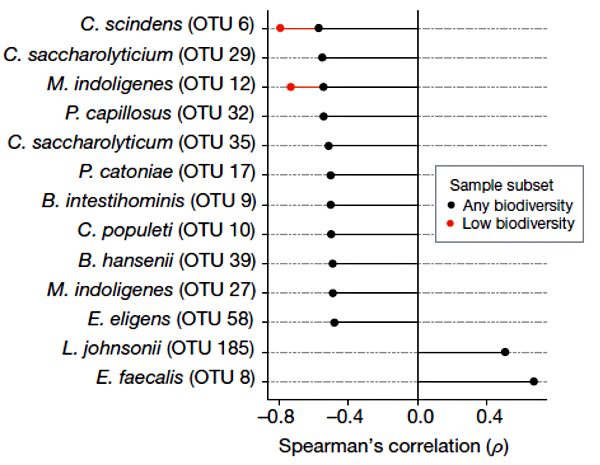
Рисунок 1. Корреляция между присутствием конкретных бактериальных таксонов в микробиоме и устойчивостью к заражению C. difficile [3].
Антибиотики эффективны в борьбе со множеством смертельных заболеваний, но вместе с тем они наносят существенный урон микробиому человека. После курса антибиотиков человек, как правило, более подвержен заражению различными патогенами. Clostridium difficile — грамположительная подвижная бактерия, основной возбудитель острых внутрибольничных кишечных инфекций. За последние 15 лет число смертельных случаев, обусловленных размножением С. difficile, возросло по меньшей мере в 10 раз, особенно среди пожилых и ослабленных людей [1]. Борьба с С. difficile осложняется тем, что при неблагоприятных условиях этот вид образует споры, выдерживающие действие антибиотиков. Такая особенность позволяет бактериям повторно колонизировать кишечник спустя несколько недель и даже месяцев после окончания лечения.
Недавно было показано, что трансплантация микробиомов здоровых доноров вылечивает тяжелые инфекции C. difficile [2]. Однако оставалось неизвестным, какие именно члены микробиома восстанавливают устойчивость организма к инфекции C. difficile и какими механизмами. И вот наконец вышла статья, которая проливает свет на довольно необычный механизм межвидовых взаимодействий в микробиоме [3].
О мышах и людях
C. difficile — не только человеческая беда, но и мышиная. Для начала микробиомы мышей пробовали травить разными антибиотиками и смотрели, как от этого меняется восприимчивость к C. difficile. В целом антибиотики не столько уменьшают суммарное число бактерий в кишечнике, сколько существенно нарушают расстановку сил — соотношение разных таксономических групп. Оказалось, что восприимчивость к C. difficile четко коррелирует с общим снижением видового разнообразия микробима. Удалось выделить горстку из 11 условных видов (операционных таксономических единиц), ассоциированных с устойчивостью к заражению C. difficile (рис. 1). Многие из них оказались тоже клостридиями (кластер Clostridium XIVa). Ученые обратили внимание на один таксон, присутствие которого сильнее всего коррелировало с резистентностью к C. difficile, даже у животных с экстремально низким видовым разнообразием микробиома. Героем оказался Clostridium scindens.
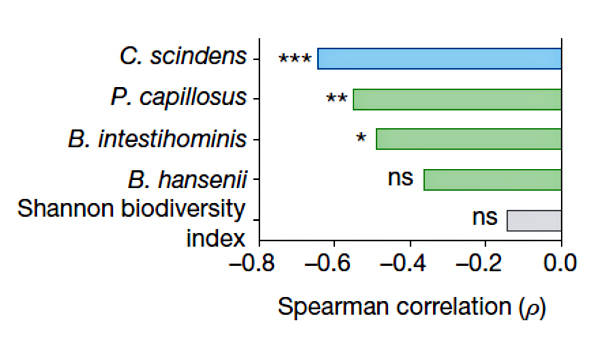
Рисунок 2. Корреляция между приживлением видов-кандидатов в микробиоме и устойчивостью к C. difficile [3].
Но то у мышей. Как же обстоят дела у человека? Для определения видов, связанных с устойчивостью к инфекции C. difficile, исследовали микробиомы пациентов, перенесших аллогеную трансплантацию гемопоэтических стволовых клеток. Большинство из них проходило химиотерапию и/или лучевую терапию одновременно с курсом антибиотиков во время трансплантации. Ослабленный иммунитет и снижение видового разнообразия микробиома делают этих пациентов легкой мишенью для C. difficile. У человека удалось найти два основных вида, с которыми не уживались C. difficile. Наиболее сильным ингибитором оказался C. scindens, как и у мышей. Как будто бы победа?
Для проверки ингибирующего эффекта C. scindens вместе с несколькими другими перспективными бактериями запустили в кишечники животных, недавно принимавших антибиотики (рис. 2). Оказалось, что такая микробная трансплантация существенно облегчила течение инфекции, вызванной C. difficile, а также положительно сказалась на снижении смертности и увеличении массы тела по сравнению с контролем. Наиболее заметную устойчивость к C. difficile обеспечивал, как и ожидалось, C. scindens. Приживление трасплантированных бактерий в микробиоме отслеживали по наличию гена соответствующей 16S рРНК. Устойчивость к C. difficile росла прямо пропорционально обилию C. scindens. То есть улучшение приживаемости C. scindens может повысить защиту против C. difficile. Примечательно, что такая аккуратная замена плохой клостридии на очень похожую, но хорошую, не нарушает существующий в микробиоме баланс (ни качественный, ни количественный). Своеобразная антидотная терапия, только на уровне микробиома. Все это открывает искрящиеся горизонты для разработки безопасных лекарств против C. difficile. Но как именно C. scindens противостоит C. difficile?
Механизм ингибирующего действия
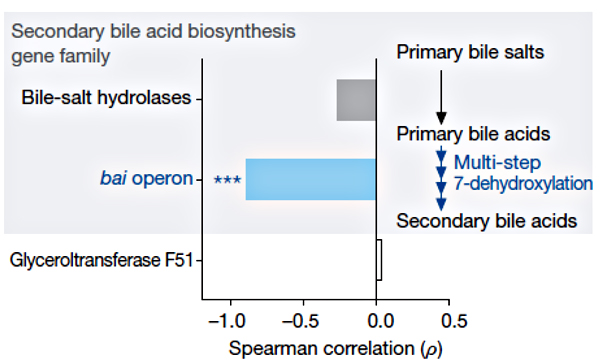
Рисунок 3. Корреляция между устойчивостью к C. difficile и наличием семейств генов, необходимых для синтеза вторичных желчных кислот [3].
Известно, что некоторые вторичные желчные кислоты могут ухудшать рост C. difficile in vitro [4]. У очень большого числа микробиомных бактерий есть ген bsh, кодирующий гидролазу желчных кислот. Однако у редкой бактерии (ужасно малой доли микробиомных организмов) есть все гены, необходимые для осуществления полного пути биосинтеза желчных кислот. Редкой бактерией, конечно же, оказалась C. scindens, обладающая критическим для синтеза вторичных желчных кислот геном 7α-гидроксистероид-дегидрогеназы (рис. 3). Именно на этой уникальной биохимической особенности и зиждется защитный механизм C. scindens против C. difficile. Внедрение C. scindens в микробиом животных, восприимчивых к C. difficile, восстанавливает необходимый уровень и соотношение вторичных желчных кислот: дезоксихолевой (DCA) и литохолевой (LCA). Обе эти кислоты подавляют рост C. difficile пропорционально своей концентрации. Примечательно, что C. scindens повышает количество вторичных желчных кислот до физиологического уровня и препятствует росту C. difficile даже у животных, прошедших курс антибиотикотерапии. Этот механизм консервативен — реализуется как в микробиоме мыши, так и в микробиоме человека.
Терапевтические перспективы
* — О черных делишках кишечных микробов-диверсантов, сокращающих пул желчных кислот и стимулирующих развитие атеросклероза, читайте в статье «Не доверяйте рекламе, или потенциальная связь метаболизма и развития атеросклероза» [6] — Ред.
Клостридиозы у детей
Клостридиозы — острые инфекционные заболевания человека и животных, которые вызваны клостридиями.
Клостридиозы классифицируют по механизму возникновения на травматические и энтеральные. К энтеральным относят: клостридиоз диффициле, клостридиоз перфрингенс, ботулизм. К травматическим относят газовую гангрену и столбняк. Ниже будут рассмотрены клостридиоз диффициле и клостридиоз перфрингенс.
Клостридиоз перфрингенс – острое заболевание инфекционной природы с энтеральным путем заражения, которое проявляется синдромом гастроэнтерита или энтероколита и инфекционным токсикозом, а в более редких случаях и некротическим энтеритом или сепсисом.
Клостридиоз диффициле – острое заболевание инфекционной природы (путь заражения также энтеральный), которое вызывается антибиотикоиндуцированными штаммами клостридий диффициле и проявляется диарейным синдромом с развитием псевдомембранозного колита и инфекционным токсикозом.
Что провоцирует / Причины Клостридиозов у детей:
Человек может заразиться только некоторыми представителями клостридий 2-й и 4-й групп, которые приводят к энтеральным клостридиозам, а также возбудителем столбняка и возбудителями газовой гангрены. Данные бактерии вырабатывают специфические активные экзотоксины.
Клостридии «проживают» в естественной среде в кишечниках животных и человека. Они могут там находиться длительное время и размножаться, но при этом к болезням не приводят. С каловыми массами клостридии попадают во внешнюю среду, в основном в землю. Там они могут «жить» долгий срок в виде спор.
Клостридии перфрингенс длительное время считали возбудителем лишь газовой гангрены. Но в середине прошлого столетия наши связь между данными бактериями и пищевыми токсикоинфекциями.
Клостридии перфрингенс представляю собой короткие полиморфные палочки, которые не имеют жгутиков. Могут образовывать субтерминально расположенные споры. Относятся к строгим анаэробам. Их делят на шесть типов в зависимости от способности производить экзотоксины и ферменты: А, В, С, D, Е, F.
Чаще всего детский кишечный клостридиоз спровоцирован клостридиями перфрингенс типа А, в более редких случаях – типами С и F.
Патогенез (что происходит?) во время Клостридиозов у детей:
Клостридиоз перфрингенс попадает в организме в ЖКТ (желудочно-кишечный тракт) вместе с зараженной едой. Далее они следуют в тонкий кишечник, там размножаются, приводя к развитию воспалительного процесса. Через эпителиальный слой кишечника ребенка они попадают в близлежащие ткани и кровь. Так заболевание переходит в тяжелую септическую форму (но не во всех случаях).
Клостридии перфрингенс продуцируют экзоэнтеротоксины, имеющие цитолитические и некротические свойства, что и определяет основные симптомы, которые проявляются в ходе заболевания.
В кишечнике, многих органах и системах (даже в ЦНС) экзотоксины клостридии перфрингенс приводят к функциональным и структурным изменениям. Может развиться токсикоз и эксикоз. К диарее приводит местный воспалительный процесс в кишечнике ребенка.
Патоморфология клостридиоза перфрингенс. Во время болезни максимальные структурные изменения случаются в тонкой или толстой (реже) кишке. У умерших фиксируют отечность слизистой оболочки кишечника, ее гиперемированность, множественные кровоизлияния, стазы, в более редких случаях и некрозы.
Клостридиоз диффициле начинается лишь во время или по окончанию применения антибиотиков широкого спектра действия, в особенности цефамизина, ампициллина, линкомицина и клиндамицина. Это происходит по причине подавления антибиотиками естественной флоры кишечника, вследствие чего клостридии диффициле могут колонизировать кишечник, размножаясь там и образовывая токсины.
Некоторые антибиотики приводят к энтеротоксинообразованию у бактерий. Помимо этого, нормальная кишечная флора у детей и взрослых производит бета-лактамазу — фермент, разрушающий бета-лактамное кольцо бета-лактамов, чем инактивируется действие антибиотика в кишечнике.
Симптомы Клостридиозов у детей:
Инкубационный период клостридиоза перфрингенс составляет от 6 до 24 часов. Это довольно короткий срок. Болезнь имеет острое начало. Проявляются такие симптомы:
С самого начала клостридиоза перфрингенс стул становится жидкой консистенции, частота дефекации повышается. Стул энтеритный или энтероколитный. Болезнь протекает относительно легко, выздоровление наступает на 3-4 сутки после начала.
Кишечный клостридиоза перфрингенс протекает иногда в тяжелых формах – по типу некротического энтероколита или энтерита. Такой форме болезни подвержены ослабленные дети с длительными дисфункциями желудочно-кишечного тракта; дети, которые пролечили антибиотиками широкого спектра действия; дети с кишечным дисбактериозом. Болезнь начинается по типу острого гастроэнтерита. Появляются боли в животе, частая рвота с наличием крови, стул обильный водянистый или пенистый (дефекация от 15 до 20 раз за сутки). В стуле может наблюдаться примесь крови или слизи. От старших детей поступают жалобы на разбитость и общую слабость, головокружения, боли в животе (могут быть постоянными или схваткообразными). Далее начинается обезвоживание организма ребенка, «падает» артериальное давление. Фиксируют увеличение печени и селезенки, парез кишечника (резкое вздутие живота).
Если болезнь прогрессирует и не вылечена вовремя, может случиться летальный исход вследствие нарушения сердечно-сосудистой деятельности. У ослабленных детей и грудничков инфекция может генерализироваться, развивается сепсис.
Кишечный клостридиоз диффициле в большинстве случаев по симптомам аналогичен псевдомембранозному колиту, в более редких случаях – некротическому энтероколиту или диарейному синдрому. Заболевания псевдомембранозным колитом характерны для грудничков, новорожденных и дошкольников.
Псевдомембранозиый колит появляется, как правило, через неделю-10 дней после начала приема антибиотиков. Болезнь начинается остро – поднимается температура, появляются срыгивания или повторная рвота, боли в животе и диарея. Малыши отказываются от еды, родители могут заметить вздутие живота и снижение массы тела.
Кожа приобретает бледно-серый оттенок, на коже живота часто видна сеть застойных вен. Стул становится жидким, водянистым, наблюдаются примеси слизи и крови (не всегда). В некоторых случаях большая часть стула представляет собой густую белесоватую слизь и обрывки фибринозных наложений. Иногда стул гнойный, с кровянистыми примесями. Для некоторых случаев характерно кишечное кровотечение, что часто приводит к летальному исходу.
Болезнь протекает у новорожденных (в особенности – у недоношенных) тяжело. Наблюдают профузный понос, обезвоживание, расстройство периферического кровообращения или расстройство кровообращения по типу коллапса без диареи.
Если есть изъязвление пораженных участков слизистой оболочки кишечника, могут фиксировать перформацию кишечника и каловый перитонит. При этом состояние ребенка тяжелые, кожа окрашивается в серый оттенок, дыхание поверхностное, резко выражен парез кишечника, наблюдаются гиподинамия и гипорефлексия, заостренность черт лица больного ребенка. Не исключена отечность гениталий. Если лечение не начато вовремя, есть вероятность летального исхода.
Клостридии диффициле, помимо некротических энтероколитов, псевдомембранозных колитов и кишечного сепсиса могут приводить к более легким болезням ЖКТ, которые протекают схоже с энтеритами и энтероколитами, особенностей не имеют.
Диагностика Клостридиозов у детей:
Кишечный клостридиоз перфрингенс диагностируют при помощи эпидемиологических и клинико-лабораторных данных в сумме. Для заболевания характерны острое начало, быстро развитие клинических проявлений – диареи, рвоты, повышения температуры, интоксикации или нейротоксикоза и т. д. Симптомы ярче всего выражены на 1-2 день после начала заболевания. Так же быстро «сходят на нет», как и появляются.
Такие симптомы характерны не только для данного заболевания, потому проводят лабораторную диагностику. Используют экспресс-методы (РНГА и ИФА) для обнаружения в фекалиях больного ребенка энтеротоксина. У выделенных штаммов клостридий определяют энтеротоксигенность.
В крови у больных с кишечным клостридиозом перфрингенс наблюдают умеренный лейкоцитоз и палочко-ядерный сдвиг.
Для диагностики кишечного клостридиоза диффициле необходимы сведения анамнеза о терапии антибиотиками, а также инструментальные и клинические показатели. Проводится комплекс лабораторных исследований для обнаружения в фекалиях больного ребенка специфических токсинов (энтеро- и цитотоксина) и возбудителя.
Селективное выделение клостридии диффициле проводят с помощью циклосерин-цефокситин-фруктозного агара. В последнее время диагностику энтероклостридиоза диффициле проводят с помощью высокочувствительных методов ИФА и РЛА.
Доказать клостридиоз диффициле с помощью только обнаружения возбудителя и его токсинов в кале или другом биоматериале от больного нельзя. Потому что данные микроорганизмы и токсины могут быть и у здорового человека, в основном у недавно рожденных и детей до 6 месяцев.
Лечение Клостридиозов у детей:
Лечебные мероприятия при кишечном клостридиозе перфрингенс аналогичны таковым при других бактериальных диареях. Назначают этиотропную терапию, учитывая чувствительность обнаруженных штаммов клостридий к антибиотикам. Врачи рекомендуют использовать для лечения энтеральные формы антибиотиков, к примеру, азитромицин, амоксиклав, цефалоспорины 3-го поколения и т. д.
Комплексная терапия включает бактерийные препараты, такие как бификол или бифидумбактерин, а также другие препараты для нормализации биоценоза кишечника. Бактерийные препараты служат для прекращения колонизации кишечника клостридиями. При особо тяжелых формах заболевания, если установлен тип возбудителя, для лечения могут применять антитоксическую сыворотку в дозе 5000—10000 АЕ внутримышечно по методу Безредки или энтерально.
Под этиотропной терапией антибиотикоиндуцированного кишечного клостридиоза диффициле подразумевают введение парентеральных аминогликозидов, метронидазола, цефалоспоринов.
После окончания приема антибиотиков следует назначить ребенку прием бактерийных препаратов (к примеру, линекса, бифидумбактерина, лактобактерина и пр). Это поможет нормализовать биоценоз в кишечнике.
Лечат клостридий диффициле также ферментными препаратами, например, фесталом, креоном и т. д., витаминами (в особенности – группой В). Необходима симптоматическая и патогенетическая терапия. Если есть соответствующие показания, применяют инфузионную терапию, чтобы нормализовать баланс жидкости в организме ребенка, провести дезинтоксикацию и парентеральное питание. Применяют антигистаминные препараты, а при тяжелых формах кортикостероиды и специфические антитоксические сыворотки.
Профилактика Клостридиозов у детей:
Самые важные профилактические меры заключаются в:
— строгом соблюдении санитарно-гигиенических норм приготовления, хранения и сбыта пищевых продуктов;
— активном выявлении носителей клостридий среди работников пищеблоков и детских учреждений;
— своевременной изоляции и лечении зараженных клостридиями детей и взрослых;
— санитарно-просветительной работе среди населения о правильном уходе за детьми и их кормлении;
— кратновременном хранении продуктов и термической обработке.
Профилактические меры при кишечном клостридиозе диффициле должны быть направлены, прежде всего, на предупреждение антибиотикоиндуцированности как важнейшего фактора заболевания этим клостридиозом.
Не следует использовать как профилактическое или лечебное средство антибактериальные лекарства широкого спектра действия длительными курсами.
Чтобы избежать колонизации кишечника клостридиями, необходимо вовремя лечить кишечный дисбактериоз и проводить его профилактику. В стационарах, особенно в отделениях для новорожденных, следует обеспечивать необходимый санитарно-гигиенический режим, правильную дезинфекцию инструментария, посуды, белья и т. д.
Обработка предметов проводится с помощью хлориндиоксида или его аналогов, имеющих бактерицидные и спороцидные свойства, влияющие на клостридий.