В планетарной модели атома принимается что число
Планетарная модель атома.
Планетарная модель атома, или модель Резерфорда — это историческая модель строения атома, предложенная Эрнестом Резерфордом как результат эксперимента с рассеиванием альфа-частиц.
Для вычисления распределения «+» заряда в атоме, английский ученый Э. Резерфорд провел исследование рассеяния α-частиц фольгой из разных веществ. Большинство α-частиц беспрепятственно, практически не отклоняясь, проходило сквозь фольгу, и лишь 1 из 2000 частиц отклонялась на углы, большие 90°. Результатом этих экспериментов в 1911 г. стало предложение Резерфордом следующей модели строения атома.
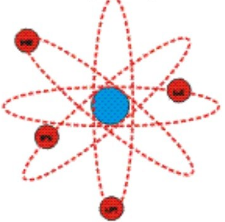
Атом состоит из положительно заряженного ядра, вокруг него обращаются электроны, каждый по своей орбите, как планеты Солнечной системы, обращающиеся вокруг Солнца. Именно поэтому модель назвали планетарной.
Положительный заряд ядра qядра связан с числом электронов Z в атоме при помощи соотношения:

Заряд ядра и число электронов в атоме, соответственно, совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
В целом атом является электронейтральным. Электрон, отрываясь или присоединяясь к атому (как результат столкновения, например, либо при разных химических процессах) может образовывать положительно либо отрицательно заряженные ионы.
Простая и наглядная модель атома Резерфорда отлично объясняла результаты этих опытов. Но основываясь на этой модели строения атома нельзя объяснить факт существования атома и его устойчивость.
Это несоответствие опыта выводам теории связано с попыткой применения законов классической физики к внутриатомным явлениям (которые, как выяснилось, подчиняются законам квантовой механики).
Выход из образовавшейся в теории атома ситуации нашел датский физик Нильсом Бором.
Планетарная модель атома
теория по физике 🧲 квантовая физика
Одним из самых важных открытий в области современной физики стало открытие сложного строения атома. В процессе изучения этого строения были открыты новые законы, которые применимы только для описания движения микрочастиц. Такие законы называют законами квантовой механики.
Строение атома по Томсону
Правильное представление о строении атома сложилось не сразу. Первую модель строения частицы вещества предложил английский физик Дж. Дж. Томсона, которому принадлежит открытие электронов. Сравнить эту модель можно с кексом. Положительный заряд атома, играющий роль теста, занимает весь атомарный объем. Причем его плотность одинакова во всех точках. Электроны, словно изюминки в тесте, равномерно распределяются в объеме, занятом положительным зарядом.
Так, согласно представлениям Томсона, атом водорода представляет собой небольшой положительно заряженный шарик радиусом в 10 –10 м. И внутри него расположен один электрон. У более сложных атомов электронов больше.
Опыты Резерфорда
Модель Томсона подверглась критике уже тогда, поскольку она абсолютно противоречила уже открытым к тому времени свойствам атома. Одно из главных свойств — устойчивость.
Известно, что масса электронов в несколько тысяч раз меньше массы атомов. Но в целом атом является нейтральным. Значит, основная масса приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Такие частицы образуются при распаде радия и некоторых других химических элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. По сути, α-частицы — это лишенные электронов атомы гелия. Двигаются они со скоростью, равной 1/15 скорости света.
Такими частицами Резерфорд в своих экспериментах бомбардировал атомы тяжелых элементов. Известно, что электроны неспособны изменить траекторию движения α-частиц, потому что они слишком мало весят. Ведь небольшой камешек, врезавшийся в автомобиль, не может существенно повлиять на его скорость.
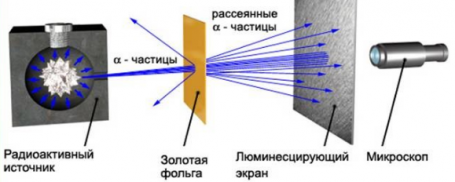
Изменить направление движения α-частиц может только положительный заряд атома. Так, если бомбардировать этими частицами атом, то по их рассеянию можно узнать, каким образом распределяется положительный заряд внутри него. Схема опыта резерфорда выглядит так:
Резерфорд поместил в цилиндр радиоактивное вещество. Вдоль цилиндра ученый высверлил узкий канал, из начал исходить пучок α-частиц. Этот поток попадал на тонкую золотую фольгу. Пройдя ее, частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. За экраном стоял микроскоп, с помощью которого можно было наблюдать столкновение полностью ионизированных атомов гелия с экраном. Ведь при каждом столкновении на экране можно было наблюдать вспышку — сцинтилляцию. Вся установка находилась внутри сосуда, из которого был выкачан воздух — это гарантировало отсутствие других факторов, которые могли бы повлиять на исход опыта.
Если провести опыт без фольги, то глядя в микроскоп, можно было наблюдать следующую картину: на экране формировался кружок, образованный сцинтилляциями от удара α-частиц об экран.
Но если на пути потока этих частиц поставить тонкую фольгу из золота, то картина меняется. Кружок, состоящий из сцинтилляций, становится больше.
Такой результат эксперимента нельзя было предсказать, если считать, что атом действительно имеет такое строение, какое предположил Томсон. Ведь при распределении по всем объему атома положительный заряд не может создать сильное электрическое поле. Поэтому он не смог бы отклонить траекторию движения α-частиц кардинально. Максимальная сила отталкивания в этом случае может быть рассчитана путем применения закона Кулона:
q a — заряд α-частицы, q — положительный заряд атома, R — радиус атома, а k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
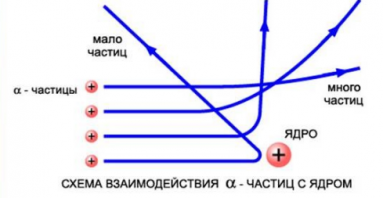
Резерфорд сделал вывод о том, что α-частица могла быть отброшена назад только случае, если положительный заряд атома и его масса сконцентрированы в небольшом пространстве. Так ученый пришел к мысли о существовании атомного ядра. По его представлению, это было тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
На рисунке выше изображены траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая количество α-частиц, рассеянных на различные углы, Резерфорд дал оценку размерам ядра. Выяснилось, что его диаметр равен примерно 10 –12 –10 –13 см. Такой разброс связан с тем, что размеры ядер атомов разных веществ различны. Размер же самого атома равен 10 –8 см. Это в 10–100 тыс. раз больше размера атомного ядра.
Планетарная модель атома
Основываясь на результатах опыта, Резерфорд создал планетарную модель атома. Согласно ей, в центре атома расположено положительно заряженное ядро. В нем сосредоточена почти вся масса атома. Но в целом атом является нейтральной частицей. Это связано с тем, что положительный заряд ядра уравновешивается отрицательным зарядом электронов, которые вращаются вокруг этого ядра подобно тому, как вращаются планеты вокруг Солнца. Но если планеты вращаются под действием гравитационных сил, то электроны вращаются под действием сил кулоновских (со стороны ядра).
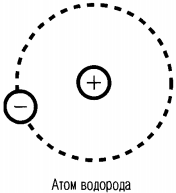
Так, в атоме водорода вокруг ядра вращается только лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона. Причем его масса примерно в 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода определяется радиусом орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но даже это модель не объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, и оно очень велико. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается энергетическими потерями. Теряя энергию, электроны должны приближаться к ядру так, как спутник приближается к Земле при торможении о верхние слои атмосферы. По расчетам, электрон должен упасть на ядро за 10 –8 с. Но этого не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать бесконечно. При этом они не излучают электромагнитные волны.
Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
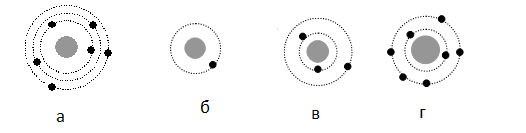
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63 Li соответствует схема:
Алгоритм решения
Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
pазбирался: Алиса Никитина | обсудить разбор | оценить
Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
а) нейтральным атомом углерода 9 6C б) ионом бериллия 7 4Be в) ионом лития 9 3Li г) нейтральным атомом бериллия 7 4B
Алгоритм решения
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Планетарная модель атома по Резерфорду.



Планетарная модель атома
Рассеяние a-частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет.
Какие же заряды в атоме вызывают рассеяние a-частиц? Электроны не могут этого сделать, так как их масса много меньше массы частицы: ma=7350me.При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения.
Причиной рассеяния a-частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:
2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца:
 | электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение. |
 | число электронов в атоме равно Z ( порядковый номер элемента) |
 | электроны движутся с большой скоростью, образуя электронную оболочку атома. |
Модель атома, предложенная Резерфордом, называется планетарной.
Планетарная модель атома по Резерфорду.
Опыты показали, что наиболее легко удаляемой частью атома являются электроны.
В 1903 г. Дж. Томсон предложил статическую модель атома: атом представляет собой положительный заряд, в котором вкраплены колеблющиеся электроны. Эта модель не имела экспериментального подтверждения.
2) вокруг ядра движутся электроны, число которых определяется зарядом ядра. Атом электронейтрален;
3) сила электростатического притяжения между ядром и электронами уравновешивается центробежной силой вращения электронов, так что электроны удерживаются на своих орбитах. Атом система устойчивая. Но у этой модели были недостатки:
1. Модель не объясняла устойчивость атома. Электрон, вращаясь вокруг положительно заряженного ядра, должен излучать электромагнитную энергию в виде световых волн. Но излучая свет, электрон теряет свою энергию и приближается к ядру. Исчерпав всю свою энергию, он должен «упасть» на ядро и атом прекратит существование. Излучая энергию электрон «упадёт» на ядро через 10 минус 8 сек. Это противоречит реальным свойствам атома, т.к. атом система устойчивая.
2. Модель не объясняет линейчатость спектра атомов. При непрерывном излучении энергии спектр излучения атома должен быть сплошным, а в действительности он линейчатый.
Таким образом, теория Резерфорда не объясняла ни устойчивости атома, ни линейчатость спектра. Дальнейшие исследования Нильса Бора объяснили эти факты.
Опыты по рассеиванию частиц дали возможность Резерфорду не только обнаружить ядро в атоме, но и определить его заряд. Он определял заряд ядер атомов металлов, из которых была сделана фольга (Cu, Ag, Pb) Им были получены заряды ядер: Pb 77,4; Cu 29,3; Ag 46,3. Заряд ядра совпадал с порядковым номером элемента в периодической системе. Необходимо было установить физический смысл порядкового номера (Z).
Спектральный терм
Спектра́льный терм или электро́нный терм атома, молекулы или иона — конфигурация (состояние) электронной подсистемы, определяющая энергетический уровень. Иногда под словом терм понимают собственно энергию данного уровня. Переходы между термами определяют спектры испускания и поглощения электромагнитного излучения.
Термы атома принято обозначать заглавными буквами S, P, D, F и т. д., соответствующими значению квантового числа орбитального углового момента L=0, 1, 2, 3 и т. д. Квантовое число полного углового момента J дается индексом справа внизу. Малой цифрой вверху слева обозначается кратность (мультиплетность) терма. Например, ²P3/2 — дублет Р. Иногда (как правило, для одноэлектронных атомов и ионов) впереди символа терма указывают главное квантовое число (например, 2²S1/2).
Относительную энергию термов можно определить по правилу Хунда.
Спектральные серии водорода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее изучены. Они хорошо подчиняются формуле Ридберга:

где R = 109 677 см −1 — постоянная Ридберга для водорода, 
Решая совместно уравнения (2), (5), (9), получим выражение для полной энергии электрона в атоме водорода:
 | (10) |
 | (11) |

Энергия возбуждения Евоз – это энергия, которую необходимо сообщить электрону, чтобы он из основного состояния (n = 1) перешел в возбужденное. Например, Евоз = 10,2 эВ – энергия, необходимая для перехода электрона в состояние, соответствующее n = 2 (первое возбужденное состояние).
Согласно постулату Бора, при переходе электрона из одного состояния (с большей энергией) в другое (с меньшей энергией) испускается фотон, частота которого определяется формулой (8). Учитывая выражение (10) для энергии электрона в атоме, получим выражение для частот испускаемых фотонов:
 | (12) |
или, соответственно, для длин волн испускаемых фотонов:
 | (13) |
Таким образом, модель атома Н.Бора объясняет дискретный (линейчатый) характер спектра испускания атома водорода.
Планетарная модель атома
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика.
Полезное
Смотреть что такое «Планетарная модель атома» в других словарях:
планетарная модель атома — planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. planetary atom model vok. Planetenmodell des Atoms, n rus. планетарная модель атома, f pranc. modèle planétaire de l’atome, m … Fizikos terminų žodynas
Боровская модель атома — Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Модель — I Модель (Model) Вальтер (24.1.1891, Гентин, Восточная Пруссия, 21.4.1945, близ Дуйсбурга), немецко фашистский генерал фельдмаршал (1944). В армии с 1909, участвовал в 1 й мировой войне 1914 18. С ноября 1940 командовал 3 й танковой… … Большая советская энциклопедия
СТРОЕНИЕ АТОМА — (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
Атом — У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
Резерфорд Эрнест — (1871 1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член корреспондент РАН (1922) и почетный член АН СССР (1925). Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Άτομο — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускул — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускулы — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Презентация была опубликована 6 лет назад пользователемРоман Грузинский
Похожие презентации
Презентация на тему: » В планетарной модели атома принимается, что 1)число электронов на орбитах равно числу протонов в ядре 2)число протонов равно числу нейтронов в ядре 3)число.» — Транскрипт:
1 В планетарной модели атома принимается, что 1)число электронов на орбитах равно числу протонов в ядре 2)число протонов равно числу нейтронов в ядре 3)число электронов на орбитах равно сумме чисел протонов и нейтронов в ядре 4)число нейтронов в ядре равно сумме чисел электронов на орбитах и протонов в ядре
2 Планетарная модель атома обоснована опытами по 1)растворению и плавлению твердых тел 2)ионизации газа 3)химическому получению новых веществ 4)рассеянию α-частиц
3 При изучении строения атома в рамках модели Резерфорда моделью ядра служит 1)электрически нейтральный шар 2)положительно заряженный шар с вкраплениями электронов 3)отрицательно заряженное тело малых по сравнению с атомом размеров 4)положительно заряженное тело малых по сравнению с атомом размеров
4 Энергия фотона, поглощаемого атомом при переходе из основного состояния с энергией E 0 в возбужденное состояние с энергией Е 1 равна (h постоянная Планка) 1)E 1 – E 0 2) 3) 4) E 1 + E 0
5 Согласно постулатам Бора частота электромагнитного излучения, возникающего при переходе атома из возбужденного состояния с энергией Е 1, в основное состояние с энергией Е 0, вычисляется по формуле (с скорость света, h постоянная Планка) 1) 2) 3) 4)
6 Сколько фотонов различной частоты могут испускать атомы водорода, находившиеся во втором возбужденном состоянии Е 2, согласно постулатам Бора? 1) 1 2) 2 3) 3 4) 4
7 Предположим, что энергия атомов газа может принимать только те значения, которые указаны на схеме. Атомы находятся в состоянии с энергией Е (3) Фотоны какой энергии может поглощать данный газ? 1)любой в пределах от 2· Дж до 8· Дж 2)любой, но меньшей 2· Дж 3)только 2· Дж 4)большей или равной 2· Дж
9 На рисунке приведены возможные значения энергии атомов газа. Атомы газа находятся в состоянии с энергией E 1. На газ падает луч лазера. Атомы ионизируются, если энергия фотонов в лазерном луче не меньше 1) Дж. 2) Дж. 3) Дж. 4) Дж.
10 На рисунке 2 приведены возможные значения энергии атомов газа. Атомы находятся в состоянии с энергией Е 2. Какое из следующих утверждений правильно? 1)Атомы данного газа могут поглотить фотон с энергией Дж, но не могут испустить такой фотон. 2)Атомы данного газа могут как поглотить, так и испустить фотон с энергией Дж. 3)Атомы данного газа могут испустить фотон с энергией Дж, но не могут поглотить такой фотон. 4)Атомы данного газа не могут ни поглотить, ни испустить фотон с энергией Дж.
11 На рисунке представлена диаграмма энергетических уровней атома. Какой из отмеченных стрелками переходов между энергетическими уровнями сопровождается поглощением кванта минимальной частоты? 1)с уровня 1 на уровень 4 2)с уровня 1 на уровень 2 3)с уровня 4 на уровень 1 4)с уровня 2 на уровень 1
12 При поглощении света атомом вещества 1)энергия атома меняется постепенно 2) энергия атома может меняться постепенно или скачком в зависимости от состояния атома 3)энергия атома может меняться скачком или постепенно в зависимости от частоты падающего света 4)энергия атома меняется только скачками
13 На рисунке приведены фотографии спектра поглощения неизвестного газа и спектров поглощения известных веществ. По анализу спектров можно утверждать, что неизвестный газ содержит в заметном количестве 1)водород (Н), гелий (Не) и натрий (Na) 2)только натрий (Na) и водород (Н) 3)только натрий (Na) и гелий (Не) 4)только водород (Н) и гелий (Не)
14 На рисунках А, Б, В приведены спектры излучения паров стронция, неизвестного образца и кальция. Можно утверждать, что в образце 1)не содержится ни стронция, ни кальция 2)содержится кальций, но нет стронция 3)содержатся и стронций, и кальций 4)содержится стронций, но нет кальция
15 На рисунке приведен спектр поглощения неизвестного газа, а также спектры поглощения атомов магния и лития. Что можно сказать о химическом составе газа? 1)Газ состоит только из атомов магния. 2)Газ состоит только из атомов лития. 3)Газ состоит из атомов магния и лития. 4)Газ состоит из атомов магния, лития и еще какого-то другого вещества.