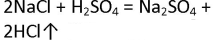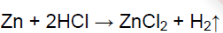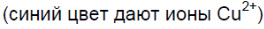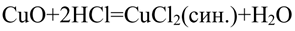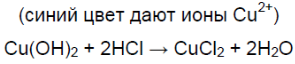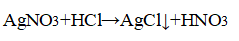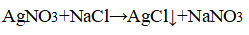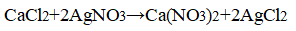В пробирку насыпьте немного оксида кальция и добавьте соляной кислоты что наблюдаете
Методические указания к лабораторным работам Ростов-на-Дону
Главная > Методические указания
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Федеральное агентство по образованию
Донской государственный технический университет
Методические указания к лабораторным работам
А.В.Хохлов. Химия. Методические указания к лабораторным работам.
Ростов н/Д, Издательский центр ДГТУ. 2009. 15 с.
Методические указания для студентов специальностей 280202, 280102, 260100, 150206, 150501, 150204, 150202.
Печатается по решению редакционно-издательского совета
Научный редактор д.т.н., профессор А.С.Кужаров
© Донской государственный технический университет, 2009
Лабораторная работа № 1
Свойства основных классов неорганических соединений

В пробирку насыпьте немного оксида кальция CaO и добавьте 1 мл воды. Содержимое пробирки хорошо перемешайте и прибавьте 2-3 капли раствора фенолфталеина. Как изменится цвет индикатора и почему?
Опыт 2. Взаимодействие основных оксидов с кислотами.
В пробирку насыпьте немного оксида кальция (около 0,1 г) и добавьте 1 мл раствора соляной кислоты HCl. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Взаимодействие амфотерных оксидов со щелочами и кислотами.
В две пробирки насыпьте небольшое количество (около 0,1 г) оксида цинка ZnO. В первую прилейте 2-3 мл раствора соляной кислоты, во вторую 2-3 мл раствора гидроксида натрия. Что происходит? Проверьте растворимость оксида цинка в воде. Составьте уравнения всех процессов.
В пробирку налейте 1-2 мл раствора гидроксида натрия NaOH, добавьте 1-2 капли раствора фенолфталеина и медленно, по каплям, прибавьте 1-2 мл соляной кислоты HCl до изменения окраски индикатора. Что происходит? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 5. Исследование амфотерности гидроксидов цинка и
Опыт 6. Получение нерастворимых оснований.
Опыт 7. Взаимодействие кислот с солями.
К 1-2 мл раствора нитрата свинца(II) Pb(NO 3 ) 2 прилейте 1-2 мл раствора соляной кислоты. Что происходит? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 8. Взаимодействия кислот с металлами
Опыт 9. Получение солей из амфотерных гидроксидов.
Лабораторная работа № 2
Определение молярной массы эквивалента металла
Отметьте условия проведения опыта: давление (р) и температуру (Т).
По табл. 2.1 определите давление насыщенного водяного пара (h) при температуре проведения опыта. Экспериментальные данные внесите в табл. 2.2.
Практическая работа №2. Влияние различных факторов на скорость химической реакции. Химия 11 класс
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Практическая работа №2
Влияние различных факторов на скорость химической реакции.
Цель: рассмотреть влияние различных факторов на скорость химической реакции.
Оборудование и реактивы: пробирки, спиртовка, спички, держатель, штатив для пробирок, лучинка, цинк, магний, медь: гранулы и порошок, растворы соляной кислоты (1:3, 1:10), уксусная кислота, мел, стакан с горячей водой, пероксид водорода, оксид марганца ( IV ).
Оформить работу в виде таблицы:
Рассматриваемый фактор, влияющий на скорость химической реакции
Наблюдения, позволяющие судить о скорости реакции
1. Влияние природы реагирующих веществ
В первой пробирке (магния) наблюдается активное выделение газа (водорода)
Во второй пробирке (где цинк) медленно выделяются пузырьки газа (водорода)
В третей пробирке (где медь) ничего не наблюдается
Cu + HCl ↛ реакция не идет
С цинком быстрее протекает реакция с соляной кислотой, чем с уксусной кислотой
2. Влияние концентрации реагирующих веществ
Где более интенсивно проходит реакция? Почему?
Там, где концентрация кислоты больше (1:3), там реакция идет быстрее, чем где концентрация кислоты составляет 1:10.
В двух пробирках идет одна и та же реакция:
Zn + 2HCl → ZnCl 2 + H 2 ↑
Чем выше концентрация реагирующих веществ, тем чаще столкновения их частиц и тем выше скорость химической реакции
3. Влияние поверхности соприкосновения реагентов
В одну пробирку опустите кусочек мела, в другую насыпьте порошок мела. Налейте в пробирку по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Наиболее интенсивно газ выделяется, там где был порошок мела, нежели кусочек мела
В двух пробирках идет одна и та же реакция:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
При увеличении степени измельчения твердых веществ, увеличивается поверхность соприкосновения реагирующих веществ, т. е. растет число столкновений между молекулами и или атомами поэтому, чем выше степень измельчения веществ, тем быстрее протекает скорость реакции
4. Влияние температуры
В две пробирки опустите по одной грануле цинка. Налейте по 1 мл соляной кислоты одинаковой концентрации в каждую пробирку. Одну пробирку опустите в стакан с горячей водой. По интенсивности выделения пузырьков водорода сделайте вывод о влиянии температуры на скорость химической реакции
Быстрее реакция идет там, где пробирка опущена в стакан с горячей водой
В двух пробирках идет одна и та же реакция:
Zn + 2HCl → ZnCl 2 + H 2 ↑
При столкновении молекул и/или атомов реагируют только те молекулы и/или атомы, которые обладают достаточной кинетической энергией для осуществления реакции. При повышении температуры доля таких молекул и/или атомов возрастает, поэтому в пробирке, которая опущена в стакан с горячей водой, реакция идет более интенсивно
5. Влияние катализатора
В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца
Под действием катализаторов вещества становятся реакционно способными при более низкой температуре
Вывод: Скорость химической реакции зависит от условий: от природы реагирующих веществ, от площади соприкосновения, от концентрации, от температуры, от присутствия катализаторов.
Правила техники безопасности при выполнении химического эксперимента
Многие вещества при попадании на кожу могут вызвать ожоги. Никогда не берите вещества руками.
Некоторые вещества имеют неприятный запах, а их пары могут вызвать отравление. Не подносите близко к лицу открытую склянку.
В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
7. Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
8. Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
9. При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа.
10. Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
11. Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
12. Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
13. Без разрешения учителя, ничего на столах не трогать.
14. Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
15. После работы приведи порядок на рабочем месте.
Вопросы к параграфу 16 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
§ 16. Практическая работа №3.
Получение соляной кислоты и изучение её свойств
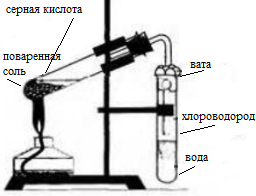
1. Получение соляной кислоты. Соберите прибор, как показано на рисунке 13 (см. с. 56). В пробирку насыпьте 2—3 г поваренной соли и прилейте концентрированную серную кислоту (2 : 1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5—1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5—6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой! Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании. Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз? Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Получение соляной кислоты
Насыпали 2-3 г. поваренной соли и прилили концентрированную кислоту (2:1). Закрыли пробирку пробкой с газоотводной трубкой, конец трубки опустили в пробирку с водой, чтобы он находился над уровнем воды на 1 см. нагрели смесь с помощью спиртовки.
В лаборатории соляную кислоту можно получить с помощью растворения в воде хлороводорода, который получают воздействием концентрированной H2SO4 на хлорид.
2. Химические свойства соляной кислоты. Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II) в шестую — немного мела или другого карбоната. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами. Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? составьте уравнения соответствующих реакций.
Химические свойства соляной кислоты
Лакмусовая бумажка окрашивается в красный цвет.
Есть кислотные свойства.
Выделяется бесцветный газ
Zn или Mg стоят левее водорода в ряду напряжений, поэтому реагируют с соляной кислотой с выделением водорода.
Изменений не происходит
Медь стоит правее водорода в ряду напряжений, поэтому реакция не идёт.
Чёрный порошок растворяется, образуется раствор синего цвета.
Реагирует с основными оксидами.
Синий осадок растворяется, образуется раствор синего цвета.
Реагирует с нерастворимыми основаниями.
Выделяется бесцветный газ.
Реагирует с солями слабых кислот
3. Распознавание соляной кислоты и её солей. В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция.во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте. Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты. Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)? Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
Распознавание соляной кислоты её солей
Прилили раствор нитрата серебра
Взаимодействие с нитратом серебра является качественной реакцией на хлорид-ионы.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Отличить а) и б) можно, применяя раствор нитрата серебра (I), потому что образовывается нерастворимый в концентрированной азотной кислоте белый осадок — хлорид серебра (I).
в) применить индикатор и щёлочь, при этом изменится цвет индикатора из кислотной среды в нейтральную в случае соляной кислоты.
Заменить раствор серебра (I) нитратом свинца можно, потому что идёт такая же качественная реакция с образованием белого осадка, но он растворяется в азотной кислоте.
Практическая работа №7. Получение соляной кислоты и изучение ее свойств (химия 8 класс)
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Химия 8 класс Практическая работа№7.
Получение соляной кислоты и изучение ее свойств
Цель работы: сформировать навыки решения экспериментальных задач и планирования эксперимента; закрепить знания о свойствах соляной кислоты; совершенствовать умения обращаться с кислотами; научить способам распознания соляной кислоты и ее солей; формировать навыки работы с реактивами, составлять уравнения реакций, наблюдать и делать выводы.
Планируемые результаты: уметь применять полученные теоретические знания о свойствах соляной кислоты в практических работах, проводить опыты по осуществлению реакций в соответствии с правилами пользования химической посудой и правилами безопасного обращения с химическими веществами, описывать свойства веществ и наблюдения в ходе эксперимента.
2.Актуализация опорных знаний.
Учащиеся называют правила техники безопасности при проведении практических работ. Учитель напоминает основные правила ТБ (при работе с кислотами и щелочами и др.).
3.Выполнение практической работы.
Учитель объясняет принципы оформления результатов практической работы в тетрадях: следует написать план опыта, свои наблюдения, соответствующие уравнения реакций и сделать выводы.
Отчет о работе оформите в виде таблицы:
1.Получение соляной кислоты и опыты с ней
2.Химические свойства соляной кислоты
Практическая работа № 4. Получение и свойства карбоновых кислот. ГДЗ Химия 10-11 класс Цветков.
Помогите мне с ответами
1. Поместите в пробирку 3—4 г ацетата натрия и прибавьте примерно 2—3 мл раствора серной кислоты (1:1). Пробирку закройте пробкой с газоотводной трубкой, свободный конец которой опустите в пустую пробирку (рис. 65). Нагревайте смесь веществ на пламени до тех пор, пока в пробирке-приемнике соберется 1—2 мл жидкости. Обратите внимание на запах уксусной кислоты.
2. Собранную кислоту разделите на две части. Одну часть испытайте раствором лакмуса и нейтрализуйте раствором щелочи. Вторую часть разбавьте немного водой и в полученный раствор поместите кусочек ленты или порошок магния. Что наблюдаете? Составьте уравнения реакций.
3. Проделайте реакции уксусной кислоты с каким-либо оксидом мталла и солью.
4. Проверьте, окисляется ли муравьиная кислота аммиачным раствором оксида серебра (I). Составьте уравнение реакции.
5. Приготовьте в пробирке при нагревании водный раствор обыкновенного хозяйственного мыла (настрогав его немного для этой цели в виде тонких стружек).
6. Налейте в пробирку 2—3 мл раствора мыла и прибавьте к нему соляной кислоты до образования хлопьев. Что собой представляет этот осадок? Составьте уравнение реакции. Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
7. К 2—3 мл раствора мыла в пробирке прилейте раствор хлорида кальция. Что наблюдаете? Напишите уравнение реакции. Какое свойство мыла иллюстрируется данным опытом?
8. Докажите опытным путем, что олеиновая кислота является кислотой непредельной.