В состав чего входит фосфор
Фосфор (P, Phosphorus)
История фосфора
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.
Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
Физические и химические свойства
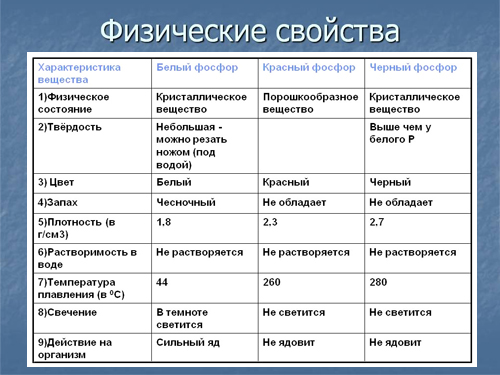
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.
Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Фосфор (Р) – роль в организме, применение, суточная потребность, источники
Фосфор (Phosphorus, Р) – химический элемент, который играет важную роль макроэлемента в организме человека и берет непосредственное участие в формировании, развитии и поддержании здоровья сердечно-сосудистой системы, головного мозга и опорно-двигательного аппарата.
Основными функциями фосфора также являются – превращение жиров, углеводов, передача нервных импульсов, синергичная работа с кальцием в формировании костного скелета и зубов. Данный элемент входит в состав фосфолипидов, белков, ДНК и АТФ, в связи с чем по праву имеет титул – «элемент жизни».
В чистом виде Р из-за высокой химической активности практически не встречается, тем не менее, он участвует в образовании около 190 минералов, наиболее популярными из которых являются – апатит и фосфорит. По расчётам ученых, масса земной коры на 0,08-0,09% состоит из фосфора.
История – краткая справка
Свое название фосфор получил от двух древнегреческих слов «φῶς» (свет), и «φέρω» (несу), объеденив которые получаем – светоносный.
Впервые о существовании фосфора заявил в 1669 году немецкий алхимик из г. Гамбург – Хеннинг Бранд (Hennig Brandt). Получил же Бранд совершенно случайно – когда пытался добыть золото из человеческой мочи. Конечно, логика у людей тех времен была уникальна – раз моча золотистая, значит в ней может присутствовать золото. В результате многодневного отстаивания, а после длительного выпаривания мочи, вместо жидкости в емкости остались белые воскоподобные частички непонятного вещества, которые могли ярко гореть и мерцать в темноте. Нововыявленное вещество Х.Бранд назвал «чудотворным носителем света» (phosphorus mirabilis).
Далее, Р смогли добыть — немецкий химик Иоганн Кункель (Johannes Kunckel), в 1680 г. англо-ирландский химик и физик Роберт Бойль (англ. Robert Boyle), в 1743 г. немецкий химик Андреас Маргграф (Andreas Marggraf) и другие.
Получить красный фосфор сумел в середине XIX в — А.Шрёттер, что произошло при нагревании белого фосфора без контакта с кислородом.
Общие данные
Расположение в периодической таблице Д.И. Менделеева: в старой версии — III период, III ряд, V группа, в новой версии таблицы – 15 группа, 3 период.
Физико-химические свойства. Фосфор известен во многих модификациях – белый, красный, желтый, черный, металлический и др., которые еще называются аллотропными. Физические и химические свойства напрямую зависят от его формы, особенно его химическая активность.
Белый фосфор – химически активное вещество белого цвета с легкой желтизной или зеленоватостью, схожее на парафин, легко поддается деформации при небольших физических усилиях. Плохо растворим в воде, при контакте с кислородом и светом начинает светиться бледно-зеленым цветом. Небольшое воздействие температуры способно привести к самовозгоранию вещества. Очень ядовит – попадание внутрь всего 0,05-0,15 г вещества может привести к летальному исходу. При контакте с кожей также способен самовоспламеняться, после чего оставляет сильные ожоги.
Красный фосфор – более устойчивая форма элемента к термическому воздействию, которую получают из его белой формы. Окрашен в красные, фиолетовые цвета с металлическим отблеском. Не растворяется в воде, не светится в темноте, способен самопроизвольно загореться при ударе или трении. Ядовитость в тысячи раз меньше по сравнению с белым. Применяется при изготовлении спичечных коробков – входит в состав терочной поверхности.
Биологическая роль фосфора в организме
В организме фосфор присутствует в виде ортофосфорной и пирофосфорной кислот. Этот элемент входит в состав фосфолипидов, АТФ (аденозинтрифосфорная кислота), нуклеиновых кислот (ДНК, РНК), фосфопротеидов, нуклеотидов, различных ферментов и коферментов. В костях человека Р находится в форме гидроксилапатита, в зубной эмали – в виде фторапатита.
В целом, 1% массы тела человека припадает на фосфор в тех или иных формах, из которых около 85% элемента содержится в составе костей из зубов.
Регулирование метаболизма фосфорных соединений производят витамин D и гормоны.
Фосфор выполняет множество важных и полезных функций, среди которых:
Применение фосфора в других сферах человеческой жизни
Суточная потребность
Рекомендуемые суточные дозы фосфора в зависимости от пола и возраста:
| Дети | до 1 года | 100-275 мг |
| От 1 до 3 лет | 460-3000 мг | |
| От 3 до 9 лет | 500-3000 мг | |
| Подростки | от 9 до 18 лет | 1250—4000 мг |
| Взрослые | от 18 до 70 лет | 700-4000 мг |
| Лица преклонного возраста | старше 70 лет | 700-3000 мг |
| Во время беременности | до 3000—3500 мг |
Для максимальной эффективности усваивания организмом фосфора его необходимо одновременно употреблять с кальцием, в соотношении – 1,5 (Р) : 1 (Са).
Суточная доза фосфора повышается при обильных физических нагрузках, занятиях спортом.
Нехватка фосфора — симптомы
Дефицит фосфора в организме (гипофосфатемия) дает о себе знать, когда его количество в сыворотке крови составляет 0,81-0,32 ммоль/л и меньше. Это может вызвать ряд осложнений со здоровьем, среди которых:
Причины нехватки фосфора
Применение фосфора в медицине
Применение Р с лечебной целью целесообразно в следующих случаях:
В качестве препаратов фосфора чаще всего применяют биофосфонаты («Этидронат»), «Кальция глицерофосфат».
Избыток фосфора
Избыток фосфора в организме (гиперфосфатемия) также, как и нехватка может вызвать ряд осложнений со здоровьем, среди которых:
Причины переизбытка фосфора
Источники фосфора
В каких продуктах содержится фосфор больше всего?
Химические источники (Р): «Этидронат», «Кальция глицерофосфат», «Фосален», витаминно-минеральные комплексы «Витрум», пищевые добавки Е338, Е339, Е340, Е341, Е342, Е343.
Взаимодействие фосфора с другими веществами
Избыточное количество в организме алюминия, кальция, магния, железа, эстрогенов, андрогенов и тироксина понижают усвояемость фосфора, а также его полную активность;
Прием Р в сочетании с кальцием (пропорция 1,5 Р к 1 Са) взаимодополняют друг друга, тем самым повышая свою активность.
Повышенное количество витамина D способствует переизбытку фосфора, однако, недостаток D приводит к недостатку Р.
При воздействии кислорода — Р легко окисляется.
Видео
Фосфор. Химия фосфора и его соединений
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Серная кислота также окисляет фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Или с гидроксидом кальция:
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Способы получения фосфидов
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Фосфид магния разлагается соляной кислотой:
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Еще пример : фосфористая кислота окисляется соединениями ртути (II):
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Фосфат кальция растворяется под действием серной кислоты:
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Фосфат кальция также восстанавливается алюминием при сплавлении:
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия: