В состав чего входит гемоглобин
В состав чего входит гемоглобин
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2.
Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
В состав чего входит гемоглобин
Гемоглобин – белок, содержащийся в эритроцитах и осуществляющий обмен кислорода между легкими и тканями организма. Имеет в своем составе железо. Также он обуславливает цвет крови.
Синонимы английские
Hemoglobin, Haemoglobin, Haemoglobin concentration, Hb, Hgb.
Какой биоматериал можно использовать для исследования?
Общая информация об исследовании
Измеряется количество гемоглобина, содержащегося в эритроцитах белка, который доставляет кислород к тканям и органам, а углекислый газ – от тканей и органов к легким, где он выдыхается.
Это происходит за счет того, что кислород способен связываться железом, атомы которого «встроены» в гемоглобин. «Подходя» к тканям, эритроциты освобождаются от кислорода и забирают «отработанный» диоксид углерода (углекислый газ).
Гемоглобин состоит из аминокислот, образующих белковый комплекс глобин, и гема, содержащего железа. Образование глобина и гема у некоторых людей может нарушаться, что грозит анемией.
Сниженный уровень гемоглобина, скорее всего, свидетельствует об анемии – состоянии, при котором организм не получает достаточно кислорода, что вызывает слабость и быструю утомляемость.
Гемоглобин повышается при увеличении количества эритроцитов и снижается, соответственно, если их становится меньше.
Снижение количества эритроцитов может происходить из-за уменьшения их образования в костном мозге, их потери в результате кровотечения или разрушения внутри организма.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
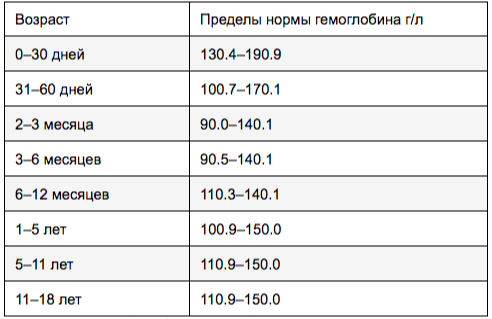
Возраст
Гемоглобин, г/л
Причины изменения уровня гемоглобина
Уровень гемоглобина выше у мужчин, так как андрогены стимулируют образование эритроцитов.
Причины повышения уровня гемоглобина:
Причины понижения уровня гемоглобина:
Что может влиять на результат?
Повышенный уровень гемоглобина наблюдается:
Уровень гемоглобина понижен:
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, нефролог, хирург.
Гемоглобин
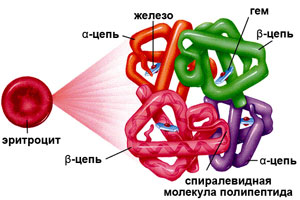
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
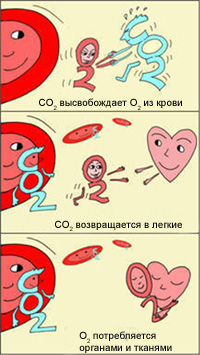
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Что надо знать о гемоглобине и как он влияет на самочувствие
Материал прокомментировал и проверил Иван Ромасов, врач-терапевт и кардиолог сети клиник «Семейная»
Что такое гемоглобин
Гемоглобин — белок из красных кровяных телец, переносящий по организму железо. Оно удерживает кислород, необходимый для всех функций организма. На уровень гемоглобина влияют различные факторы, включая возраст, пол и возможные заболевания.
Отклонение от нормы в показателях — признак множества диагнозов, хотя у некоторых пациентов это индивидуальная особенность. Поэтому только врач может определить, требует ли коррекции каждый конкретный случай [1].
Когда стоит сдать анализ на гемоглобин
Главная функция гемоглобина — дыхательная. При его нехватке может происходить гипоксия — кислородное голодание. Обычно анализ крови на гемоглобин назначают при общем обследовании и диспансеризации либо для отслеживания реакции организма на лечение и назначенные препараты.
Это один из базовых показателей при любом течении болезней. Кроме того, гемоглобин важно отслеживать в период беременности. Если вы заметили у себя следующие симптомы, запишитесь к терапевту, который назначит сдачу анализа крови:
Контроль уровня гемоглобина позволяет выявить многие опасные заболевания на ранних стадиях, чтобы скорее приступить к лечению. К тому же длительные отхождения от нормы показателей крови могут привести к серьезным осложнениям. Например, независимо от причин повышения гемоглобина, увеличивается гематокрит — объем красных кровяных телец — в результате чего снижается проходимость тонких капилляров, ухудшается питание всех органов и тканей организма. Этот процесс влияет на ухудшение иммунитета, появление отечности и замедление процессов регенерации.
Нормы гемоглобина
Норма для мужчин — не менее 130 г гемоглобина на 1 л крови, для женщин — не менее 120 г/л [2]. У пожилых людей уровень гемоглобина может быть ниже из-за хронических воспалений, недостаточного питания и побочных эффектов от принимаемых лекарств. У младенцев эти показатели выше, чем у взрослых, потому что им нужно больше кровяных телец для транспортировки кислорода. По мере взросления уровень гемоглобина меняется, достигая стандартных показателей к 18 годам.
Повышенный гемоглобин
Высокий уровень гемоглобина обычно сопровождает повышение эритроцитов. Чем больше красных кровяных телец, тем больше гемоглобина, и наоборот. Высокие показатели часто указывают на возможные заболевания и проблемы со здоровьем.
Высокие показатели гемоглобина также встречаются в результате курения, нарушения чувствительности к кислороду, недавнего переливания крови. Основными симптомами могут быть головная боль, непроходящие синяки, кровотечения, потливость, аномальная потеря веса, желтоватый оттенок белка глаз и отечность суставов.
Низкий гемоглобин
Низкий уровень гемоглобина обычно наблюдается при недостатке эритроцитов. Его причины:
Симптомы низкого гемоглобина включают в себя бледность кожи, одышку, учащенное сердцебиение, опухание конечностей.
Гемоглобин А1с
При сдаче анализа крови можно посмотреть результаты на гемоглобин A1c (HbA1c), его называют гликированным. Это гемоглобин, к которому присоединена глюкоза. Врачи часто назначают тест HbA1 пациентам с диабетом. Он помогает получить более четкую картину среднего уровня глюкозы в крови в течение двух-четырех месяцев. Глюкоза, также называемая сахаром в крови, циркулирует по ней и присоединяется к гемоглобину. Чем больше глюкозы в крови, тем вероятнее, что у вас повышенный уровень гликозилированного гемоглобина. Глюкоза остается прикрепленной к гемоглобину около 120 дней.
Высокий уровень HbA1c указывает на то, что уровень сахара в крови был высоким в течение нескольких месяцев. В большинстве случаев больным диабетом следует стремиться к уровню HbA1c не более 7%. У людей без диабета уровень HbA1c обычно составляет около 5,7%. Если у вас диабет и высокий уровень HbA1c, возможно, вам потребуется изменить схему приема лекарств.
Когда надо обратиться к врачу
Помимо систематического обследования и тревожных симптомов, тест на гемоглобин есть смысл проводить, если:
Чем раньше будут выявлены аномальные уровни гемоглобина, тем лучше. Это повысит шансы на успешное лечение.
Как повысить гемоглобин
После консультации с врачом вам могут назначить препараты для повышения гемоглобина. В любом случае определить отклонения от нормы может только врач. Он же подберет лечение, исходя из индивидуальных особенностей пациента. Не пытайтесь исправить ситуацию с помощью продуктов, если анализы показали серьезное повышение или понижение уровня гемоглобина.
Терапевт может назначить добавки, содержащие железо. Крайне важно соблюдать прописанную дозу, потому что переизбыток вещества приводит к гемохроматозу, следствием которого становятся заболевания печени и ЖКТ. Управление пищевых добавок Национального института здравоохранения рекомендует мужчинам получать до 8 мг железа в день, а женщинам — до 18 мг в день [3]. Дозировка для беременных женщин может быть увеличена до 27 мг в день. Улучшение самочувствия и показателей крови отмечают в срок от одной недели до месяца с начала приема препаратов.
Продукты, повышающие гемоглобин
Если у врача нет особых рекомендаций, можно поддерживать уровень гемоглобина, употребляя пищу с высоким содержанием железа и фолиевой кислоты. Эти продукты не могут считаться полноценной заменой препаратам, но станут хорошим дополнением для сбалансированного разнообразного рациона:
Учитывайте, что железо в основном содержится в мясе и субпродуктах. Несмотря на то что содержание железа в шпинате достигает 3,8 мг на 100 г, съесть такое количество зелени за день довольно сложно. Для сравнения: в 100 г печени содержится 6,9 мг железа, а это 49% от дневной нормы.
Фолиевая кислота — витамин группы B, который организм использует для производства части красных кровяных телец, содержащей гемоглобин. Без достаточного количества фолиевой кислоты эритроциты не созревают. Это может привести к анемии и низкому уровню гемоглобина. Компенсировать недостаток фолиевой кислоты помогут определенные продукты:
Что влияет на усвояемость железа
Важный вопрос, насколько хорошо железо усваивается организмом. Самый простой вариант улучшить этот показатель — употреблять богатые микроэлементом продукты с добавлением витамина С. Например, заправить салат лимонным соком, добавить в него побольше темной листовой зелени или клубники. Витамин А также участвует в процессах усвоения железа. Он содержится в продуктах животного происхождения — рыбе и печени, а также в сливочном и растительном масле.
Учитывайте, что кальций ухудшает усвояемость железа. Это не значит, что нужно исключить богатые им молочные продукты, инжир, семена и соевые бобы. Но постарайтесь есть их отдельно от добавок железа, назначенных врачом. И наоборот — не ешьте железосодержащие продукты незадолго до и после употребления кальция. Еще одно вещество, ухудшающее всасываемость железа, — фитиновая кислота, которая содержится в грецких и бразильских орехах, кунжуте.
Комментарий эксперта
Иван Ромасов, врач-терапевт и кардиолог сети клиник «Семейная»
Различают три вида гемоглобина:
Также есть четыре формы гемоглобина:
Недостаток гемоглобина во время беременности может грозить осложнениями ее течения, а также задержками в развитии ребенка впоследствии. Что касается посещения врача, то не любое плохое самочувствие требует сдачи общего анализа крови — только затяжной астенический синдром, не объясняемый другими причинами.
Снижение уровня гемоглобина всегда требует приема медикаментозных препаратов. Изменение вторичных лабораторных показателей по типу объема эритроцитов или насыщения их гемоглобином на первом этапе можно корректировать только изменением питания. При снижении уровня гемоглобина ниже лабораторной нормы всегда требуется прием препаратов железа, а включение в диету железосодержащих продуктов (в первую очередь мяса и субпродуктов) позволяет лишь закрепить результаты лечения.
Ни в коем случае нельзя принимать препараты без назначения. Это может грозить серьезными осложнениями — сидерозом внутренних органов, то есть отложением в них солей железа. Но если препараты прописал врач, то следуйте его инструкциям.
Единственное побочное действие, которое часто наблюдается при приеме прописанных препаратов железа, — проблемы с пищеварением. Объясняется это тем, что наиболее часто в состав данных лекарств входит аскорбиновая кислота, раздражающая слизистую оболочку желудочно-кишечного тракта. Люди часто бросают прием препаратов, столкнувшись с данными проблемами, потому что не знают, что их можно скорректировать. К тому же существуют новые поколения препаратов, у которых данных побочных действий не возникает. Когда нужно быстро поднять уровень гемоглобина (например перед проведением плановой операции при выраженной анемии), используют внутривенные инфузии препаратов железа, но данный процесс проходит только под наблюдением врача.
ГЕМОГЛОБИН
ГЕМОГЛОБИН, Hb (haemoglobinum; греч. haima кровь + лат. globus шарик),— гемопротеид, сложный белок, относящийся к гемсодержащим хромопротеидам; осуществляет перенос кислорода от легких к тканям и участвует в переносе углекислого газа от тканей в органы дыхания. Гемоглобин содержится в эритроцитах всех позвоночных и некоторых беспозвоночных животных (черви, моллюски, членистоногие, иглокожие), а также в корневых клубеньках некоторых бобовых растений. Мол. вес (масса) Гемоглобина эритроцитов человека равен 64 458; в одном эритроците находится ок. 400 млн. молекул Гемоглобина. В воде Гемоглобин хорошо растворим, нерастворим в спирте, хлороформе, эфире, хорошо кристаллизуется (форма кристаллов Гемоглобина различных животных неодинакова).
В состав Гемоглобина входит простой белок— глобин и железосодержащая простетическая (небелковая) группа — гем (96 и 4% от массы молекулы соответственно). При pH ниже 2,0 происходит расщепление молекулы Гемоглобина на гем и глобин.
Содержание
Гем (C34H32O4N4) представляет собой железопротопорфирин— комплексное соединение протопорфирина IX с двухвалентным железом. Железо находится в центре протопорфиринового ядра и связано с четырьмя атомами азота пиррольных ядер (рис. 1): две связи координационные и две связи с замещением водорода.
Глобин
Глобин — белок типа альбуминов, содержит в своей молекуле четыре полипептидные цепи: две альфа-цепи (в каждую из которых входит по 141 аминокислотному остатку) и две бета-цепи, содержащие по 146 остатков аминокислот. Т. о., белковый компонент молекулы Г. построен из 574 остатков различных аминокислот. Первичная структура, т. е. генетически обусловленная последовательность расположения аминокислот в полипептидных цепях глобина человека и ряда животных, полностью изучена. Отличительной особенностью глобина человека является отсутствие в его составе аминокислот изо лейцина и цистина. N-концевыми остатками в альфа- и бета-цепях являются остатки валина. C-концевые остатки альфа-цепей представлены остатками аргинина, а бета-цепей — гистидина. Предпоследнее положение в каждой из цепей занимают остатки тирозина.
Рентгеноструктурный анализ кристаллов Г. позволил выявить основные особенности пространственной структуры его молекулы [Перутц (М. Perutz)]. Оказалось, что альфа- и бета-цепи содержат спиральные сегменты различной длины, которые построены по принципу альфа-спиралей (вторичная структура); альфа-цепь имеет 7, а бета-цепь — 8 спиральных сегментов, соединенных неспиральными участками. Спиральные сегменты, начиная с N-конца, обозначаются буквами латинского алфавита (А, В, С, D, E, F, G, Н), а неспиральные участки или углы поворота спиралей имеют соответствующее обозначение (АВ, ВС, CD, DE и т. д.). Неспиральные участки на аминном (N) или карбоксильном (С) конце цепи глобина обозначают соответственно NA или НС. Аминокислотные остатки нумеруются в каждом сегменте и, кроме того, в скобках дается нумерация данного остатка от N-конца цепи.
Спиральные и неспиральные участки определенным образом уложены в пространстве, что определяет третичную структуру цепей глобина. Последняя почти идентична у альфа- и бета-цепей Г., несмотря на значительные различия в их первичной структуре. Это обусловлено специфическим расположением полярных и гидрофобных групп аминокислот, приводящим к скоплению неполярных групп во внутренней части глобулы с образованием гидрофобного ядра. Полярные группы белка обращены к водной среде, находясь с ней в контакте. Внутри каждой цепи глобина недалеко от поверхности находится гидрофобная впадина («гемовый карман»), в к-рой располагается гем, ориентируясь так, что его неполярные заместители направлены во внутрь молекулы, входя в состав гидрофобного ядра. В результате возникает ок. 60 неполярных контактов между гемом и глобином и один-два полярных (ионных) контакта гема с альфа- и бета-цепями, в которых участвуют остатки пропионовой к-ты гема, выходящие наружу из гидрофобного «кармана». Расположение гема в гидрофобной впадине глобина обеспечивает возможность обратимого присоединения кислорода к Fe 2+ гема без окисления последнего до Fe 3+ и характерно для гемоглобинов различных видов животных. Подтверждением этого является крайняя чувствительность Г. к любым изменениям неполярных контактов вблизи гема. Так, замена гема в Г. на гематопорфирин приводит к резкому нарушению свойств Г.
Некоторые аминокислотные остатки, окружающие гем в гидрофобной впадине, относятся к числу инвариантных аминокислот, т. е. аминокислот, одинаковых для различных видов животных и существенных для функции Г. Среди инвариантных аминокислот большое значение отводится трем: остаткам гистидина, так наз. проксимальным гистидинам (87-я позиция в а- и 92-я позиция в P-цепях), дистальным гистидинам (58-я позиция в а- и 63-я позиция в (5-цепях), a также остатку валина Е-11 (62-я позиция в альфа-цепи и 67-я позиция в бета-цепи).
Связь между так наз. проксимальным гистидином и железом гема является единственной хим. связью между ними (реализуется пятая координационная связь атома Fe 2+ гема) и непосредственно влияет на присоединение кислорода к гему. «Дистальный» гистидин непосредственно не связан с гемом и участия в фиксировании кислорода не принимает. Его значение состоит в стабилизации атома Fe 2+ против необратимого окисления (по-видимому, за счет образования водородной связи между кислородом и азотом). Остаток валина (Е-11) является своего рода регулятором скорости присоединения кислорода к гемам: в бета-цепях он стерически расположен так, что занимает то место, куда должен присоединиться кислород, вследствие чего оксигенация начинается с фльфа-цепей.
Белковая часть и простетическая группа молекулы Г. оказывают друг на друга сильное влияние. Глобин изменяет многие свойства гема, придавая ему способность к связыванию кислорода. Гем обеспечивает устойчивость глобина к действию к-т, нагреванию, расщеплению ферментами и обусловливает особенности кристаллизационных свойств Г.
Полипептидные цепи с присоединенными к ним молекулами гема образуют четыре основные части — субъединицы молекулы Г. Характер соединения (укладки) их между собой ц расположение в пространстве определяют особенности четвертичной структуры Г.: а- и P-цепи располагаются по углам тетраэдра вокруг оси симметрии, причем альфа-цепи лежат поверх p-цепей и как бы втискиваются между ними, а все четыре гема далеко удалены друг от друга (рис. 3). В целом образуется тетрамерная сфероидная частица с размерами 6,4 X 5,5 х 5,0 нм. Четвертичная структура стабилизирована солевыми связями между α—α- и β-β-цепями и двумя видами контактов между α и β-цепями (α1-β1 и α2-β2). Контакты α1-β1 наиболее обширны, в них участвуют 34 аминокислотных остатка, большинство взаимодействий неполярно. Контакт α1-β2 включает 19 аминокислотных остатков, большинство связей также неполярно, за исключением нескольких водородных связей. Все остатки, находящиеся в этом контакте, одинаковы у всех изученных видов животных, в то время как 1/3 остатков в α1-β1-контактах варьирует.
Фетальный Г. заменяется на HbA в первые месяцы после рождения. Он характеризуется значительной устойчивостью к тепловой денатурации, на чем основаны методы определения его содержания в крови.
В зависимости от состава полипептидных цепей перечисленные типы Г. обозначаются следующим образом: HbA — как Hbα2β2, HbA2 — как Hbα2σ2, a HbF — как Hbα2γ. При врожденных аномалиях и заболеваниях кроветворного аппарата появляются аномальные типы Г., напр, при серповидноклеточной анемии (см.), талассемии (см.), врожденной метгемоглобинемии неэнзиматического происхождения (см. Метгемоглобинемия) и др. Наиболее часто встречается замещение единственной аминокислоты в одной паре полипептидных цепей.
Метгемоглобин обладает способностью прочно связывать фтористый водород, синильную к-ту и другие вещества. Этим его свойством пользуются в мед. практике для спасения людей, отравленных синильной к-той. Различные производные Г. различаются по спектрам поглощения (табл.).