дисплазия кроветворения что это
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Миелодиспластический синдром: причины, симптомы, лечение
Термин « миелодиспластический синдром » (сокращённо МДС) объединяет различные патологии, при которых обнаруживаются цитопения (понижение концентрации форменных элементов крови), дисплазия (неправильное развитие) гемоцитобластов (предшественников кровяных клеток), гипоклеточность или гиперклеточность костного мозга.
МДС встречается достаточно редко – 3-5 случаев на 100 тысяч населения. Но после 60 лет частота болезни повышается до 20-40 случаев ( https://www.eduherald.ru/pdf/2021/2/20538.pdf ).
Причины болезни
Точные причины МДС пока не удалось установить. Известно, что в 10-20% случаев патология развивается у людей, проходивших лучевую или химиотерапевтическую терапию ( https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer ).
Ученые предполагают, что спровоцировать миелоидный синдром способен также парвовирус В19.
Повышают риск возникновения патологии постоянная работа с некоторыми химическими веществами (пестицидами, бензином, органическими растворителями), неблагоприятная экологическая ситуация, курение, некоторые врожденные и наследственные болезни.
Под влиянием повреждающих факторов в стволовых клетках возникают мутации, которые способствуют развитию МДС. Постепенно они накапливаются, способствуя переходу болезни в лейкоз.
Симптомы патологии
Признаки МДС зависят от того, дефицит каких кровяных клеток испытывает организм.
Выделяют 3 группы клинических проявлений:
У некоторых пациентов в число симптомов миелодиспластического синдрома входят увеличение размеров селезенки (спленомегалия) и печени (гепатомегалия).
Диагностика МДС
Основной метод диагностики миелодиспластического синдрома – исследование крови. При МДС возможно понижение как одного показателя, так и их комбинация. Диагноз ставят только при устойчивой (не менее полугода) цитопении, если не найдены другие причины.
Если возникает подозрение на миелодиспластический синдром, делают трепанобиопсию и пункцию костного мозга. Полученный биоматериал подвергают гистологическому и цитологическому исследованию.
Чтобы исключить другие причины цитопении, пациента направляют на дополнительные лабораторные и инструментальные исследования, которые могут включать:
Цитопения сопровождает различные заболевания. Поэтому важно исключить другие причины: рак, аутоиммунные заболевания, хронические инфекции, нарушение гемопоэза, отравление бензином или тяжелыми металлами, нехватку меди, избыток цинка, побочное действие лекарств.
Чтобы дифференцировать миелодиспластический синдром от миелоидного лейкоза, определяют число бластных клеток. Согласно ВОЗ, если показатель превышает 20%, то диагностируют острый лейкоз ( https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer ).
Лечение МДС
Выбор способа лечения зависит от степени и прогрессирования цитопении, группы риска, имеющихся сопутствующих заболеваний.
Единственный действенный метод лечения, обеспечивающий лечение , – пересадка костного мозга.
Выделяют 3 основные способа лечения:
o Чтобы купировать либо предотвратить кровоточивость, прибегают к трансфузии тромбоцитов.
o При гипопластическом типе кроветворения эффективное действие оказывают иммунодепрессанты, которые защищают костный мозг от иммунной атаки.
В клинике Спиженко лечение подбирают индивидуально для каждого пациента в соответствии с международными рекомендациями и утвержденными протоколами.
Дисплазия кроветворения что это
Часть 1. История вопроса, FAB-классификация, патогенез.
(лекция для врачей и студентов)
В конце 30-х, начале 40-х годов ХХ столетия внимание исследователей привлекла группа заболеваний проявляющихся анемией, рефрактерной к какой-либо терапии. Больные с такой патологией не отвечали на лечение препаратами железа, витаминами группы В и фолиевой кислотой, что дало основание использовать для обозначения данной болезни термина «рефрактерная анемия». В отечественной литературе эти заболевания обычно рассматривылись под термином «ахрестические анемии».
Дальнейшие исследования позволили выявили у больных с резистентной к терапии анемией, как с увеличением количества бластных клеток в костном мозге, так и без, ряд особенностей. Эти особенности касались в первую очередь морфологии костного мозга (нарушение архитектоники ростков гемопоэза, изменения стромальной ткани, признаки дисплазии кроветворных клеток). Кроме того, при выполнении цитогенетического исследования у таких больных часто выявлялись изменение кариотипа гемопоэтических клеток.
Цитогенетическими и ферментными методами была доказана клональная (опухолевая) природа заболевания. Характерной особеностью клеток, происходящих из опухолевого клона, при миелодиспластическом синдроме является их морфологическая и функциональная неполноценность.
Для обозначения данной группы заболеваний был принят термин «миелодиспластический синдром» в рамках которого были описаны пять самостоятельных нозологических форм (заболеваний).
Сегодня общепринятой является классификация МДС разработанная Франко-Америко-Британской исследовательской группой (FAB) и опубликованная в 1982 году. В основе классификации лежат четыре признака:
— количество бластов в костном мозге;
— количество бластов в периферической крови;
— количество атипичных (кольцевидных) сидеробластов в костном мозге;
— количество моноцитов в периферической крови.
Таблица 1. FAB-классификация миелодиспластического синдрома (по Bennett et al., 1982).
а) количество бластов в костном мозге менее 5%
б) количество кольцевых сидеробластов в костном мозге менее 15%
в) количество бластов в периферической крови менее 1%
г) количество моноцитов в периферической крови менее 1х10^9/л
2.Рефрактерная анемия с кольцевыми сидеробластами:
а) количество бластов в костном мозге менее 5%
б) количество кольцевых сидеробластов в костном мозге не менее 15%
в) количество бластов в периферической крови менее 1%
г) количество моноцитов в периферической крови менее 1х10^9/л
3.Рефрактерная анемия с избытком бластов:
а) количество бластов в костном мозге более 5%, но менее 20%
б) количество кольцевых сидеробластов в костном мозге менее 15%
в) количество бластов в периферической крови менее 5%
г) количество моноцитов в периферической крови менее 1х10^9/л
4.Рефрактерная анемия с избытком бластов на стадии трансформации:
а) количество бластов в костном мозге более 20%, но менее 30%
б) количество кольцевых сидеробластов в костном мозге менее 15%
в) количество бластов в периферической крови менее 1%
г) количество моноцитов в периферической крови менее 1х10^9/л
5.Хронический миеломоноцитарный лейкоз:
а) количество бластов в костном мозге менее 20%
б) количество кольцевых сидеробластов в костном мозге любое
в) количество бластов в периферической крови менее 5%
г) количество моноцитов в периферической крови не менее 1х10^9/л
Таблица 2. Частота встречаемости каждого из нозологических вариантов МДС, длительность выживания и вероятность трансформации в острый лейкоз.
частота (%) выживаемость (мес) вероятность(%)
1.Рефрактерная анемия: 25 37 11
2.Рефрактерная анемия с кольцевыми сидеробластами: 18 49 5
3.Рефрактерная анемия с избытком бластов: 28 9 23
4.Рефрактерная анемия с избытком бластов
на стадии трансформации: 12 6 48
5.Хронический миеломоноцитарный лейкоз: 17 22 20
Патогенез. Отправной точкой в развитии МДС является мутация стволовой клетки крови. Потомки мутировавшей клетки получают биологическое преимущество перед нормальными гемопоэтическими клетками, что позволяет им полностью колонизировать костный мозг, вытесняя нормальные гемопоэтические клетки. Особенностью мутации стволовой клетки крови при МДС является частичное сохранение ее потомками способности к созреванию до зрелых клеток крови. Однако, процесс созревания носит неэффективный характер, что приводит к уменьшению количества зрелых клеток в периферической крови. Кроме количественных изменений в составе клеток периферической крови имеет место и снижение их функциональной активности.
Немаловажную роль в развитии патологического клона гемопоэтических клеток играет стромальное микроокружение, однако конкретные механизмы вовлечение стромальной ткани в патологический процесс при МДС изучены еще недостаточно.
Таблица 4. Морфологические признаки дисплазии кроветворения при исследовании аспирата костного мозга (по Bartl R, Frisch B и Baumgart R, 1992).
— большие мегакариоциты с одним или несколькими мелкими круглыми ядрами
— увеличение бластных клеток
— гипо- и гипергранулярность
— базофилия цитоплазмы зрелых клеток
— эозинофилы с кольцевыми ядрами
— моноциты с множественными вытянутыми лопастями цитоплазмы
— афзурофильные гранулы в цитоплазме
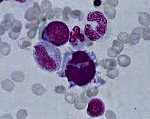
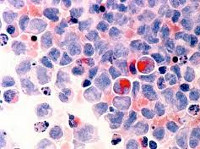
Ниже представлены несколько фотографий, иллюстрирующих морфологические признаки дисплазии кроветворения.
Рисунок 1. Дисплазия эритроидного ростка в костном мозге: мегалобластоидность, асинхронность ядер, тельца Жоли.
Рисунок 2. Дисплазия мегакариоцитарного ростка в костном мозге: микромегакариоцит.
Рисунок 3. Дисплазия гранулоцитарного ростка в костном мозге: значительная редукция числа гранул.
Рисунок 4. Костный мозг больного рефрактерной сидеробластной анемией: кольцевые сидеробласты.
Таблица 5. Гистологические признаки дисплазии кроветворения при исследовании биоптата костного мозга (по Bartl R, Frisch B и Baumgart R, 1992).
Клеточность костного мозга:
— гиперклеточный (свыше 50% случаев)
— нормоклеточный (30-40% случаев)
— гипоклеточный (менее 20% случаев)
— атипичная локализация незрелых предшественников
— атипичная локализация эритроцитарных предшественников
— атипичная локализация мегакариоцитов
— интраваскулярное расположение гемопоэтических клеток
— расширение синусоидов со склерозом стенок
— интростициальный и парамегакариоцитарный фиброз
— увеличение тучных клеток
— увеличение костного преобразования
[an error occurred while processing this directive]
Миелодиспластические синдромы
Миелодиспластические синдромы (МДС) объединяют группу злокачественных опухолевых заболеваний системы кроветворения.
При этих заболеваниях происходит нарушение созревания клеток костного мозга с изменением их строения и функциональных свойств.
Характерной, но не обязательной чертой заболевания является исход в острый лейкоз.
Эпидемиология
Заболеваемость МДС в среднем составляет 3-4 случая на 100 000 населения в год и увеличивается с возрастом.
Заболеваемость мужчин незначительно преобладает над заболеваемостью женщин. МДС в детском возрасте встречается крайне редко.
В 10-15% случаев МДС является осложнением проведенной химиотерапии и облучения по поводу другого онкологического заболевания.
Истинная заболеваемость МДС остается неизвестной. Связано это с бессимптомным течением заболевания у многих больных, трудностями диагностики и др. причинами.
Факторы риска
Известно, что факторы риска развития МДС и острых миелоидных лейкозов схожи.
В детском возрасте основными предрасполагающими факторами развития МДС являются генетические заболевания (синдромы Дауна, Фанкони, нейрофиброматоз, врожденный дискератоз и др.).
Генетическая предрасположенность отмечена и у лиц зрелого возраста, родители которых страдали МДС.
К химическим факторам риска относятся органические соединения (бензин и его производные, пестициды, растворители), а также неорганические (асбест, кварц, мышьяк) вещества.
МДС развивается чаще у курящих по сравнению с некурящими.
Более высокий риск возникновения МДС отмечен у работников сельского хозяйства, текстильной промышленности, лечебных учреждений, операторов машин, у лиц, проживающих вблизи заводов.
Наиболее изученным фактором риска является влияние химиопрепаратов и лучевого лечения. Чаще всего МДС диагностируется у больных, лечившихся по поводу рака молочной железы, множественной миеломы, лимфомы Ходжкина (лимфогранулематоза), неходжкинской лимфомы (лимфосаркомы), мелкоклеточного рака легкого.
Лучше всего МДС изучены у больных лимфомой Ходжкина. Частота развития МДС у этой категории больных колеблется от 1,5 до 10% и зависит от возраста, предшествующего лечения и длительности наблюдения.
Средний период от начала лечения болезни Ходжкина до установления диагноза МДС составляет около 4-6 лет. Убедительных данных об увеличении риска МДС при комбинации химиотерапии и облучения по сравнению с использованием только химиотерапии нет.
Клинические проявления
Признаки и симптомы у больных с МДС неспецифичны. У многих больных на протяжении ряда лет МДС протекает бессимптомно и выявляется лишь при обследовании по поводу других заболеваний.
Анемия (малокровие) является самым частым симптомом МДС и обнаруживается в 85-90% случаев. Большинство жалоб обусловлено выраженностью малокровия. Лейкопения (снижение числа лейкоцитов), отмечаемая у 50% больных, может быть причиной склонности к инфекционным осложнениям. В отдельных случаях повышение температуры может быть симптомом МДС. Иногда больные обращаются к врачу в связи со склонностью к кровотечениям из-за снижения числа тромбоцитов.
Несколько реже имеется увеличение лимфатических узлов. Увеличение, печени и лимфатических узлов при других вариантах МДС встречается редко.
Диагностика
Выявление МДС основывается на обнаружении признаков дисплазии (нарушений формирования ткани) в одном или нескольких ростках кроветворения.
При этом выявленные изменения могут быть чрезвычайно разнообразными. Соотношение нормальных и измененных клеток у разных больных существенно варьируют.
Принято считать клеточные линии (ростки кроветворения) измененными, если число клеток с признаками дисплазии составляет более 10%.
В том случае, если число измененных клеток в костном мозге невелико (менее 10%), для достоверной диагностики МДС необходимо проводить цитогенетическое исследование.
Прогностические факторы
Прогноз (исход) МДС зависит от многих факторов.
Продолжительность жизни и вероятность трансформации (перехода) в острый лейкоз при МДС существенно варьируются.
Самая короткая продолжительность жизни (5-7 месяцев) отмечается у больных МДС, вызванным химиотерапией и облучением. Кроме того, прогноз менее благоприятный у пациентов старше 60 лет, мужского пола и при наличии симптомов интоксикации.
Среди показателей крови к неблагоприятным прогностическим признакам относятся:
Наибольшее прогностическое значение имеет степень опухолевой инфильтрации (поражения) костного мозга. Прогноз менее благоприятный, если число опухолевых клеток в костном мозге превышает 10%. Некоторые выявленные хромосомные изменения также отрицательно сказываются на исходе заболевания.
Лечение
Существует два подхода к лечению МДС:
— радикальный, направленный на достижение и сохранение полной ремиссии,
— нерадикальный, направленный на улучшение качества жизни больных.
При нерадикальном подходе допускается существование (персистирирование) болезни, что принципиально отличает лечение МДС от терапии острых лейкозов.
Методы лечения МДС:
Выбор различных направлений терапии определяется: возрастом больного, наличием донора стволовых клеток, возможностью проведения адекватной сопроводительной терапии, а также эффективностью отдельных препаратов, подобранных с учетом исходных клинико-лабораторных показателей.
Практически с помощью каждого из перечисленных методов терапии возможно достижение полной ремиссии. Препараты, улучшающие качество жизни, успешно используются у больных с благоприятным прогнозом (с длительным сроком жизни и низкой вероятностью развития острого лейкоза).
При благоприятном прогнозе с минимальными проявлениями заболевания можно ограничиться наблюдением за больным, пока показатели крови и костного мозга остаются стабильными.
При выраженном малокровии показано переливание эритроцитарной массы. В ряде случаев необходимо применение ростовых факторов, антитимоцитарного глобулина, индукторов дифференцировки клеток и пр.
При прогрессировании МДС проводится химиотерапия.
У больных с неблагоприятным прогнозом проводится химиотерапия по программам лечения острого миелоидного лейкоза. При невозможности химиотерапии или высоком риске осложнений допустимо использование противоопухолевых препаратов в малых дозах.
Такой подход может позволить улучшить качество жизни больных и провести адекватное лечение в более поздние сроки.
После достижения полной ремиссии и при невозможности проведения аллогенной трансплантации костного мозга может осуществляться аутологичная трансплантация костного мозга или периферических стволовых клеток.
Необходимо подчеркнуть, что единственным методом лечения, позволяющим существенно увеличить продолжительность жизни больных МДС, является аллогенная трансплантация костного мозга или периферических стволовых клеток.
Однако применение аллогенной трансплантации не всегда возможно в связи с пожилым возрастом большинства больных и отсутствием идентичного родственного донора.
До настоящего времени результаты лечения больных МДС остаются неудовлетворительными.
В связи с этим практически не существует общепринятых стандартов лечения, а определены лишь общие подходы к терапии для разных групп больных при разных вариантах заболевания.