для чего фиксируют мазки микробиология
Для чего фиксируют мазки микробиология
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.

Окрашенные мазки. Отбор материала для микроскопии
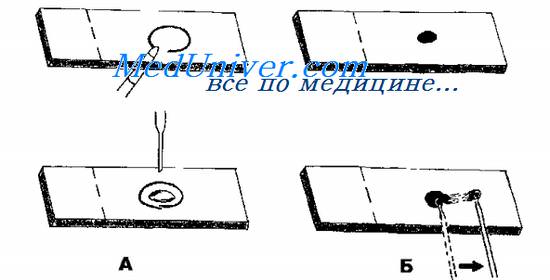
Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 11-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 11-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 11-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 11-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 11-10, Б).
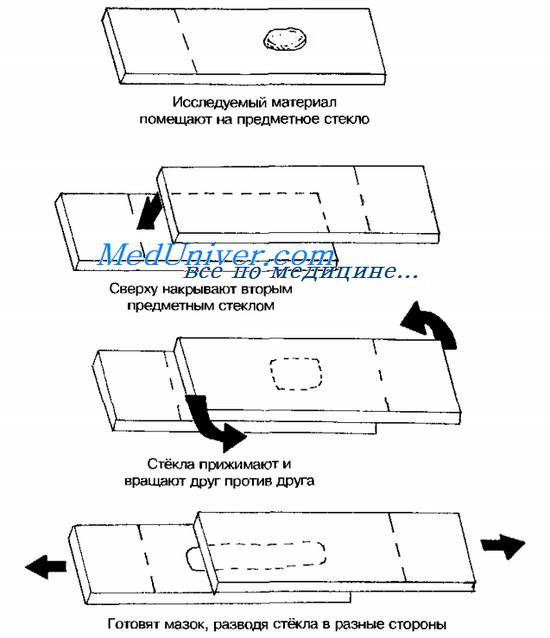
Фиксация препарата. Фиксация мазка. Фиксация бактерий
В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светоопти-ческой микроскопии используют формалин, спирты, глутараль-дегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др.
Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
6.2. Микроскопия микроорганизмов в окрашенном виде
Тела микробных клеток в преобладающем большинстве случаев прозрачны и для того, чтобы увидеть четкие контуры микробных клеток, применяют метод биологического окрашивания.
Окрашенные тела микроорганизмов, отчетливо выделяясь на серебристо-белом фоне препарата, позволяют ориентировочно оценивать состав микробного пейзажа, изучаемого объекта; при применении специальных методов окраски исследуют некоторые анатомические структуры клетки: наличие капсул, спор, жгутиков, ядерного вещества, мембраны и т. д.
В качестве основных красок в микробиологии используют производные каменноугольной смолы, главным образом искусственные органические красители, получаемые из анилина (С6Н5NН2,), его производных и других ароматических аминов, ряда нафталина и антрацена.
В табл. 6.1 представлены наиболее употребляемые красители катионной и анионной групп.
Таблица 6.1. Наиболее употребляемые красители катионной и анионной групп
Нигрозин (индийские чернила)
Из сухих анилиновых красок готовят обычно насыщенные спиртовые растворы, которые, не изменяя своих свойств, могут храниться длительное время. Из насыщенных спиртовых растворов для окрашивания бактерий изготавливаются рабочие, разбавленные спиртовые растворы нужной концентрации.
Для окрашивания микроорганизмов пользуются преимущественно основными красителями.
6.2.1. Приготовление мазков для окрашивания
Мазки готовят из культур микробов, клинического материала (мокрота, гной, моча, кровь и др.), из биоптатов, органов трупов.
Техника приготовления мазков определяется характером исследуемого материала.
Для изучения взаимного расположения элементов ткани и находящихся в ней микроорганизмов делают мазки-отпечатки. Для этого вырезанный из середины органа небольшой кусочек ткани захватывают пинцетом и прикладывают поверхностью среза к предметному стеклу последовательно в нескольких участках, получая, таким образом, ряд мазков-отпечатков.
6.2.2. Высушивание и фиксирование мазков
Приготовленный на предметном стекле мазок высушивают на воздухе и после полного высыхания фиксируют. При фиксировании мазок закрепляется на поверхности предметного стекла, и поэтому при последующей окраске препарата микробные клетки не смываются. Кроме того, убитые микробные клетки окрашиваются лучше, чем живые.
Различают физический способ фиксации, в основу которого положено воздействие высокой температуры на микробную клетку, и химические способы, предусматривающие применение химических средств, вызывающих коагуляцию белков цитоплазмы.
Физический способ фиксации. Предметное стекло с препаратом берут пинцетом или I и II пальцами правой руки за ребра мазком кверху и плавным движением проводят 2–3 раза над верхней частью пламени горелки. Весь процесс фиксации должен занимать не более 2 с. Надежность фиксации проверяют следующим простым приемом: свободную от мазка поверхность предметного стекла прикладывают к тыльной поверхности левой кисти. При правильном фиксировании мазка стекло должно быть горячим, но не вызывать ощущения ожога.
Химический способ фиксации. Для фиксации мазков применяют также химические вещества и соединения (табл. 6.2).
Таблица 6.2. Химические вещества и соединения, применяемые для фиксации мазков
МИКРОСКОПИЯ НАТИВНОЙ КРОВИ
Методические указания по МНК
РОССИЙСКИЙ УНИВЕРСИТЕТ ДРУЖБЫ НАРОДОВ
О.О. Анисимова, О.Н. Морылева
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
МИКРОСКОПИЯ НАТИВНОЙ КРОВИ
Для медицинских работников различных специальностей, преподавателей и студентов медицинских вузов
МОСКВА
Утверждено
Редакционно-издательским советом факультета
повышения квалификации медицинских работников
Университета
Методические указания подготовлены
на факультете повышения квалификации
медицинских работников РУДН
Анисимова О.О., Морылева О.Н.
Лабораторная диагностика. Микроскопия нативной крови: методические указания.
В пособии рассматриваются наиболее актуальные вопросы метода микроскопии нативной крови, указания по методике проведения данного исследования и интерпретации его результатов.
Пособие предназначено для медицинских работников различных специальностей, преподавателей и учащихся медицинских образовательных учреждений.
Фотографии нативной крови, наглядно отражающие содержание методических указаний, опубликованы в пособии «Атлас нативной крови».
© Анисимова О.О., Морылева О.Н., 2010
Содержание
Список сокращений
— биологически активные добавки к пище
— биологически активные вещества
— микроскопия нативной крови
— полимеразная цепная реакция
Введение
Кровь – это уникальная субстанция нашего организма. От ее состава и физико-химических свойств зависит здоровье человека. В свою очередь, состояние крови является отражением всех обменных процессов, протекающих в организме, функциональной активности его органов и систем и, конечно же, патологических нарушений в них.
Со времен изобретения Антонием Левенгуком микроскопа, в изучении свойств крови наука прошла большой путь развития. За этот период создано колоссальное количество методов исследования этой важнейшей жидкой среды организма. Различные типы микроскопии, окраски препаратов, цитохимические и радиоизотопные методы, ИФА, ПЦР – это лишь очень неполный перечень существующих на сегодняшний день способов ее изучения. Но наиболее часто в клинической лабораторной практике для исследования крови используется микроскопия окрашенного мазка. Для этого мазок крови предварительно высушивается, фиксируется и окрашивается, а затем производится подсчёт форменных элементов и описывается морфология клеток. Нативную или живую кровь (без фиксации и окраски) микроскопируют достаточно редко. А между тем исследование «живой» капли – самый простой, информативный и минимально затратный метод исследования крови, который известен давно и широко использовался еще в прошлые века. В силу различных обстоятельств, на определенном этапе медицинская практика отошла от повсеместного использования данного метода. Но, как говорится, «все новое – это хорошо забытое старое».
И вот сегодня, в эру компьютеров и цифровых технологий, внимание к методу исследования нативной крови вновь возрастает и приобретает все большую популярность. Микроскоп удалось соединить с цифровой видеокамерой, телевизором и компьютером, что увеличило его разрешающую способность и дало возможность визуализировать на экране объекты крови, трудно различимые в обычный световой микроскоп, и, что очень важно, сохранять изображения для дальнейшей работы. Это позволило не только просматривать клеточные элементы крови, но и оценивать их динамические функциональные характеристики, выявлять биологические контаминанты в плазме, а также производить демонстрацию исследования пациенту. Последнее обстоятельство очень важно, поскольку включение пациента в диагностический процесс и получение им возможности оценки собственного состояния имеет огромное значение для привлечения его к эффективному сотрудничеству с врачом в вопросах восстановления его собственного здоровья.
В тоже время существуют определенные сложности с адаптацией исследования нативной крови к требованиям стандартизации и контроля качества по системе ФСФОК. В практическом же использовании метода возникает ряд вопросов по идентификации визуализируемых объектов вследствие недостаточного количества научно обоснованных данных по интерпретации результатов. Данные методические указания, опирающиеся на фундаментальную теоретическую базу и обширный исследовательский материал[1], в определенной мере восполнят существующий пробел и помогут упорядочить работу.
Вопросы терминологии
Метод исследования нативной крови под микроскопом не является новым в полном смысле этого слова. Обычная световая микроскопия, применяемая в лабораторной практике сегодня, максимально позволяет увеличивать просматриваемые объекты не более чем в 1500 раз. Этого достаточно для просмотра структуры окрашенных препаратов, но не дает возможности оценки динамических процессов в крови. Современная техника позволила модернизировать световую микроскопию и получить значительно больше информации о визуализируемых объектах. Но суть метода от этого не поменялась. Тем не менее целый ряд практикующих сегодня врачей называет это исследование по-разному: «темнопольник», функциональное гемосканирование и т.д. Эти формулировки ошибочны и затрудняют лицензирование деятельности.
Поэтому обращаем внимание специалистов на тот факт, что в приказах Министерства здравоохранения и социального развития РФ данный метод прописан и значится как микроскопия нативной крови, что полностью согласуется с общепринятой в лабораторной диагностике терминологией и отражает суть данного исследования. Таким образом, исследование под микроскопом капли интактной капиллярной крови в настоящих методических указаниях будет обозначаться в соответствии с официально принятой терминологией, как микроскопия нативной крови или МНК.
Общие вопросы
Метод микроскопии нативной крови подразумевает исследование образца крови сразу после взятия в течение не более 10-15 минут, после чего в крови происходят необратимые изменения. Капельку крови под покровным стеклом изучают сначала обзорно при малом увеличении, затем анализируют морфологию клеток и содержимое плазмы под иммерсией при максимальном увеличении. Важным отличием данного метода от обычных анализов является проведение исследования образца крови без какой-либо его предварительной обработки и в присутствии пациента. Пациент имеет уникальную возможность видеть свои клетки и в процессе исследования получать важнейшую для него информацию.
Перечень необходимого оборудования:
— световой микроскоп с увеличением в 1000-1500 раз с тринокуляром;
— конденсор для темнопольной микроскопии (необходимой опцией не является, т.е. его наличие для работы необязательно);
— адаптированная к микроскопу видеокамера (цифровая или аналоговая) с видеотюнером и S-video-выходом;
— устройство приёма и обработки изображений (компьютер или ноутбук – для приёма и сохранения фотоснимков и видеоизображений и/или телевизор для воспроизведения картинки на экране);
— пакет программного обеспечения.
Методика приготовления препарата
Кровь для исследования берут капиллярную, полученную обычным способом, из безымянного или среднего пальца пациента. Капля крови помещается на идеальное по чистоте, обезжиренное стекло и накрывается покровным стеклом, также тщательно обработанным.
Недопустимо использовать стекла сразу из упаковки без обработки и обезжиривания, а также предварительного визуального контроля на микроскопе при 400-кратном увеличении! Грязь великолепно видна на стекле при темнопольном микроскопировании (ТПМ).
Прокол пальца производится с использованием одноразовых скарификаторов, одноразовых спиртовых и стерильных салфеток с учетом правил санитарно-эпидемиологического режима при работе с кровью.
Капельку крови помещают на середину предметного стекла. Обращаем ваше внимание на то, что первые 1-2 капли нужно снять (их можно расположить на стекле сбоку, поскольку они для исследования не используются). Далее необходимо аккуратно накрыть основную каплю крови покровным стеклом таким образом, чтобы кровь равномерно распределилась под стеклом монослоем. Это очень важный момент для качественного приготовления препарата и получения максимально объективных результатов исследования.
Данный образец помещают на предметный столик микроскопа и просматривают сначала на малом (объективы 4, 10), затем на большом увеличении (объективы 40, 60, 100).
Артефакты
В результате использования некачественно обработанных стёкол, нарушения правил взятия крови и приготовления препарата можно неправильно интерпретировать результаты исследования и сделать ошибочные заключения. Это тем более недопустимо, поскольку анализ проводится в присутствии пациента.
Врач, производящий диагностику, должен учитывать, что предметное стекло, взятое из упаковки, загрязнено (см. фото, Атлас нативной крови). На предметных стёклах, взятых из упаковки, можно наблюдать частички пыли, ворсинки, сколы, нити, слущенный эпителий, жир и т.д.
Предметные стекла для исследования необходимо предварительно эффективно обрабатывать. Для этого они первоначально промываются моющими средствами и тщательно ополаскиваются в проточной воде, после чего помещаются в смесь Никифорова (смесь этилового спирта и эфира). Смесь должна храниться в стеклянной емкости с хорошо притёртой крышкой. Вместо смеси Никифорова можно использовать специальные готовые растворы для обработки предметных стёкол.
Далее стекла натирают нетканными салфетками и перед исследованием тестируют под микроскопом (без иммерсионного масла!).
Аналогичным образом обрабатываются покровные стекла.
Таким образом, подготовка стёкол перед исследованием имеет колоссальное значение для максимально объективной и информативной диагностики.
Клетки крови
В периферической капиллярной крови в норме можно наблюдать три различных группы клеток: эритроциты, лейкоциты и тромбоциты.
Эритроциты
Эритроциты – самая многочисленная популяция клеток крови. Количество эритроцитов в крови в норме поддерживается на постоянном уровне и составляет 3,5–5,0х10 12 в одном литре.
Продолжительность жизни эритроцита человека в среднем 120 суток.
Для описания эритроцитов в клинической лабораторной практике принята специальная терминология. Обозначим сейчас основные наиболее часто встречающиеся термины.
Анизоциты – эритроциты разного размера.
Анизоцитоз – состояние, при котором явно выражена вариация размеров эритроцитов.
Анизохромия – различная окраска эритроцитов.
Гиперхромия – интенсивная окраска эритроцитов, связанная с повышенным насыщением гемоглобином (микропрепарат: отсутствие или уменьшение центрального просветления у эритроцита).
Гипохромия – снижение плотности окраски эритроцитов (микропрепарат: увеличение размера центрального просветления и уменьшение интенсивности окраски эритроцита).
Дакриоциты (каплевидные эритроциты) – эритроциты в виде капли.
Микроциты – эритроциты диаметром менее 6,5 мкм.
Микроцитоз – состояние, при котором преобладают микроциты.
Макроциты – эритроциты диаметром более 8–9 мкм.
Макроцитоз – состояние, при котором преобладают макроциты.
Мегалоциты – эритроциты диаметром более 10–12 мкм.
Монетные столбики – агрегаты эритроцитов.
Нормоцит – двояковогнутый эритроцит нормального размера (7,0–7,8 мкм) с центральным просветлением.
Нормобласт – ядросодержащий эритроцит, клетка – предшественник ретикулоцита. В норме в периферической крови не встречается.
Акантоциты – эритроциты с многочисленными шипиками различной величины.
Мишеневидные эритроциты – клетки с центральным расположением гемоглобина в виде мишени.
Овалоциты – эритроциты овальной формы.
Ретикулоциты – молодые эритроциты без центрального просветления (диаметр 7,7–8,5 мкм), образуются после потери нормобластами ядер.
Сфероциты – эритроциты сферической формы без центрального просветления.
Стоматоциты – эритроциты, центральное просветление которых имеет вид полоски или рта. При стоматоцитарной трансформации также могут образоваться сферостоматоциты, но в отличие от сфероэхиноцитов они не имеют шипов.
Шизоциты – фрагменты разрушенных эритроцитов. При прохождении через узкие сосуды и бифуркации под давлением часть эритроцитов механически повреждается и теряет форму двояковогнутого диска. Фрагменты этих эритроцитов подвергаются гемолизу или утилизируются нейтрофилами.
Шлемовидные эритроциты – фрагменты разрушенных эритроцитов в форме шлема.
Эхиноцит – эритроцит с шипами одинакового размера, расположенными равномерно по поверхности клетки. Выделяют эхиноциты трех стадий трансформации.
Наиболее часто встречающиеся ошибки в описании и интерпретации
Лейкоциты
В периферической крови встречаются три вида клеток, объединённых общим термином. Дифференцировка лейкоцитов происходит в костном мозге. Процесс выхода лейкоцитов из костного мозга высокоселективен. В норме в кровоток поступают только зрелые клетки. Это гранулоциты – клетки, содержащие гранулы, и агранулоциты – моноциты и лимфоциты. Каждый вид клеток специализирован на выполнение присущих только им задач.
Гранулоциты
По структуре гранул выделяют три группы клеток:
Нейтрофилы составляют 60–70% общего числа лейкоцитов. Нейтрофилы рассматриваются как первая линия защиты организма. Основная функция этих клеток – участие в борьбе с микроорганизмами.
В зависимости от степени зрелости и строения ядра выделяют палочкоядерные и сегментоядерные нейтрофилы.
Палочкоядерные нейтрофилы имеют диаметр 10–18 мкм. Во время движения могут вытягиваться до весьма значительных размеров. Ядро клеток выглядит, как длинная изогнутая палочка без перемычек.
Сегментоядерные нейтрофилы имеют диаметр 10–16 мкм. Их ядро состоит из 2–5 сегментов и расположено центрально. Иногда из-за перегиба ядра перемычка между сегментами бывает не видна. Такую клетку принято относить к сегментоядерной.
Неактивные нейтрофилы имеют округлую форму, малоподвижны. Если размер нейтрофила равен или меньше размера эритроцита, можно говорить о снижении иммунитета.
Базофилы составляют всего 0,5% от общего числа лейкоцитов. Это достаточно редко встречающаяся клетка. Базофилы подвижны, способны к фагоцитозу. В гранулах клеток содержатся гистамин, лейкотриены, тромбоксаны, ферменты и другие биологически активные вещества, поддерживающие реакции воспаления. Отличить базофил от эозинофила в нативной крови можно по меньшим размерам и более конденсированному ядру. Гранулы базофила крупнее, чем у нейтрофила, но мельче и нежнее, чем у эозинофила.
Как уже отмечалось, основная функция гранулоцитов – фагоцитоз, поэтому все они обладают способностью к передвижению, что и наблюдается в нативном препарате.
В норме в поле зрения (могут быть не в каждом) встречаются единичные гранулоциты. Они в 2–3 раза крупнее эритроцитов, подвижны. При угнетении иммунитета клетки становятся мельче, практически соотносимыми с размерами эритроцитов и малоподвижными.
В процессе развития воспалительной реакции происходит мобилизация костномозговых и циркулирующих лейкоцитов, развивается лейкоцитоз, что можно наблюдать в капле нативной крови.
Морфологические аномалии нейтрофилов:
Данные морфологические аномалии необходимо дифференцировать с артефактами, полученными при приготовлении препарата.
Агранулоциты
Моноциты
В периферической крови моноциты составляют от 1 до 10% всех лейкоцитов. Моноцит – это крупная клетка диаметром 12–18 мкм. Ядро различной формы: от бобовидной до сегментированной. Цитоплазма содержит многочисленные пылевидные гранулы, иногда можно наблюдать вакуоли и фагоцитированные частицы.
Моноциты обладают хорошей адгезивной способностью, легко прилипают к стеклу и пластику, поэтому на препарате они выглядят распластанными, фагоцитирующими клетками.
Лимфоциты
В крови лимфоциты составляют 20–35% всех лейкоцитов.
Популяция лимфоцитов чрезвычайно гетерогенна. Она включает три типа зрелых Т-лимфоцитов и три типа зрелых В-лимфоцитов, имеющих различные функциональные характеристики. Помимо этого, обнаружена популяция клеток, не несущая маркеров ни Т-, ни В-клеток. Это так называемые нулевые лимфоциты или естественные киллеры (NK). Нормальные размеры лимфоцитов варьируют от 4,5–6 мкм до 10–12 мкм.
Общими анатомо-морфологическими признаками для всех клеток лимфоидного ряда являются:
— ядро крупное, округлое или овальное;
— ядро расположено в центре или эксцентрично;
— зернистость всегда носит гранулярный характер.
По размеру цитоплазмы различают широкоплазменные, среднеплазменные и узкоплазменные (большие, средние и малые) лимфоциты.
Тромбоциты
Тромбоциты образуются при отшнуровке фрагментов цитоплазмы от гигантской клетки мегакариоцита и выполняют роль ключевого фактора гемостаза. Тромбоцит содержит набор органелл, которые обеспечивают жизненный цикл клетки.
Зрелые тромбоциты – это безъядерные клетки, имеющие круглую, овальную или звёздчатую форму.
В целом популяция тромбоцитов неоднородна. Микроформы тромбоцитов имеют диаметр менее 1,5 мкм, макроформы могут достигать 5 мкм и мегалоформы — 6–10 мкм. Активные (возбуждённые) тромбоциты имеют звёздчатую форму с нитевидными отростками-псевдоподиями.
Функции тромбоцитов определяются их способностью к адгезии, агрегации, транспорту различных веществ в крови, дегрануляции, ретракции кровяного сгустка и т.д. При изучении тромбоцитов, показано, что во время их физиологической активности в течение 1–2 минут большинство из них теряют дискоидную форму и распластываются на поверхности стекла, образуя псевдоподии. При МНК тромбоциты часто видны в виде звёздчатых распластанных клеток.
Склонность к повышенной агрегации видна в виде скоплений клеток различного размера. Стимуляторами агрегации тромбоцитов являются: АДФ, адреналин, норадреналин, тромбин, серотонин, фибриноген и др.
Неклеточные структуры крови
Плазма и ее компоненты
Соотношение объёмов клеточных элементов и плазмы составляет примерно 1:1. В физиологической системе крови плазма (жидкая фаза, суспензионная среда) выступает как консервативный, наиболее стабильный компонент, препятствующий патологическим изменениям рН. Диапазон изменений рН крови составляет всего 0,1 единицы, а значения 7,35–7,45 поддерживаются мощнейшей буферной системой крови. Поэтому кровь – это всегда слабощелочная среда и кислой не бывает (только при тяжёлой патологии, но это состояния, требующие реанимационных мероприятий).
Функции плазмы настолько разнообразны и настолько жизненно важны, что можно сказать: «Плазма есть сама жизнь».
При исследовании нативной крови нормальная плазма имеет вид прозрачной жидкости слегка голубоватого цвета.
Поскольку все вещества в плазме находятся в растворённом состоянии, они имеют чрезвычайно мелкие размеры. Поэтому увидеть их посредством светового микроскопа не представляется возможным.
При микроскопии хорошо визуализируются крупные полимеризованные нити фибрина и хиломикроны.
Фибриноген и фибрин
Фибриноген – белок острой фазы воспаления и один из основных факторов свёртывания крови. Синтез фибриногена происходит в печени.
При микроскопическом исследовании нативной крови можно видеть продукт полимеризации фибриногена – фибрин.
Механизм образования фибрина in vivo состоит из трех этапов:
1. Под влиянием тромбина от фибриногена отщепляются фибринопептиды А и В, в результате чего образуются мономеры фибрина. Эта реакция происходит при обязательном участии протеолитических ферментов.
2. При участии кальция происходит агрегация и полимеризация мономеров. Образуется растворимый фибрин.
3. От растворимого фибрина с помощью ферментов отщепляется сиаловая кислота, что ведет к образованию нерастворимого фибрина и формированию сгустка.
In vitro процесс протекает несколько иначе. Через некоторое время после взятия крови запускается процесс ее свёртывания и на препарате появляются нити фибрина в виде нежных темных полос на фоне прозрачной плазмы. Иногда нити фибрина настолько тонки, что практически неразличимы в микроскоп, что, конечно, не означает их полного отсутствия.
Через 10–15 минут при участии тромбоцитов начинается ретракция кровяного сгустка и процесс фибринолиза.
При заболеваниях фибрин выпадает очень быстро и нити его значительно грубее. Это зависит от исходного содержания в плазме фибриногена. А его уровень, как известно, повышается при целом ряде заболеваний.
Нарушения в питании, наследственные факторы, определённые патологические состояния и заболевания (сахарный диабет, гиперхолестеринемия), курение, алкоголь, неблагоприятные социальные условия и стрессы, токсические влияния и целый ряд фармакологических средств, а также возраст влияют на концентрацию фибриногена в крови. По данным зарубежных исследований, вышеназванные неблагоприятные воздействия приводят к повышению уровня фибриногена, в то время как при возвращении к здоровому образу жизни его количество достоверно снижается.
Антиоксиданты (природные витамины А, С, Е и готовые формы атиоксидантов, таких как микрогидрин, фикотен, фитоси), свежие фрукты и овощи, а также достаточная физическая нагрузка также выраженно способствуют снижению уровня фибриногена и фибрина (см. фото, Атлас нативной крови).
Учитывая всё изложенное, целесообразно регулярно и в течение длительного времени проводить повторные исследования нативной крови и оценивать динамику свёртывающей системы по указанным визуальным признакам. Особенно это актуально для пациентов, относящихся к группам риска развития сердечно-сосудистых заболеваний.
Хиломикроны
Хиломикроны (ХМ) – это первый транспортер поступающих с пищей липидов (прежде всего триглицеридов (ТГ)) на их пути через лимфу в кровь. Хиломикроны образуются преимущественно в энтероцитах кишечника. Их функция: перенос экзогенного жира из кишечника в ткани (преимущественно в жировую ткань). Размеры хиломикрона достаточно велики (сравнимы с размерами эритроцитов), поэтому он не может пройти через поры, имеющиеся в стенках кровеносных капилляров, путем экзоцитоза. Путем экзоцитоза хиломикроны поступают в лимфу и с ее током попадают в большой круг кровообращения. После употребления в пищу жира в крови наблюдается повышенное содержание хиломикронов.
Иногда в крови встречаются такие аналиты (компоненты плазмы), происхождение и структура которых пока не совсем ясна. Они являются, в частности, одним из множества сюрпризов, которые уже преподнёс исследователям метод МНК. Поэтому очень важно продолжать научный поиск в данной области.
Микроорганизмы
(апатогенные и патогенные)
Справедливости ради необходимо отметить, что в естественных науках (биологии, микробиологии и др.) никогда и не постулировалось положение о стерильности крови, исходя из многочисленных наблюдений и того факта, что кровь – это основная транспортная система организма. Чтобы убедиться в этом, достаточно просмотреть научные труды не только периода 20 столетия, но даже датируемые 19 веком. Современные исследования также полностью подтверждают факт наличия форм жизни в крови.
Разрешающая способность современной аппаратуры позволяет нам при проведении МНК визуализировать достаточно большое количество живых (движущихся) микроорганизмов в крови.
Возникают следующие вопросы: может быть нарушены правила асептики и антисептики при проведении анализа, или, возможно, вся эта «живность» попадает из воздуха?
В большинстве случаев это не так! Данные отечественной и зарубежной науки, а также собственные исследования показали, что визуализируемые в крови микроорганизмы, попали на предметное стекло из кровеносного русла. Кровь же является для них средой обитания либо транслокации. И это вполне логично, мы живем в природе, а человек – это открытая система.
Сегодня уже всем известен факт присутствия в организме человека достаточно большого количества самых разнообразных микроорганизмов, которые образуют его биоценоз. При этом следует помнить, что даже в норме, кроме облигатной микрофлоры, у человека в его внутренней среде присутствуют также условно-патогенные и транзиторные микроорганизмы. Основная их среда обитания у человека – это ЖКТ, вагина, уретра. Но при определённых условиях микрофлора может заселять и несвойственные ей ниши, вызывая различные заболевания, такие как пневмонии, бронхиты, тонзиллиты, циститы и др. Расселение ее по организму происходит, в основном, гематогенным путем. По данным микробиологов, 70 % микроорганизмов – гемоформы, то есть пути их транслокации по организму проходят через кровь.
Считается, что приблизительно 40 % всей патологии человека прямо или косвенно связано с пагубной деятельностью патогенной и транзиторной микрофлоры. Заболевание может вызывать также и факультативная флора, например при увеличении количества микробных тел либо снижении общего и/или местного иммунитета.
Уникальная способность бактерий приспосабливаться и выживать в экстремальных условиях, длительно персистировать в организме, не вызывая клинических проявлений, и склонность к полиморфизму позволяет им благополучно выживать даже после антибиотикотерапии.
Часть этих форм обитает в крови, другая попадает туда транзиторно, перемещаясь по организму, реализуя предназначенный природой жизненный цикл.
Бактерии
В настоящее время наиболее распространённой классификацией, используемой большинством микробиологов и бактериологов, является классификация Берджи. Согласно этой классификации, прокариоты (бактерии) делятся на два домена «Bacteria» и «Archaea».
При нативной микроскопии мы не можем идентифицировать вид бактерий, а потому следует говорить лишь об их форме и размере.
Формы бактерий наблюдаются самые разнообразные: сферические или кокки, диплококки, палочковидные, извитые, спиралевидные и т.д.; размер их может варьировать от 0,15 мкм (микоплазмы) до 8 мкм (палочковидные) и до 50 мкм у актиномицетов. Стафилококк – грамположительный круглый кокк размером 1 мкм, стрептококк – кокк неправильной формы, неподвижен, размер от 0,5 до 2 мкм.
Можно абсолютно точно утверждать, что бактерии попадают в диапазон разрешающей способности светового микроскопа, а потому их можно наблюдать при исследовании нативной крови.
Бактерии не находятся в крови постоянно, они лишь транзиторно проходят через кровь, и их наличие в препарате не всегда является признаком патологии.
К домену бактерий современными классификаторами отнесены и не совсем обычные микроорганизмы. Речь идет о микоплазме и уреоплазме. У этих бактерий отсутствует клеточная стенка. Другой их особенностью является то, что они длительно могут персистировать в организме, являясь его условно-патогенной флорой, и не провоцирвать симптоматики. Но при определённых условиях, эти микроорганизмы способны вызывать как острые, так и хронические вялотекущие со стёртой клиникой заболевания, например при снижении иммунитета либо при резком увеличении микробных тел. В этих случаях нативная микроскопия позволяет обнаруживать полиморфные колонии бактерий (микроорганизм слишком мелкий) и большое их количество, особенно после проведения функциональной пробы с водной нагрузкой. В то время как лабораторными методами диагностики эти возбудители не всегда выявляются, так как являются тканевыми (клеточными) паразитами.
Вирусы
Мельчайшие микробы, не имеющие клеточного строения, содержат только ДНК или РНК. Морфологию вирусов изучают с помощью электронного микроскопа, так как размер вирусов чрезвычайно мал (от 18 до 400 нм). Световые микроскопы предназначены для изучения объектов не менее 0,2 мкм, поэтому крупные скопления вирусов, так называемые вирусные тельца, мы можем видеть, но как их идентифицировать от гранул и вакуолей лейкоцитов, нам пока не понятно, учитывая, что вирус – это облигатный внутриклеточный паразит. В то же время, по данным ряда исследований, вирусные тельца хорошо визуализируются в эритроците.
Неклеточные формы включают еще более мелкие частицы, такие как прионы (белковые инфекционные частицы, вызывающие прионные болезни со смертельным исходом) и вироиды (небольшие молекулы кольцевой суперспирализованной РНК, вызывают болезни растений). Данные объекты в световой микроскоп не видны.
Простейшие
Простейшие – эукариотические одноклеточные микроорганизмы, содержат ядро с ядрышком и цитоплазму с органеллами. Размеры простейших от 2 до100 мкм.
Простейшие имеют: органы движения (жгутики, реснички, псевдоподии), питания (пищеварительные вакуоли) и выделения (сократительные вакуоли). Подцарство простейших включает 7 типов, из которых 4 значимы для человека и чаще всего вызывают заболевания. Основные и наиболее распространённые возбудители болезней среди простейших: трихомонада, лейшмания, трипаносома, дизентерийная амеба, токсоплазма, лямблии, малярийный плазмодий и балантидий.
Нахождение в крови лейшманий, трипаносом и малярийного плазмодия вопросов не вызывает, поскольку при попадании в организм они либо паразитируют в клетках крови, либо используют кровь как транспортную систему. Наличие данных паразитов всегда сопровождается соответствующей клиникой.
Токсоплазма тоже проходит стадию развития в крови, но часто встречается скрытое носительство при отсутствии клинических проявлений.
Спорным до сих пор является присутствие в крови лямблий и трихомонад, поскольку непонятен механизм их выживания в несвойственной для них среде. В литературе также нет достоверных данных об обнаружении и идентификации этих простейших в периферической крови.
Грибы
К несовершенным грибам, в частности, относятся формы, вызывающие грибковые заболевания ног и стригущий лишай.
Форма, размеры и мицелий специфичны для каждого вида.
К самым известным «обитателям» человека безусловно относится Candida, которая является частью условно-патогенной и транзиторной микрофлоры млекопитающих и человека. На фоне ослабленного иммунитета, при попадании в ткани данная эндогенная флора вызывает кандидозы различной локализации: пневмонии, бронхиты, язвенные процессы в ЖКТ, циститы и др.
Достаточно часто в крови можно встретить микроорганизмы дрожжевых и диморфных грибов в стадии почкования, характерным признаком которых является плотная, четко очерченная поверхность.
Этот факт существенно помогает отличить, например, деформированный эритроцит от клетки гриба.
Гельминты
Гельминты – многоклеточные паразитические черви. Термин «гельминтозы» был введен еще Гиппократом. Сегодня известно более 100 тысяч видов паразитических червей. У человека описано их более 250 видов. Проблема гельминтозов стала чрезвычайно актуальна в настоящее время. В результате развития туризма и увеличения миграции населения, всё чаще в Европе, РФ и странах СНГ стали встречаться экзотические виды паразитов и редких гельминтозов, диагностика которых абсолютно не разработана.
По форме тела и циклам развития выделяют три различных группы гельминтов: нематоды, трематоды и цестоды.
Не углубляясь в классификацию, описание морфологии и жизненного цикла гельминтов, приведём лишь их размеры и возможность обнаружения в капиллярной периферической крови при микроскопии.
По современным научным данным (научно-обоснованным и официально подтверждённым), в периферической крови могут быть обнаружены следующие виды гельминтов в личиночной их стадии: анкилостома, некатор, аскарида, токсокара, бругия, вухерерия, лоа лоа, стронгилоид, трихинелла, шистосома.
Размеры взрослых особей, их личинок и яиц весьма значительны. Ниже представлены некоторые из них, приведённые в официальных документах (МУК 2.1.7.730-99 (По состоянию на 18 октября 2006 года) «Гигиеническая оценка качества почвы населённых пунктов», МУК 13-4-2/1751 «Возбудители гельминтозоонозов в пресноводных рыбах» от 04.10.99):
Обращаем ваше внимание на то, что указаны величины личинок, паразитирующих в рыбе. Продолжая свой жизненный цикл в организме человека, они еще больше увеличиваются в размерах.
Размеры гельминтов и их личинки значительно превышают величину не только клеток крови, но и капиллярного русла. Поэтому возможность встретить их при микроскопии периферической капиллярной крови – скорее исключение, чем правило.
Другие биологические формы
При микроскопии нативной крови достаточно часто обнаруживаются объекты, идентифицировать которые пока не представляется возможным. Не исключено (особенно при наличии определенной клинической картины), что визуализируемые в крови биологические контаминанты относятся к паразитарным формам жизни. Но однозначно это утверждать не представляется возможным. Сложность интерпретации объясняется отсутствием исследований по идентификации данных объектов. Тем не менее однозначно понятно, исходя из размеров (всего одна клетка), большинство из них – это не гельминты, поскольку все гельминты многоклеточные! Среди известных одноклеточных микроорганизмов большинство подобных форм не наблюдаются. От эритроцитов они отличаются подвижностью и иной структурой клеточного строения. Для прояснения этих вопросов необходимы глубокие серьезные исследования. Но на сегодняшний день именно эти объекты активно обсуждаются в среде практикующих врачей, причем нередко беспредметно создают почву для необоснованных домыслов.
Приложение № 1
МИКРОСКОПИЯ НАТИВНОЙ КРОВИ
ЭТАПЫ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ
I. Методика приготовления препарата
1. Подготовка предметных и покровных стекол (стекла готовятся до исследования).
1.1. Замачивание стекол в специальном растворе (этиловый спирт 96° + эфир для наркоза =1:1) с целью обезжиривания (не менее 1 часа).
1.2. Тщательная натирка стекол нетканой салфеткой.
1.3. Предварительный контрольный просмотр стекол перед исследованием при 400-кратном увеличении на предмет наличия возможных артефактов.
2.1. Кровь для исследования берут капиллярную из безымянного или среднего пальца.
2.2. Палец тщательно протирается спиртовой салфеткой. Затем высушивается стерильной сухой марлевой салфеткой.
2.3. Прокол пальца производят с использованием одноразового скарификатора.
2.4. Каплю крови помещают на середину покровного стекла и аккуратно (без усилий – во избежание раздавливания клеток крови и появления артефактов) накрывают покровным стеклом, также тщательно обработанным. Кровь под стеклом должна распределиться равномерно монослоем, что очень важно для объективности результатов. Примечание: первые 1–2 капли крови помещаются на предметное стекло в боковой его части.
2.5. Полученный препарат крови помещают на предметный столик микроскопа и просматривают сначала на малом (объективы: 4, 10), а затем на большом (объективы: 40, 100) увеличении.
II. Микроскопия крови
Увеличение и разрешающая способность светового микроскопа позволяют визуализировать в крови в основном только нижеперечисленные объекты:
— нормальные дискоциты (6–8 мкм);
— анизоциты (микро- и макроформы 4–15 мкм);
— пойкилоциты (клетки с измененной формой);
— анизохромные (с различной окраской);
— юные и незрелые формы (ретикулоциты, нормобласты);
— эхиноциты, стоматоциты, шлемовидные эритроциты;
— гемолизированные эритроциты и другие формы деградации и старения эритроцитов;
— включения в эритроцитах (остатки ядра);
— гранулоциты (нейтрофилы, эозинофилы, базофилы);
— агранулоциты (моноциты, Т- и В-лимфоциты);
— юные и незрелые формы (в том числе бластные).
2. Фибрин (в виде нитей и тяжей).
3. Хиломикроны (шарообразные опалесцирующие структуры светло-зеленого цвета размером до 5–8 мкм).
4. Бактерии разного размера и формы, подвижные и неподвижные (примечание: без видовой идентификации!).
6. Возможно обнаружение яиц глистов и миграционных личиночных стадий некоторых гельминтов (микрофилярий, аскарид, анкилостом, некатора, трихинелл и др.). Диагностика гельминтозов проводится с учетом их макроразмеров (значительно крупнее эритроцита, примерно от 100 и больше мкм). Редчайшей диагностической находкой может быть обнаружение взрослого гельминта (очевидно, что это многоклеточное существо также будет макроразмеров).
Примечания:
III. Функциональная проба
При наличии показаний (выраженной агрегации эритроцитов, снижении физиологической активности лейкоцитов и др.) целесообразно проводить функциональную пробу, которая у взрослого человека включает:
Цель проведения функциональной пробы: оценка адаптационных резервов организма человека и индивидуальный подбор БАД к пище в качестве превентивной диетотерапии для профилактики возникновения заболевания либо предупреждения его прогрессирования.