для чего природа создала вирусы
Паразиты: какова природа вирусов и почему они возникают все чаще
Коронавирус становится поводом пошутить над незнакомцем, ему посвящают мемы, о нем слагают песни. Вирус проникает не только в организмы живых существ, но и в поп-культуру. Однако пройдет время, и о нем все забудут, как когда-то перестали говорить о вирусе Эбола, атипичной пневмонии и оспе.
Север Туркмении, 1980-е годы. В Средней Азии возникла вспышка ранее неизвестного вируса. Обстановка сложная и напряженная. Вирус передается через зараженную воду. Из-за ее употребления количество заболевших резко растет. В большинстве случаев болезнь протекает относительно благополучно, но ужас в том, что умирают в основном женщины в третьем триместре беременности.
Начались всесторонние исследования, во время которых был открыт вирус гепатита Е. Его основное проявление — «желтуха». Сейчас появилась вакцина и различные методы профилактики этой инфекции. Тогда в эпицентре событий работал эпидемиолог Михаил Фаворов.
Михаил Фаворов,
эпидемиолог, доктор медицинских наук
Сегодня Михаил Фаворов живет в США, занимает пост президента компании DiaPrep System Inc и продолжает активно работать в области диагностики, контроля и профилактики инфекционных заболеваний.
Вирус — простейшая форма жизни. Принято считать, что если он находится внутри человека или животного, то становится живым существом — размножается и обменивается информацией. Но когда вирус находится вне организма, он считается неживым. О вирусах мы узнали сравнительно недавно, около 100 лет назад. М икробиолог Дмитрий Ивановский опубликовал исследование о существовании некой субстанции, которая проходит через фильтры, задерживающие бактерии, и назвал ее вирусом. В то время как чума человечеству известна многие тысячелетия, у нее другая природа — она вызывается бактериями, которые являются более сложным и крупным организмом. Ее распространение было связано с низким уровнем жизни и плохой гигиеной. Процент летальности достигал 25%, то есть при легочной форме погибал каждый четвертый.
Среди вирусных инфекций самой страшной была оспа, которая затронула все страны мира. Вызывалась она вирусом натуральной оспы. Вакцину удалось изобрести благодаря случайному знакомству с коровьей оспой. Вирус животных, которые выступали переносчиками, вводили в организм человека, но вакцинированные не заболевали человеческой формой болезни: организм защищали антитела введенного вируса. Уникальность натуральной оспы в том, что это антропонозный вирус — им болели только люди. Поэтому, когда произвели вакцину, оспу удалось искоренить. В 1950-х годах в Африке были вакцинированы последние контактировавшие с больными, а с 1978 года вирус был полностью ликвидирован. Оспа исчезает, когда у последнего заболевшего появляются антитела, — он выздоравливает и перестает быть переносчиком.
Другое дело, что основная часть вирусов зоонозна, то есть переносится от животных к людям, и полностью искоренить такой вирус вряд ли удастся. Первая его передача от животного к человеку называется кроссвидовым переходом. Так, всем известный вирус гриппа сначала переносили птицы, и только во время Первой мировой войны случился переход на человеческую популяцию, вызвавший эпидемию «испанки», в результате которой умерли десятки миллионов людей.
За последние 20 лет мы наблюдаем уже третью попытку перехода коронавируса на человека. Вакцина, конечно, будет найдена, считает Михаил Фаворов, но не стоит ждать, что «переходы» коронавируса и других зоонозных инфекций прекратятся даже при совершенствовании медицины.
Рецепты с летучей мышью
«Взять одну летучую мышь, варить в кипящем кокосовом молоке около 15 минут с зеленым луком, морковью и специями» — так звучит рецепт апокалиптичного супа, одного из множества китайских деликатесов. Летучие мыши в Китае продаются засушенными и используются в качестве средства альтернативной медицины. Именно эти существа стали причиной возникновения вспышки эпидемии SARS (атипичной пневмонии) в 2003-м, лихорадки вируса Эбола в 2014-м и коронавируса COVID-19. Фильм Стивена Содерберга «Заражение» прекрасно проиллюстрировал цепочку случайностей, которая привела к эпидемии, похожей на вспышку смертельного вируса Нипах в Малайзии в конце 1990-х годов. Все началось также с летучей мыши, вирус перешел на свиней, а затем на человека.
По уровню плотности населения Китай и Индия превосходят все остальные регионы планеты, а разнообразие видов животных в Африке настолько велико, что большинство из нас вряд ли догадываются о существовании некоторых из них, например окапи, виверр, руконожек. Как редкие животные, так и плотность населения становятся дополнительными стимулами высокой скорости распространения заражения. Вирусы не поражают отдельно китайцев или представителей других наций, вирусы аполитичны и не имеют вероисповедания. Они умеют приспосабливаться к любым изменениям среды не хуже человека. Все, что им нужно, — тепло наших тел и, возможно, определенные рецепторы.
Коронавирус можно назвать в некотором роде эйджистским — болезнь в единичных случаях затрагивает детей, а умирают в основном пожилые люди. Одна из теорий, выдвинутая экспертами, говорит о том, что существует некий рецептор, который появляется только у взрослых. Этот «предательский» рецептор помогает вирусам прикрепиться к клетке в большом объеме. Но это пока только гипотеза, и, чтобы подтвердить ее, нужно проделать огромную работу по изучению вирусов. Их структура сложна и многообразна. Вирусы различаются по форме, по механизму репликации (поражения организма), но самая большая разница в том, что часть вирусов обладает основной нуклеиновой кислотой — ДНК, а другая часть содержит РНК. Это две разные «природы», и разница между ними гораздо больше, чем между слонами и бактериями — и те и другие хотя бы имеют клетки, которые содержат ДНК.
Вспышка эпидемий — это не просто случайность, а стечение обстоятельств.
Каждый вирус обладает своей особенностью, которую он использует для паразитирования на живом существе, и от этого взаимодействия зависит, к чему приведет заболевание. Если вирус «наш», антропонозный, то глобальных эпидемий он, как правило, не вызывает (за редким исключением той же оспы). Он вызывает болезнь, которая приводит, например, к хроническому заболеванию, как в случае гепатита B и ВИЧ. Если вирус зоонозный, то он так или иначе приводит к вспышке эпидемии.
Все закрыто: рынки, магазины, метро. Остановки общественного транспорта абсолютно пусты. По тротуарам проплывает только мусор, гонимый ветром, исчезающий в желтоватой дымке. Странно, если учесть, что в городе проживают миллионы человек. Изредка на улице появляются люди в респираторных масках, некоторые сделаны из подручных средств. Однажды увидев такую картину, вряд ли возможно спутать с чем-то эпицентр распространения респираторного заболевания, и защищаться надо незамедлительно.
Чтобы обезопасить себя и свою семью во время респираторной эпидемии, главное — находиться на расстоянии не ближе 2 м от заболевшего, чихающего или кашляющего человека, мыть руки каждые два часа, проветривать помещения, минимально контактировать с людьми.
«Респираторная маска вполне может защитить, но проблема в том, что надежна она всего 20 минут», — напоминает Фаворов.
История человечества насчитывает десятки тысяч кровавых войн, но самые страшные по потерям, пожалуй, — войны с паразитами. По некоторым данным, от чумы умерло больше людей, чем в результате всех войн, вместе взятых, — около 186 млн человек. От одной Юстиниановой чумы, первой зарегистрированной в истории, погибли 100 млн человек. Разработка защиты от биологической угрозы требует больших затрат, поэтому вакцины создаются только для тех вирусов, которые представляют реальную опасность. Более того, к некоторым вакцинам вирусы привыкают, становятся устойчивыми и меняют свою структуру, поэтому человечеству приходится постоянно быть начеку и придумывать что-то новое.
Респираторная маска вполне может защитить, но проблема в том, что надежна она всего 20 минут.
В микробиологии это называют гонкой вооружений между вирусом и человеком — когда вирус привыкает, а человек разрабатывает более изощренный вид вакцины. Это можно отнести к вирусу гриппа, способному постоянно изменять свои антигенные структуры, ускользая от иммунитета или вакцины. Например, изначально был грипп А, от которого была изобретена вакцина. Но микроскопические существа, точнее их нуклеиновые кислоты, подобрали ключ к существованию в организме. Так появился грипп типа В. Но далеко не все вирусы могут «декодировать» вакцину. Например, вирус кори, к которому есть вакцина, не меняется столетиями и не может выжить в организме при наличии антител.
На уроках биологии нам говорили, что жизнь — это способ существования нуклеиновых кислот. Один из вариантов существования нуклеиновых кислот — это вирусы, которые живут на других организмах. Они совершенно не заботятся о нашем благополучии, они пытаются приспособиться, как и все живые существа на планете. Единственное, за что стоит их благодарить, — эволюционное совершенство иммунной системы человека. Веками, когда появлялось какое-либо заражение, организм человека вырабатывал антитела и формировал клеточный иммунитет. Все знают, что если держать человека в стерильной среде, а потом выпустить на улицу, он вскоре умрет, потому что у него не будет механизма выработки защиты. Но это не цель существования вирусов, скорее побочный эффект.
Прогнозировать возникновение вспышек вирусов еще сложнее, чем рассуждать о высших смыслах. Это всегда уникальная ситуация, которая происходит в результате изменения состояния окружающей среды, при которой человек попадает в новые условия взаимодействия с другими видами животных. А сегодня антропогенное воздействие на окружающую среду достигло абсолютно несопоставимых масштабов по сравнению с предыдущими поколениями, к тому же человек как вид постоянно растет. У ученых есть возможность наблюдать за попытками вирусов совершить кроссвидовой переход благодаря лабораторным методам слежения. Врачи ликвидировали оспу и почти победили вирус полиомиелита — это внушает надежду, что с новым вирусом можно будет хотя бы договориться. Как бы ни сложились эти взаимоотношения, стоит помнить: пока человек будет существовать как вид, всегда найдутся те, кто захочет на нем паразитировать.
Как защититься от коронавируса? Узнайте здесь.
Я всегда тяготел к мысли, что каждый микроб (в собирательной интерпретации) всегда несет какую-то функцию как локальную, так и глобальную. Любое грубое вмешательство человека в гармонию природы (осушение болот, истребление пернатых. ) всегда приводило к экологической катастрофе. Но зачем природе вирусы? Материал ниже опубликованный еще в прошлом веке в журнале «Химия и жизнь» на мой взгляд наглядно раскрывает этот момент. Хотелось бы услышать комментарии специалистов.
Подобная первоначальная постановка вопроса вообще естественна для человеческого общества, постоянно находящегося в определенном «противоборстве» с факторами окружающей среды. Кроме того, причиной глубоко укоренившегося отношения к вирусам как к нежелательным, патологическим агентам послужило развитие учения об инфекционных болезнях, и в первую очередь о бактериальных и паразитарных, которым организм противопоставляет сложный комплекс иммунных механизмов, во многом сходный с организуемой организмом противовирусной защитой.
Открыв сам факт существования вирусов, и в первую очередь, обнаружив их повреждающее действие, ведущее к заболеванию, человек объявил им священную войну. Но если иметь в виду несомненную убиквитарность вирусов, их повреждающее действие следует считать скорее исключением, чем правилом. В самом деле, мы сами и вся окружающая нас природа беспредельно насыщена вирусами, однако даже во время тяжелейших эпидемий, вызываемых, например, вирусами полиомиелита, заболевает не более одного-двух человек из 100 000 (ста тысяч). Среди заведомо получивших этот вирус детей заболевает лишь один из тысячи. Подобное же соотношение характерно и для заболеваний, вызванных вирусом клещевого энцефалита.
Тут мы явно противоречим логике. Если в городе с населением 100 000 человек имеется один тунеядец или один убийца, то у нас даже не возникает мысли распространять это обвинение на остальных 99 999 жителей. Так может быть, стоит посмотреть на взаимоотношения вирусов с остальными представителями живой природы не со стороны единичного трагического исхода, а со стороны девяносто девяти тысяч девятисот девяносто девяти благополучных? Разве не удивительна ситуация, при которой «паразиты» и «убийцы» убикваторны (т. е. распространены повсеместно), насыщают и нас самих, и пищу, которую мы едим, и воду, которую мы пьем, и воздух, которым дышим, а жизнь (причем не только в узком, антропоцентрическом смысле, но и в глобальном, биосферном) не только не исчезает, но успешно развивается, прогрессирует, эволюционирует? Так может быть, роль вирусов в биосфере не ограничивается исключительно сатанинской ролью болезнетворного начала?
Экстремальные механизмы адаптации вводятся в действие нервной и эндокринной системами. Но для длительной адаптации эти системы непригодны. Длительное перегрузочное воздействие среды на организм повышает активность конкретного нервного или эндокринного аппарата на столь долгий срок, что это приводит к их истощению, к заболеванию.
Трудно даже представить себе, что любой организм, постоянно встречая массу различных вирусов, становится лишь объектом нападения, вынужденным только обороняться. Наличие большого выбора разрозненной, находящейся в разных комбинациях, генетической информации скорее представляет для организма-хозяина определенный интерес, так как из этого огромного фонда можно отобрать любую недостающую ему в данный момент генетическую информацию. Интегрируя необходимый информационный блок, организм получает возможность функциональной перестройки, соответствующей изменившимся условиям окружающей среды.
Кстати, существование аналогичного механизма функциональных изменений в связи с изменениями внутренней среды организма уже твердо доказано: в последние годы обнаружен факт формирования в клетках многочисленных эндогенных вирусов, представляющих собой блоки генетической информации, которой обмениваются клетки в пределах организма.
4. Роль вирусов как адаптирующего агента подтверждает и тот факт, что существуют узкоспециализированные вирусы. Например, достаточно хорошо изученный вирус сигма представляет собой генетический фактор, изменяющий чувствительность дрозофил к углекислому газу.
Вирусы оказывают отчетливое воздействие на жизнедеятельность растений. Они могут изменять активность ферментов, стимулировать или подавлять рост, увеличивать или уменьшать фотосинтез, влиять на скорость потребления кислорода и выделения углекислоты, на транспортировку воды и перенос растворенных в ней веществ, на окраску растений. Все это при определенных изменениях среды может оказаться для растения исключительно важным.
Значение вирусов как универсального фактора адаптации подтверждает и такой факт: длительное размножение культур клеток в лабораторных условиях возможно только при интеграции в генетический код клеток вирусных геномов. При этом жизнедеятельность клеток трансформируется и возникает биологически устойчивая система. Например, культивируемые вне организма клетки ткани позвоночных, перестающие делиться через 15-20 пассажей, становятся способны к беспредельному размножению после того, как в их геномы включаются геномы вирусов. И речь здесь идет о полезной (не опухолевой) трансформации клеток. Значит, их жизнедеятельность опять-таки трансформируется таким образом, что возникает устойчивая в данных условиях биологическая система. То есть происходит адаптация клеток к новой среде.
6. Но как же тогда быть с гриппом, с корью, с ветряной оспой? Как быть со всей группой вирусных респираторных заболеваний с воздушно-капельной передачей? Вспышки этих инфекций, наиболее массовых, нередко представляющихся неотвратимыми, казалось бы, способны опровергнуть все сказанное выше.
Вспомним, однако, о таких общих для всех респираторных вирусных чертах, как их сезонная приуроченность, четко соответствующая основным изменениям условий среды обитания (осенне-зимний и весенний периоды). Следует особо подчеркнуть, что эти вспышки следуют не календарным датам, а экстремальным моментам меняющихся условий внешней среды, то есть тем моментам, когда возникает наиболее острая необходимость в адаптационной перестройке организма, и в первую очередь дыхательного аппарата.
7. История развития любых разделов биологии свидетельствует о том, что природа в своей основе гармонически рациональна, что она использует универсальные решения, унифицированные конструкции. Достаточно вспомнить универсальные принципы гена, клетки, процессов размножения, универсальность стрессового феномена и иммунных механизмов (по отношению к бактериям, вирусам, токсинам, чужеродным органическим и неорганическим веществам и так далее).
С этих позиций можно по-новому взглянуть и на давно обсуждаемый вопрос о происхождении вирусов. Коль скоро без них невозможно развитие стабильной жизни, невозможна эволюция организмов, то, следовательно, речь идет об элементах генетического обмена, возникших при возникновении жизни на Земле и существовавших в биосфере всегда. Ведь именно вирусы генетически объединяют все живое в динамическое единое целое, определяя гармонию экологического развития.
8. Все это позволяет по-иному взглянуть и на практические проблемы…
… Может быть, стоит отказаться от традиционного сочетания полной стерильности с жесткой иммунодепрессией и попытаться использовать вирусы для создания устойчивой системы биологического взаимопроникновения?
И вообще, понимание вирусного заболевания как патологии адаптации предполагает смещение клинического акцента с поисков средств, направленных исключительно против вирусов, в сторону первоочередного воздействия на иммунную систему.
Взгляд на вездесущие вирусы только как на болезнетворное начало все еще остается общепринятым, хотя есть уже вполне достаточные основания для отказа от этой догмы и для признания вирусов не только полезными, но и необходимыми. В первую очередь презумпция невиновности вирусов определяется их убиквитарностью.»
Комментарии к статье И.М.Сазановой:
О полезных вирусах писала в 1983 году в своей статье «Вирус против вируса» и Марина Ворошилова, член-корреспондент АМН СССР, видный вирусолог, многие годы работавшая вместе с академиками М. П. Чумаковым и А. А. Смородинцевым и возглавлявшая лабораторию иммунологии и вакцинопрофилактики Института по изучению полиомиелита АМН СССР:
«Многие болезни на самом деле являются скорее болезнями адаптации, то есть отклонениями общего адаптационного синдрома, чем результатом прямого повреждающего действия патогенных агентов». (Ганс Селье. )
«Создание биосферы, ее начало и было моментом начала процесса эволюции, создания этим путем морфологически различных наследственных рядов». (В. И. Вернадский. )
Академик Академии медицинских наук СССР, профессор-эпидемиолог О. В. Бароян писал в своей книге «Закономерности и парадоксы. Раздумья об эпидемиях и иммунитете, о судьбах ученых и их труде», вышедшей в 1986 году в издательстве «Знание»:
Правомерны и состоятельны ли в этих условиях иллюзорные попытки искать односторонних преимуществ для одного вида за счет ущемления коренных интересов других? За биологический эгоизм, диктующий человеку взгляд на жизнь лишь с позиций его собственных интересов, рано или поздно приходится расплачиваться. Так допустимо ли и впредь закрывать глаза на эту взаимную зависимость? Не пора ли всем людям взглянуть на окружающую природу с истинно широких, общебиологических позиций и гораздо точнее, справедливее сбалансировать свои интересы с глубинными, непреходящими, неотменяемыми интересами других видов живого на Земле!
…За сравнительно короткий промежуток времени (с 1880 по 1900 год) были изучены биология и морфология десятков болезнетворных бактерий. Многим стало казаться, что причина инфекций, а стало быть, и истоки эпидемий определены и нет больше почвы для дискуссий и споров! В самом деле, чего уж яснее: такой-то коварный микроорганизм проникает так-то в тело человека или животного, порождает в нем инфекционный процесс, который по стереотипу, свойственному любому остро-заразному заболеванию, способен вызвать эпидемию.
…Многие исследователи высказывали мысль, что в попытках ликвидировать возбудителей ряда инфекций люди нарушают устоявшийся экологический баланс. Между тем даже частичная ликвидация какого-то вида бактерий способна привести к появлению новых, в прошлом не встречавшихся инфекционных агентов, которые могут стремиться занять место видов, оказавшихся изгнанными.
…Одним из наиболее злободневных для науки остается вопрос: возможно ли провести сколько-нибудь четкую грань между болезнетворными и безвредными для нас микроорганизмами?»
Ну если задавать вопрос «Зачем нужен природе вирус?», то нафантазировать можно много чего, но сиюминутной практической пользы это иметь не будет. Гораздо актуальнее вопрос «Зачем природе человек?» Вот уж кто нагадил, так нагадил!
Очень интересный взгляд, концепция. Кто знает, если бы человечество не боролось с вирусами, на какой высоте эволюционной стадии мы бы оказались.
Всегда смущали вопросы типа: «А зачем это. «
(комары, вирусы, паразиты, акулы и т.д.)
Как объяснить ребенку, что живые организмы существуют не «зачем», а потому что МОГУТ существовать (и разрешения, обычно, ни у кого не спрашивают).
Сочетание банальных истин с информационным мусором.
Пруф про существование «традиционного сочетания полной стерильности с жесткой иммунодепрессией» где-либо, кроме больного воображения автора, будет?
Стремительная эволюция гриппа: как одни изменения влекут за собой другие
В общественном сознании закрепилось довольно легкомысленное отношение к гриппу. Действительно, зачастую его симптомы не тяжелее простудных, да и беспокоит он нас не дольше недели, причем проходит обычно без всякого лечения. Однако история взаимодействий человека и вируса гриппа требует более серьезного подхода к этому патогену. Достаточно вспомнить, что одни из самых страшных пандемий прошлого века были вызваны этим вирусом*. Да и обычный сезонный грипп далеко не безвреден: по оценкам Всемирной организации здравоохранения, ежегодно от него и связанных с ним осложнений умирают сотни тысяч человек (в первую очередь, пожилые люди, младенцы и страдающие хроническими заболеваниями), а в годы тяжелых пандемий — миллионы. По числу унесенных жизней среди инфекционных заболеваний грипп уступает, пожалуй, только ВИЧ. Основная проблема профилактики и лечения гриппа связана с тем, что вирус очень быстро меняется, и каждый год мы имеем дело с его новыми формами, поведение которых далеко не всегда можно предсказать. Очередным шагом на пути к пониманию изменчивости вируса гриппа стал компьютерный анализ последовательностей аминокислот в белках вируса и нуклеотидов в его геноме.
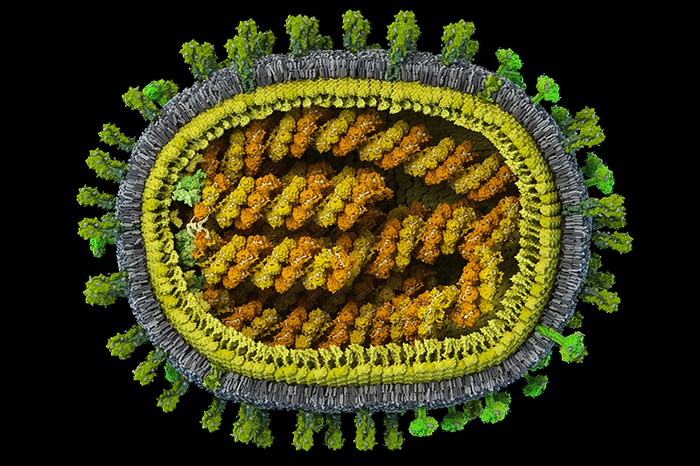
Первая в мире полная достоверная модель вируса гриппа A/H1N1 с атомным разрешением, созданная в рамках проекта Viral Park компании Visual Science при участии Национального центра биотехнологии в Мадриде. Цель проекта — построение научно достоверных 3D-моделей распространенных вирусов человека с максимальной детализацией. Специалисты Visual Science собирают воедино данные огромного количества работ по молекулярной биологии, вирусологии и кристаллографии вирусов, мнения экспертов ведущих научных центров мира и результаты молекулярного моделирования, полученные научным отделом компании. Модель в значительной степени построена на основе данных, опубликованных исследовательскими коллективами под руководством: Хуана Ортина (Испанский национальный центр биотехнологий, Мадрид, Испания), Такеши Нода (Университет Токио, Япония), Роба Ригро (Отдел взаимодействий вируса и клетки, Гренобль, Франция) и Питера Розенталя (Национальный институт медицинских исследований, Лондон, Великобритания). Точное строение генома вируса гриппа удалось смоделировать благодаря сотрудничеству с Хайме Мартин-Бенито (Испанский национальный центр биотехнологий, Мадрид, Испания), группа которого добилась уникальных результатов в описании упаковки вирусного генетического материала. Создатели модели: Иван Константинов (руководитель проекта), Юрий Стефанов (научный консультант), Анастасия Бакулина (ведущий молекулярный моделлер), Дмитрий Щербинин (молекулярный моделлер), Александр Ковалевский (3D-моделлер)
Эволюция вирусов доставляет нам немало проблем, поскольку постоянно создает штаммы патогенов, к которым не готовы ни наш иммунитет, ни индустрия производства антивирусных препаратов и вакцин. Способность вирусных популяций быстро эволюционировать держится, с одной стороны, на огромном количестве потомства, производимого патогеном в ходе инфекции, а с другой — на высокой изменчивости вирусного генетического материала, которая дает естественному отбору шанс выявить варианты («штаммы»), противостоящие нашему иммунитету эффективнее своих предшественников. Но не все вирусы способны меняться одинаково быстро. Особенно высокая изменчивость присуща вирусам с РНК-геномом, поскольку ферменты, которые осуществляют его копирование, в отличие от полимераз, реплицирующих ДНК, не в состоянии исправлять ошибки синтеза [1]. Это приводит к появлению большего числа мутаций, чем у ДНК-вирусов.
Есть и другой механизм, позволяющий еще сильнее увеличить изменчивость. Его могут использовать РНК-вирусы, геном которых разделен на части — сегменты, напоминающие человеческие хромосомы. Если в клетку одновременно проникают два штамма одного вируса с сегментированным геномом, в потомстве может произойти перемешивание участков генетического материала — реассортация, подобно тому, как в каждом из нас перемешаны фрагменты генетического материала наших родителей. В результате реассортации возникает новый штамм вируса. Если вирусы-«родители» сильно отличались друг от друга генетически, то их потомок может приобрести набор свойств, существенно отличающих его от каждого из них. Один из патогенов, способных на такой резкий эволюционный сдвиг, — вирус гриппа. Его геном состоит из восьми отдельных молекул РНК, каждая из которых необходима для успешного осуществления жизненного цикла вируса.
Общая длина генома вируса гриппа составляет приблизительно 13 500 нуклеотидов [2]. Три самых крупных (примерно по 2300 нуклеотидов) его сегмента (PA, PB1 и PB2) кодируют вирусную полимеразу — белок, копирующий РНК и состоящий из трех крупных субъединиц. Четвертый по длине (около 1750 нуклеотидов) сегмент (HA) отвечает за синтез гемагглютинина. Этот белок заякорен в липидной оболочке вируса и отвечает за его проникновение в клетку, связываясь с рецептором на поверхности клеточной мембраны [3]. В зависимости от того, какой именно вариант гемагглютинина несет вирус, связывание может быть более или менее крепким. После этого клетка поглощает вирус, помещая его в мембранный пузырек внутри цитоплазмы. Большинство макромолекулярных комплексов, поглощаемых таким образом, перевариваются клеткой. Однако вирус избегает этой участи: его мембрана сливается с мембраной пузырька, в результате чего ее содержимое оказывается в цитоплазме. В этом процессе гемагглютинин также играет важную роль. Затем геном вируса проникает в ядро, где с него может начать считываться информация.
Сегмент размером около 1550 нуклеотидов (NP) кодирует нуклеопротеин — белок, необходимый вирусу для упаковки РНК. Множество копий такого белка распределяется по каждому из геномных сегментов, связываясь с молекулой нуклеиновой кислоты. В результате фрагменты генома образуют нуклеопротеидные тяжи, сложенные пополам и закрученные в спираль, к каждому из которых прикрепляется своя копия полимеразного комплекса [4].
Следующий сегмент длиной около 1450 нуклеотидов (NA) кодирует белок нейраминидазу. Он нужен вирусу для того, чтобы только что образовавшаяся новая частица могла «отрезать» себя от хозяйской клетки. Кстати, некоторые лекарства против гриппа (например, озельтамивир, известный под торговой маркой «Тамифлю») нацелены именно на блокирование нейраминидазы, которое позволяет снизить распространение вирусных частиц [5]. Правда, некоторые варианты нейраминидазы обеспечивают вирусу возможность избегать действия этих препаратов, делая его устойчивым к соответствующим лекарствам.
Сегмент M1/M2 длиной 1000 нуклеотидов, в соответствии со своим названием, кодирует сразу два белка — М1 и М2. Из молекул первого из них образован слой (матрикс), подстилающий вирусную липидную оболочку. Обычно М1 играет ключевую роль в формировании вирусных частиц, поскольку он взаимодействует одновременно с поверхностными белками вируса и внутренними компонентами вирусной частицы. Задача матриксного белка — собрать все составляющие воедино [6]. Белок М2 выполняет роль ионного канала. Он расположен в липидной оболочке вируса и способствует его распаковке в цитоплазме клетки [7].
Последний, самый короткий (из 865 нуклеотидов) сегмент РНК вируса гриппа отвечает за синтез двух белков, которые не попадают в зрелую вирусную частицу. Эти белки называются NS1 и NEP. Первый необходим вирусу, в частности, для того, чтобы блокировать считывание информации с клеточных молекул РНК [8]. Благодаря ему клетке приходится синтезировать преимущественно вирусные белки, оставляя свои собственные нужды. Второй белок, NEP, обеспечивает транспорт новообразованных геномных комплексов вируса из ядра к клеточной мембране, где происходит сборка вирионов [9].
Новые штаммы и поиск реассортаций
Классификация штаммов вируса гриппа основана прежде всего на том, какие именно варианты гемагглютинина и нейраминидазы входят в его состав. Широко известные комбинации букв H и N в сочетании с порядковыми номерами (например, H3N2) как раз и обозначают подтип вируса: гемагглютинин 3, нейраминидаза 2. Таких подтипов десятки, однако человека заражают лишь немногие — обычно те, у которых не слишком большие номера N и H. Наиболее давние хозяева вируса гриппа — птицы, от которых новые штаммы время от времени передаются домашнему скоту и, прямо или опосредованно, людям [10]. Чем более долгий период коэволюции провели вместе патоген и хозяин, тем менее болезненным становится их совместное существование. Птичьи штаммы вируса зачастую оказываются очень опасными после передачи новым хозяевам [11].
Известно, что именно реассортации сегментов РНК привели к возникновению штаммов, которые вызвали пандемии азиатского и гонконгского гриппа в 1957 и 1968 гг., унесшие около 2,5 млн жизней [12]. Возможно, что и испанский грипп начала прошлого века, число жертв которого шло на десятки миллионов, тоже появился в результате такой эволюционной схемы [13].
Сам процесс и последствия реассортаций изучены в настоящее время недостаточно полно. В частности, не совсем ясно, как такое резкое изменение генетического материала сказывается на дальнейшей эволюции вируса. Дело в том, что белкам, кодируемым разными сегментами вирусного генома, надо взаимодействовать между собой. Например, это важно при сборке вирусной частицы. В ходе этого процесса на поверхности зараженной клетки концентрируются вирусные белки, интегрированные в липидную оболочку. К ним относятся гемагглютинин, нейраминидаза и М2. Поверхностные белки вируса должны взаимодействовать с матриксом, который в это время формируется под клеточной мембраной. С другой стороны, М1 должен связаться с сегментами генома, чтобы они оказались упакованы в новую частицу. Да и сами сегменты должны собраться вместе таким образом, чтобы составить полный функциональный геном. Все эти ключевые для жизненного цикла вируса молекулярные взаимодействия могут быть затруднены, если белки синтезированы фрагментами геномов разных штаммов, которые еще не «притерлись» друг к другу в ходе совместной эволюции. Возможно, именно из-за этого успешные реассортации происходят сравнительно редко. Однако, коль скоро реассортация случилась, разным кускам генома, оказавшимся в одном новом штамме, надо приспособиться друг к другу.
Можно предположить, что после успешных реассортаций в геноме новой линии вируса должны закрепляться дополнительные точечные мутации, обеспечивающие такую «притирку». Эту гипотезу можно проверить биоинформатическими методами — с помощью компьютерного анализа тысяч прочитанных («отсеквенированных») геномов различных штаммов вируса, содержащихся в открытых базах данных в Интернете.
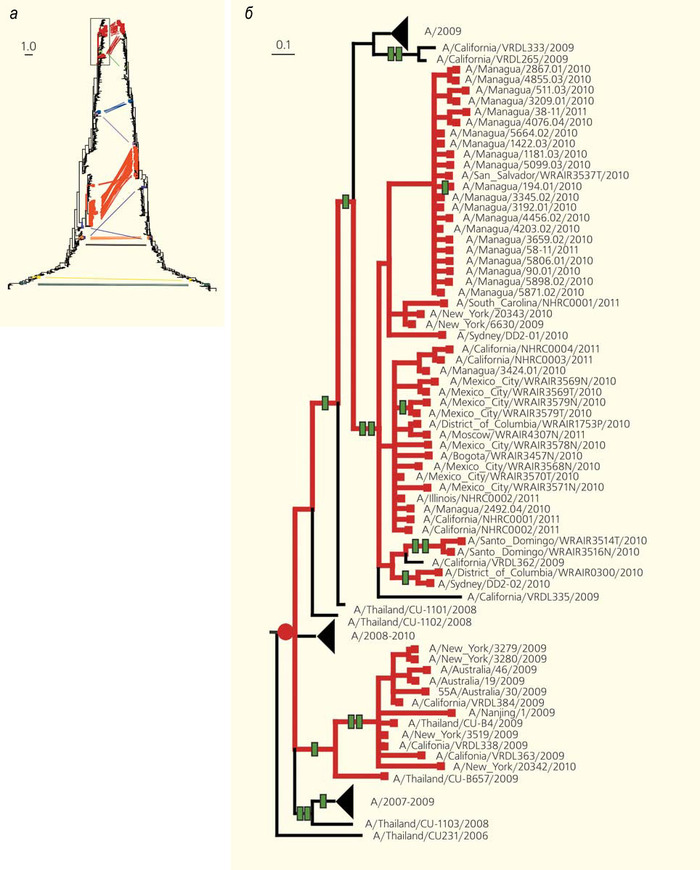
Для этого, прежде всего, необходимо узнать, что в ходе эволюции данной линии вируса гриппа произошла реассортация. Здесь на помощь приходят методы восстановления эволюционных деревьев. С помощью компьютерных программ можно сравнить ряд последовательностей одного и того же гена, взятых из большого числа особей (например, отдельных штаммов вируса), и понять, эволюционное дерево какой формы наиболее вероятно описывает историю этих штаммов. На таком дереве более похожие последовательности будут «сидеть» на близких ветках. Обычно все гены в геноме имеют одну и ту же эволюционную историю и, соответственно, описываются одним и тем же эволюционным деревом. Но из-за реассортации может оказаться, что история разных генов, попавших в один геном, различается, поскольку вирусные частицы-«родители» имеют разное происхождение. Тогда, например, может оказаться, что сегмент HA сидит на одной ветке, а сегмент NA, взятый из того же генома — совсем на другой ветке дерева. Существуют компьютерные программы, которые ищут реассортации как раз по таким несоответствиям между эволюционными деревьями разных генов. Одна из таких программ называется Graphincompatibility-based Reassortment Finder (GiRaF) [14]. Принцип ее работы заключается в построении для некой выборки секвенированных вирусов отдельных филогенетических деревьев по каждому из восьми сегментов генома. Последующее сравнение этих деревьев позволяет обнаружить ветви, в которых построенные деревья не совпадают друг с другом. Такие ветви указывают на то, что в данный период эволюции вируса произошла реассортация, поскольку иначе деревья бы совпали.
Подобное исследование можно провести с использованием геномов вируса гриппа, опубликованных в свободном доступе. Избрав в качестве объекта штаммы H3N2, можно составить выборку из 1376 сегментированных геномов, а затем сравнить между собой филогенетические деревья для этих вирусов, построенные в отдельности по каждому из геномных сегментов [15].
В результате такого сравнения оказалось, что число реассортаций примерно сопоставимо для разных сегментов: в ходе эволюции гриппа в популяции человека каждая пара сегментов в недавнем прошлом реассортировала около 50 раз.
Эволюционные деревья (а), построенные по разным генам (дерево слева — по гену гемагглютинина, справа — по гену нейраминидазы) одного и того же набора штаммов вируса гриппа [15]. Сравнение деревьев позволяет обнаруживать реассортации — моменты эволюционной истории, когда геномы разных штаммов «перемешивались». Без реассортаций два дерева были бы одинаковыми; из-за реассортаций кажется, что некоторые ветки на одном дереве «отрезали и перепривили», чтобы получилось другое дерево. Соответствующие друг другу «листья» на «перепривитых» ветках соединены линиями разных цветов. На увеличенном фрагменте дерева (б) красным кружком обозначен момент реассортации, зелеными прямоугольниками — следовавшие за ним изменения аминокислотной последовательности. На масштабных линейках указана доля изменившихся нуклеотидов
После того как ветви, в которых произошли реассортации, были обнаружены, стало возможным оценить их влияние на накопление в сегментах вирусного генома точечных замен. Для этого можно сравнить время, прошедшее между каждой такой заменой и ближайшей предшествующей ей реассортацией, с тем, которое бы ожидалось из компьютерной модели, если бы реассортации не влияли на замены. Проведенный анализ показал, что по крайней мере в пяти из восьми сегментов генома мутации ускоренно накапливаются после реассортации. Наиболее ярко эффект проявился для нейраминидазы и белка PB1. Ускорение аминокислотных замен после реассортаций вирусных геномов указывает на то, что в такие периоды эволюции вируса гриппа прежде всего происходит адаптация белков к новому генетическому окружению. Из-за того, что вирусные белки взаимодействуют между собой, молекулы из разошедшихся штаммов вынуждены какое-то время изменяться, приспосабливаясь друг к другу.
При этом для разных сегментов эффект ускоренного накопления точечных замен длится разное время. Если реассортация затрагивает субъединицу полимеразы, период «притирки» сегментов к новому копирующему белку оказывается сравнительно долгим. В случае нейраминидазы период повышенной скорости замен короче, и большинство дополнительных точечных замен встречается на филогенетических ветвях, которые сразу следуют за той, что отмечена реассортацией.
Интересно, что у нейраминидаз наблюдалось 30 замен, расстояние от которых до ветви, несущей реассортацию, меньше того эволюционного расстояния, на котором мы бы ожидали встретить одну случайную синонимичную замену в гене данного белка. Такой результат свидетельствует о том, что все эти 30 мутаций произошли и закрепились необычайно быстро, и что необходимость быстрой адаптации возникла именно благодаря тому, что соответствующий сегмент генома попал в новое генетическое окружение.
Какие же именно мутации случаются после реассортаций? Чтобы ответить на этот вопрос, можно разделить мутации на разные категории, пользуясь уже имеющимися знаниями о биологии вируса, о структуре его белков и об их эволюции. Например, известно, что некоторые мутации подвержены так называемому положительному отбору. Это значит, что они увеличивают приспособленность данного штамма — возрастает число вирусных частиц-потомков, которые он производит. В результате на такие «полезные» для вируса мутации начинает действовать дарвиновский естественный отбор, и частота их встречаемости со временем повышается. Такой отбор в поверхностных белках вируса гриппа (гемагглютинине и нейраминидазе), как правило, связан с действием иммунной системы хозяина: более приспособленными оказываются такие мутантные частицы, которые эффективнее «маскируются», избегая иммунитета. Места в белках, которые вирус может изменить, чтобы стать незаметным для иммунной системы, и которые поэтому обычно подвержены такому отбору, хорошо известны [16]. Можно было бы ожидать, что эти места также эволюционируют быстрее и после реассортаций. Но оказалось, что ускорение эволюции после реассортаций происходит совсем в других частях белка. По-видимому, это означает, что за взаимодействия белков друг с другом отвечают не те участки, что за их взаимодействие с иммунной системой.
Кроме того, можно изучить параллельные мутации, которые многократно затрагивали одни и те же позиции в уже эволюционно разошедшихся белках. Оказалось, что такие мутации часто случаются и вскоре после реассортаций. Возможно, это означает, что существенная доля параллельных мутаций происходит как ответ на мутации в других белках вируса. Вирус — тесно скоординированная структура, и, возможно, не только реассортации, но и каждое важное эволюционное событие влечет за собой «шлейф» изменений в других местах того же белка или других белков. Взаимодействия между разными генами и между разными местами одного гена называются эпистазом. Пары замен у вируса гриппа, когда вторая замена нейтрализует вредные последствия первой, были известны и ранее [17]. Оказалось, что замены в сайтах, способные уравновешивать изменения в других местах того же белка, быстро возникают также и после реассортаций, по-видимому, «подстраивая» межбелковые взаимодействия после замен в другом белке. Похоже, существуют такие аминокислоты, изменения которых могут нейтрализовать множество различных «поломок» в вирусном геноме.
Реассортация — это резкое эволюционное изменение, которое поначалу может снижать общую приспособленность вируса к условиям окружающей среды и к организму-хозяину. Однако иногда оказывается, что из-за такой перетасовки белков из разных штаммов новая форма патогена оказывается более приспособленной, чем штаммы-предшественники, получая возможность эффективнее распространиться [18]. Похоже, что за коррекцию первичного вредного эффекта от реассортации как раз и отвечают быстро закрепляющиеся адаптивные мутации.
Предсказания, полученные только статистическими методами, — путем анализа последовательностей белков и кодирующих их генов, — конечно, не могут иметь стопроцентную точность. Действительно ли взаимодействуют две определенные аминокислоты, можно проверить экспериментально. Однако каждый белок вируса состоит из сотен аминокислот, так что возможны десятки тысяч разных взаимодействий. Постановка такого числа экспериментов практически неосуществимы. Биоинформатический анализ позволяет расставлять приоритеты: выбирать и анализировать только те аминокислоты, которые участвуют во взаимодействиях, экономя время и силы экспериментаторов. Кроме того, такой подход позволяет понять, насколько взаимодействия, приводящие к вредности реассортаций, распространены на уровне всего генома.
Вопрос этот отнюдь не праздный. Связь между реассортациями и последующим накоплением аминокислотных замен может быть важна для предсказания возникновения новых линий вируса, способных вызвать пандемии. Например, «птичий» грипп (H5N1) — один из вероятных кандидатов на роль агента будущих серьезнейших эпидемий [19, 20]. Существующие штаммы этого подтипа гриппа в настоящее время не передаются между млекопитающими; однако для того чтобы получить такую способность, вирусу необходимы всего лишь пять дополнительных мутаций либо реассортация в сочетании с четырьмя заменами [21, 22]. При этом две из этих мутаций уже распространены среди вирусов H5N1 [23]. Если произойдет реассортация, недостающие замены могут возникнуть быстрее, чем считалось ранее.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 13-04-02098) и Министерства образования и науки Российской Федерации (проект 11.G34.31.0008).
Георгий Александрович Базыкин — кандидат биологических наук, заведующий сектором молекулярной эволюции в Институте проблем передачи информации им. А. А. Харкевича РАН, ведущий научный сотрудник лаборатории эволюционной геномики факультета биоинженерии и биоинформатики МГУ им. М. В. Ломоносова. Занимается изучением различных вопросов биологической эволюции с использованием методов геномики и биоинформатики.
Юрий Эдуардович Стефанов — кандидат биологических наук, научный сотрудник Института молекулярной биологии РАН им. В. А. Энгельгарта и научный консультант студии научного дизайна Visual Science. Область научных интересов — эволюция мобильных генетических элементов, трехмерное компьютерное моделирование вирусных частиц.
1. Steinhauer D. A., Domingo E., Holland J. J. Lack of evidence for proofreading mechanisms associated with an RNA virus polymerase // Gene. 1992. V. 22. № 2. P. 281–288.
2. Teng Q., Hu T., Li X. et al. Complete genome sequence of an H3N2 avian influenza virus isolated from a live poultry market in Eastern China // J. Virol. 2012. V. 86. № 21. P. 11944. DOI: 10.1128/JVI.02082-12.
3. Carr C. M., Kim P. S. A spring-loaded mechanism for the conformational change of influenza hemagglutinin // Cell. 1993. V. 73. № 4. P. 823–832.
4. Arranz R., Coloma R., Chichуn F. J. et al. The structure of native influenza virion ribonucleoproteins // Science. 2012. V. 338. № 6114. P. 1634–1637. DOI: 10.1126/science.1228172.
5. Kamali A., Holodniy M. Influenza treatment and prophylaxis with neuraminidase inhibitors: a review // Infection and Drug Resistance. 2013. № 6. P. 187–198. DOI: 10.2147/IDR.S36601.
6. Nayak D. P., Hui E. K., Barman S. Assembly and budding of influenza virus // Virus Res. 2004. V. 106. № 2. P. 147–165.
7. Lear J. D. Proton conduction through the M2 protein of the influenza A virus; a quantitative, mechanistic analysis of experimental data // FEBS Lett. 2003. V. 552. № 1. P. 17–22.
8. Hale B. G., Randall R. E., Ortнn J. et al. The multifunctional NS1 protein of influenza A viruses // J. Gen. Virol. 2008. V. 89. № 10. P. 2359–2376. DOI: 10.1099/vir.0.2008/004606-0.
9. Robb N. C, Smith M., Vreede F. T. et al. NS2/NEP protein regulates transcription and replication of the influenza virus RNA genome // J. Gen. Virol. 2009. V. 90. № 6. P. 1398–1407. DOI: 10.1099/vir.0.009639-0.
10. El Zowalaty M. E., Bustin S. A., Husseiny M. I. et al. Avian influenza: virology, diagnosis and surveillance // Future Microbiol. 2013. V. 8. № 9. P. 1209–1227. DOI: 10.2217/fmb.13.81.
11. Kaplan B. S., Webby R. J. The avian and mammalian host range of highly pathogenic avian H5N1 influenza // Virus Res. 2013. V. 178. № 1. P. 3–11. DOI: 10.1016/j.virusres.2013.09.004.
12. Kilbourne E. D. Influenza pandemics of the 20th century // Emerg. Infect. Dis. 2006. V. 12. № 1. P. 9–14.
13. Suzuki Y. A phylogenetic approach to detecting reassortments in viruses with segmented genomes // Gene. 2010. V. 464. № 1–2. P. 11–16. DOI: 10.1016/j.gene.2010.05.002.
14. Nagarajan N., Kingsford C. GiRaF: robust, computational identification of influenza reassortments via graph mining // Nucleic Acids Research. 2011. V. 39. № 6. e34. DOI: 10.1093/nar/gkq1232.
15. Neverov A. D., Lezhnina K. V., Kondrashov A. S., Bazykin G. A. Intrasubtype Reassortments Cause Adaptive Amino Acid Replacements in H3N2 Influenza Genes // PLoS Genet. 2014. V. 10. № 1. e1004037. DOI: 10.1371/journal.pgen.1004037
16. Wolf Y. I., Viboud C., Holmes E. C. et al. Long intervals of stasis punctuated by bursts of positive selection in the seasonal evolution of influenza A virus // Biol. Direct. 2006. V. 1. P. 34.
17. Kryazhimskiy S., Dushoff J., Bazykin G. A. et al. Prevalence of epistasis in the evolution of influenza A surface proteins // PLoS Genet. 2011. V. 7. № 2. e1001301. DOI: 10.1371/journal.pgen.1001301.
18. Li K. S., Guan Y., Wang J. et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia // Nature. 2004. V. 430. № 6996. P. 209–213.
19. Ferguson N. M., Fraser C., Donnelly C. A. et al. Public health. Public health risk from the avian H5N1 influenza epidemic // Science. 2004. V. 304. № 5673. P. 968–969.
20. Yong E. Influenza: Five questions on H5N1 // Nature. 2012. V. 486. № 7404. P. 456–458. DOI: 10.1038/486456a.
21. Herfst S., Schrauwen E. J., Linster M. et al. Airborne transmission of influenza A/H5N1 virus between ferrets // Science. 2012. V. 336. № 6088. P. 1534–1541. DOI: 10.1126/science.1213362.
22. Imai M., Watanabe T., Hatta M. et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets // Nature. 2012. V. 486. № 7403. P. 420–428. DOI: 10.1038/nature10831.
23. Russell C. A., Fonville J. M., Brown A. E. et al. The potential for respiratory droplet-transmissible A/H5N1 influenza virus to evolve in a mammalian host // Science. 2012. V. 336. № 6088. P. 1541–1547. DOI: 10.1126/science.1222526.