до чего окисляются альдегиды
Альдегиды
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
Номенклатура и изомерия альдегидов
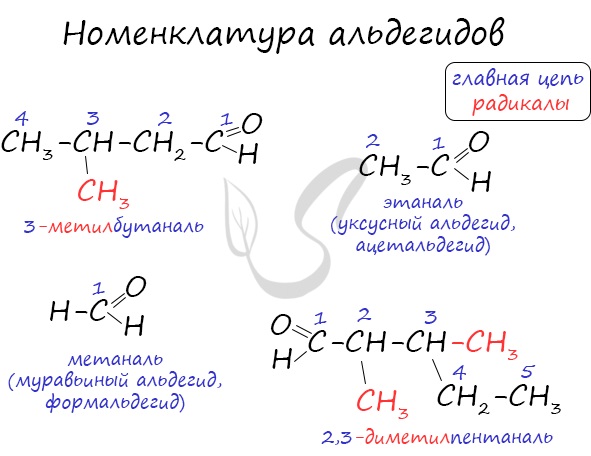
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
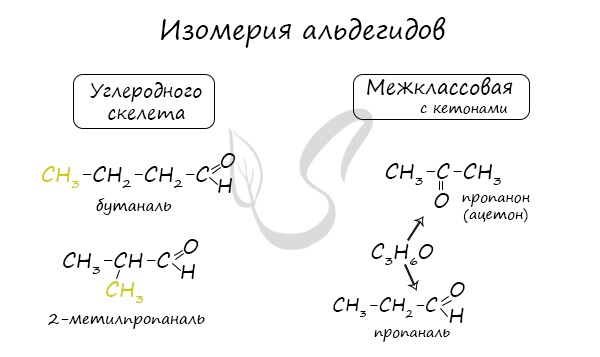
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
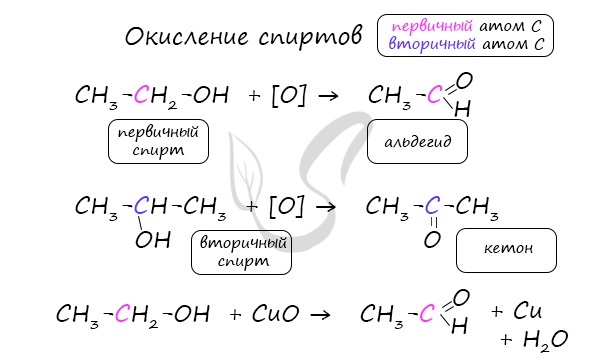
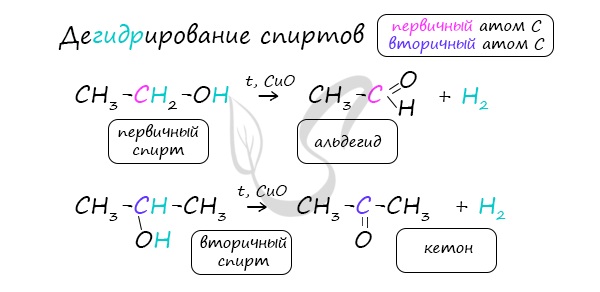
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
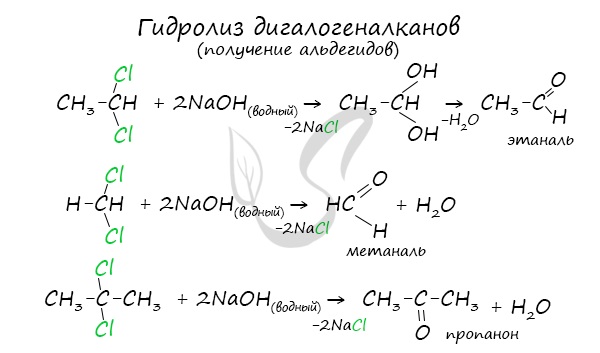
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Окисление альдегидов

Всего получено оценок: 73.
Всего получено оценок: 73.
Общая характеристика альдегидов
В отличие от спиртов и фенолов для альдегидов не характерно образование водородных связей, поэтому у них температура кипения и плавления ниже. К альдегидам относятся такие вещества, как формальдегид, ацетальдегид, акролеин и многие другие. Формальдегид или муравьиный альдегид CH2O является газом с резким запахом. Это вещество необходимо для получения каучука и множества лекарственных веществ. ацетальдегид CH3COH. Это вещество бесцветно и с помощью него получают уксусную кислоту. Акролеин CH2 =CH-COH – это жидкость, которая легко улетучивается. Этот альдегид используется в основном для производства лекарственных препаратов.
Окисление альдегидов
Для альдегидов характерны такие реакции, как присоединение, окисление, образование полимеров. Альдегиды очень легко окисляются, так как при окисленном атоме углерода есть атом водорода. Качественными реакциями на наличие альдегидной группы являются реакции «серебряного зеркала» и реакция восстановления свежеосажденного гидроксида меди (II) до образования красно-оранжевого осадка оксида меди (I):
Реакция «серебряного зеркала» – это восстановление гидроксида диамино-серебра или, как часто именуют, оксида серебра. Свое название реакция получила благодаря едва заметному налету, появляющемуся на стенках пробирки в процессе реакции. Температура, при которой происходит реакция, может достигать 80-100 градусов по Цельсию.
Достаточно эффективной является реакция окисления альдегидов гидроксидом меди (II). В процессе реакции двухвалентная медь восстанавливается до одновалентной в составе реактива Фелинга.
Реактив Фелинга – химический реактив, состоящий из раствора соли натрия-калия тартрата и раствора сульфата меди
Окисление альдегидов также может происходить под действием реактива Джонса. При этом способе, в отличие от других, повышение температуры не требуется, и реакция проводится при температуре 0-20 градусов. Реагент состоит из оксида хрома (VI), который разбавлен в серной кислоте и ацетоне.

Иногда альдегиды могут окисляться йодом в присутствии щелочи, а также диоксидом селена и перманганатом калия.
Что мы узнали?
Альдегиды – сильные окислители. Эти соединения способны окисляться в результате реакции Фелинга, реакции «серебряного зеркала», а также под действием реактива Джонса, йода и диоксида селена.
Альдегиды и кетоны
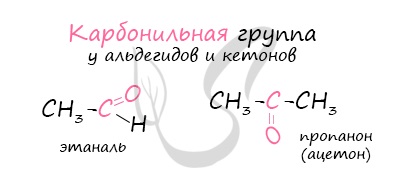
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
Структурная формула кетонов:
Строение карбонильных соединений
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120 о друг к другу.
π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
| На атоме кислорода возникает частичный отрицательный (δ – ), а на атоме углерода – частичный положительный (δ + ) заряды. |
Номенклатура карбонильных соединений
Нумерация ведется от атома углерода карбонильной группы.
| Например, 2-метилпропаналь |
Изомерия карбонильных соединений
Изомерия альдегидов
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н8О соответствуют два альдегида-изомера углеродного скелета |
| Бутаналь | 2-Метилпропаналь |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
 |  |
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют кетоны-изомеры углеродного скелета |
| Пентанон-2 | 3-Метилбутанон-2 |
 |  |
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют два кетона-изомера углеродного скелета |
| Пентанон-2 | Пентанон-3 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
 |  |
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
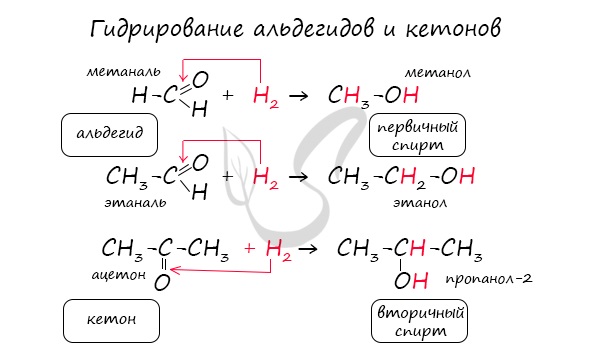
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
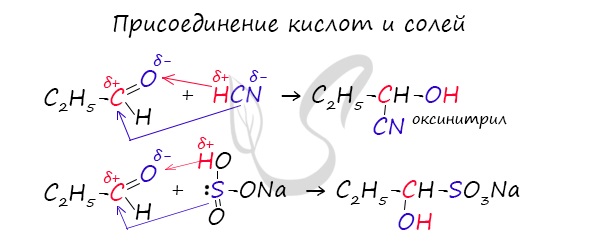
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.