двуокись натрия что это такое
Гидроксид натрия (Е524)

Общая характеристика
Научное название добавки Е524 – гидроксид натрия или едкий натр. Это очень агрессивное вещество синтетического происхождения не имеет аналогов в природе. В естественных для себя условиях оно принимает вид белых чешуек или небольших гранул мыльных на ощупь.
В наше время широко используется в разных отраслях жизнедеятельности, в том числе медицине, фармакологии, пищевой индустрии. В сельском хозяйстве, например, каустическую соду используют для проверки коровьего молока на наличие примесей. Это вещество применяют в производстве разных видов бытовой химии (самые популярные – для прочистки водопроводных и канализационных труб). В косметологии едкий натр добавляют в шампуни, мыло, жидкости для снятия лака, кремы, а также в средства для избавления от ороговевшей кожи. Кроме того, гидроксид натрия – незаменимое вещество в нефтеперерабатывающей, целлюлозно-бумажной промышленности и в производстве дизельного топлива.
В пищевой промышленности гидроксид натрия используют для регуляции кислотности, как стабилизатор и эмульгатор. Несмотря на весьма агрессивные свойства и внушительный список побочных эффектов, каустическая сода в качестве пищевой добавки разрешена во всем мире.
Опасные свойства каустической соды
Каустическая сода – довольно опасное вещество. На коже и слизистых оболочках при контакте с ней образуются глубокие и очень болезненные раны. Очень опасен контакт каустической соды с глазами, так как вызывает атрофию зрительного нерва, что ведет к слепоте. Если случайно вдохнуть порошок едкого натра, начнется приступ сильного кашля, одышка, появится боль в горле и даже возможен отек дыхательных легких. И можно только представить себе, что это вещество способно делать с нашими внутренними органами. Если случайно проглотить каустическую соду, очень быстро в животе появится сильная боль и чувство жжения, возможен анафилактический шок. При малейшем подозрении на отравление гидроксидом натрия важно немедленно вызвать скорую помощь. Участки кожи, пораженные едким натром, следует промыть несильным раствором борной или уксусной кислоты, слизистые оболочки – чистой водой, глаза – сначала обработать очень слабым раствором борной кислоты, а затем водой.
Хоть в пищевой промышленности гидроксид натрия используют в микродозах, но при регулярном употреблении пищи, содержащей Е524, возможны побочные эффекты.
В чем может содержаться

Самая известная сдоба, приготовленная с использованием каустической соды – это немецкие рогалики. Черные консервированные оливки получают свой темный цвет и характерную консистенцию также благодаря добавке Е524. В изделиях из шоколада, какао, сливочного масла или других видов жиров гидроксид натрия ускоряет расщепление белков. Эта добавка приходит на помощь и тогда, когда необходимо быстро и без труда очистить плоды от кожицы. Для этого фрукты, ягоды или овощи просто обрабатывают каустической содой. Кроме того, регулятор кислотности Е524 используют в производстве кисломолочной продукции, маргаринов, мороженого, разных видов сладостей.
Гидроксид натрия – опасное химическое соединение. И хоть в пищевой промышленности Е524 используется в небольших дозах, которые обычно не представляют опасности для человека, излишняя осторожность не повредит. Если не желаете или не можете отказаться от Е-содержащей пищи сами, то постарайтесь хотя бы минимизировать количество «ешек» в рационе маленьких детей. А для этого не забывайте перед покупкой продукта проверять, из чего он состоит.
Гидроксид натрия
С химическим соединением, называемым каустической содой, человек встречается ежедневно. Гидроксид натрия, химическая формула которого обозначается NaOH, относится к разряду едких и сильных щелочей, опасных для кожи и слизистых человека. Одновременно с этим она активно используется пищевой промышленностью, косметологией, фармацевтикой. Ни одно средство личной гигиены не обходится без добавления этого соединения. Химические свойства вещества сделали его самым популярным среди регуляторов кислотности и средств для поддержания консистенции.
Что такое гидроксид натрия
Это соединение – едкая щелочь, которая применяется не только пищевой, фармацевтической и косметической сферами, но и химической промышленностью. Гидроокись натрия, или каустическая сода, выпускается в виде немного скользких твердых гранул желтоватого или белого цвета. При сильной концентрации NaOH разъедает органические соединения, поэтому способен вызвать ожог. Используется как пищевая добавка Е524, необходимая для поддержания консистенции продуктов.
Формула
Вещество имеет химическую формулу NaOH. Соединение взаимодействует с различными веществами любых агрегатных состояний, нейтрализуя их, с кислотами, образуя соль и воду. Реакция с атмосферными оксидами и гидроксидами позволяет получить тетрагидроксоцинкат или алкоголят. Едкий натр применяется для осаждения металлов. Например, при реакции с сульфатом алюминия образуется его гидроксид. Осадок не растворяется и не наблюдается избыточное получение щелочи. Это актуально при очистке воды от мелких взвесей.
Свойства
Соединение растворяется в воде. Технический Sodium Hydroxide представляет собой водный раствор гидроксида натрия в щелочеустойчивой герметичной таре. При взаимодействии с водой каустик выделяет большое количество тепла. Вещество имеет следующие свойства:
Получение
Каустическая сода встречается в составе минерала брусита. Второе по величине месторождение сконцентрировано на территории России. Гидроокись благодаря исследованиям Николы Леблана, проведенным в 1787 г., получают методом синтеза из хлористого натрия. Позже востребованным способом добычи стал электролиз. С 1882 г. ученые разработали ферритный метод получения в лаборатории гидроксида с помощью кальцинированной соды. Электрохимический способ сейчас самый популярный: ионы натрия образуют его раствор едкой ртути – амальгаму, которая растворяется водой.
Применение гидроксида натрия
Нет более распространенной щелочи, чем каустическая сода. Ежегодно потребляется порядка 57 млн т. Едкий натрий используется при получении лекарственных препаратов, фенола, органических красителей, глицерина. Еще одна сфера применения – дезинфекция помещения из-за способности химического соединения нейтрализовать вредные для человека вещества, находящиеся в воздухе. Еще гидроокиси широко используются для поддержания формы продуктов (пищевая промышленность).
В промышленности
Гидроокись натрия относится к сильной основе для химических реакций и активно применяется разными отраслями благодаря своим свойствам:
Пищевая добавка
Каустическая сода очищает овощи, фрукты от кожицы. Применяется вещество для придания цвета карамели. Как пищевая добавка E524 (класс регуляторов кислотности, веществ против комкования наряду с карбонатом натрия) используется при изготовлении какао, мороженого, сливочного масла, маргарина, шоколада, безалкогольных напитков. Оливки и маслины размягчаются, приобретают черный цвет.
Пищевые продукты – рогалики и немецкие крендели (брецели) – обрабатывают едким раствором для хрустящей корочки. В скандинавской кухне существует рыбное блюдо – лютефиск. Технология приготовления включает вымачивание на протяжении 5-6 суток сушеной трески в растворе гидроокиси, пока не будет получена желеобразная консистенция. В пищевой промышленности сода помогает рафинировать растительное масло.
В производстве моющих средств
Способность взаимодействия жиров у каустика была замечена уже давно. С VII века арабы освоили получение твердого мыла с помощью едкого натра и ароматических масел. Эта технология осталась прежней. Каустическая сода добавляется в шампуни, моющие вещества, средства личной гигиены. Косметическая промышленность применяет гидроксид Na для получения мыла против жиров, жидкости для снятия лака, кремов.
В быту
Основной способ применения – гелеобразный гидроксид или его гранулы. Входит в состав средств для устранения засоров канализации, систем отопления. Грязь растворяется, дезагрегируется и проходит дальше по трубе. Изделия из нержавеющей стали очищаются от масляных веществ с помощью каустической соды, разогретой до 50-60°С с добавлением гидроксида калия. Косметология применяет гель на его основе для размягчения ороговевшей кожи, папиллом, бородавок.
Гидроксид натрия в медицине
Соединение добавляется в лекарственные препараты против повышенной кислотности желудка, для слабительного эффекта сильного действия. Такое средство приводит к повышению перистальтики кишечника. Использование вещества восстанавливает кислотно-щелочной баланс. Применяется оно в медицине для достижения успокоительного эффекта, пригодно для очистки воды от примесей. Благодаря хлориду натрия остаются постоянными индикаторы осмотического давления плазмы крови. Не стоит путать его с пищевой содой, поваренной солью.
Вред гидроксида натрия
Вещество относится ко второму классу опасности. Из-за способности гидроокиси разъедать органические соединения применение каустика должно осуществляться с соблюдением всех мер предосторожности. При попадании щелочи на слизистые и кожу она вызывает сильные ожоги, а взаимодействие с глазами приводит к атрофии зрительного нерва. Для нейтрализации гидроксида на коже применяется слабый раствор уксуса и большое количество проточной воды.
Видео
Польза пищевой соды
Здравствуйте, дорогие читатели! Наверняка у каждой хозяйки в кухонном шкафу найдётся баночка пищевой соды. Ее мы используем в кулинарных целях, когда готовим тортики, пирожки, блинчики. А знаете ли вы, чем полезна пищевая сода, если принимать ее внутрь? Если нет тогда, читайте эту публикацию.
Традиционное использование соды
Читаю Википедию, цитирую почти дословно: «Пищевая или питьевая сода, химическая формула NaHCO3 – это натриевая соль угольной кислоты, имеет вид порошка с мелкими кристаллами. При взаимодействии с кислотами происходит распад на карбонат натрия, CO2 и H2O. Другое название порошка натрия бикарбонат, двууглекислый натрий».
Питьевую соду получают промышленным путём, насыщая хлорид натрия углекислым газом под давлением. В России двууглекислый натрий производится по ГОСТу в Крыму, в республике Башкортостан, где порошок имеет официальную регистрацию как пищевая добавка Е500.
Где применяется двуокись натрия?
Как мы видим, бикарбонат натрия используют в разных областях, но основное свое применение содовый раствор нашел в медицине. Предлагаю посмотреть видео на эту тему:
Для чего используют раствор соды в официальной медицине?
Раствор гидрокарбоната натрия 4% применяется в терапии как жидкость для внутривенного введения. Медицинский препарат на основе бикарбоната натрия используется для ощелачивания патологической кислой среды и устранения последствий ацидоза (закисления).
Метаболический ацидоз возникает при различных патологиях и проявляется как нарушение кислотно-щелочного баланса в сторону закисления, при этом показатели бикарбоната натрия в плазме крови понижены.
Когда появляется такое состояние?
Содовый раствор применяется для снятия симптомов тяжелого похмелья, для разжижения крови, то есть при всех тех состояния, когда в крови и тканях органов различные кислоты начинают преобладать над щелочными растворами и равновесие нарушается.
Закисление организма – причина многих болезней
Бикарбонат натрия является тем компонентом, который составляет основу нашей крови, если соды не хватает, мы с вами постепенно закисляемся и умираем.
Чтобы восстановить баланс, организм начинает расходовать калий и кальций, магний и натрий, железо и другие микроэлементы. Кроме этого для уменьшения концентрации кислоты ткани задерживают воду, что делает кровь гуще и еще больше тормозит метаболизм.
В результате такие вещества как мочевина, креатинин, молочная кислота, соли натрия, калия и др. не удаляются из организма, а откладываются в тканях, образуя шлаки и отложение солей.
Немногие придают значение тому факту, что для организма закисление наносит вред. Состояние приводит к быстрому утомлению, слабости мышц, бессоннице, депрессии, снижению работоспособности и умственной активности.
Также вымывается кальций из костей, ослабевает иммунитет, появляется напряжение в шее, плечах, снижается активность антител в борьбе с вирусами, бактериями, раковыми клетками.
В чем заключаются полезности бикарбоната натрия для организма?
Сода с водой при приеме внутрь имеет мыльно соленый вкус. Но положительное действие раствора выражено так ярко, что этот изъян не такой уж существенный. Какие полезные свойства имеет этот чудесный порошок?
Щелочная среда некомфортна для размножения патологической микрофлоры: глистов, бактерий, вирусов. Применение соды вызывает гибель этих микроорганизмов, либо они уходят из заражённых органов. А здоровые клетки в этой среде, наоборот, процветают, омолаживаются.
Любые виды интоксикации можно лечить раствором порошка в воде. С течением жизни мы постоянно отравляем свой организм вредными привычками, такими как курение и употребление алкоголя.
Мы едим некачественные продукты с красителями, консервантами, нитратами, вдыхаем воздух, отравленный выхлопными газами, испытываем на себе действие радиации, употребляем в пищу много животного белка и других продуктов, которые при переваривании выделяют различные кислоты.
Закисление делает кровь гуще, обменные процессы притормаживаются, клетки в тканях двигаются медленно, либо отмирают.
Рост раковых клеток как результат закисления
Официальная медицина заявляет, что злокачественная опухоль трудно поддается лечению. Между тем существуют альтернативные методики, которые ведут борьбу с новообразованиями при помощи раствора бикарбоната натрия. Разработал метод итальянский врач Симончини, который доказал влияние канцерогенов на окисление тканей.
Если кратко, та суть метода состоит в том, что сода действует на раковые клетки как вода на сахар. Продукты распада вымываются в кровь, человеку становится хуже, поднимается температура, появляются симптомы интоксикации.
В это время пациент должен пройти курс дезинтоксикационной терапии, состоящий из 10 капельниц, чтобы вывести вредные вещества из организма.
У Симончини появилось много последователей, в том числе и в России. Я думаю, что с медицинской точки зрения определенная логика в этом есть, если начинать лечение на 1-2 стадии. Но традиционные врачи живут по инструкциям ВОЗ, которая этот метод отрицает. А отзывы бывших онкобольных говорят об обратном.
В настоящее время я подробно разбираюсь ещё в одном интересном вопросе: это связь между хроническим ацидозом и ВИЧ-инфекцией. То есть снижение иммунитета есть, а инфекции нет. Доводы деятелей движения «Антиспид», куда входят известные практикующие врачи, мне кажутся более убедительными, чем доводы официальной медицины.
Принимаем пищевую соду и избавляемся от закисления. Личный опыт
Если меня спросят, полезно или вредно пить соду, мой ответ будет положительным, так как средство испытано на себе.
Случайно узнала из интернета о лечении содой хронической усталости. У меня в это время снизилась работоспособность, утром после сна появлялось такое ощущение, как будто и не отдыхала совсем, активности хватало в лучшем случае до обеда, потом хотелось прилечь отдохнуть.
Если не было возможности для дневного отдыха, приходилось прикладывать неимоверные усилия, чтобы заниматься обычными делами. Никаких болезней у меня не находили, все анализы в порядке, давление в норме.
Решила попробовать один раз и… о чудо. Весь день чувствовала бодрость, легкость, самочувствие прекрасное, настроение отличное, усталости как не бывало.
Всё время, пока я пила соду, разбавленную водой, никаких намеков на бывшие симптомы не появлялось. Как это обычно бывает, моего энтузиазма хватило дней на десять. Через какое-то время все признаки вернулись ко мне. Вновь стала пить раствор питьевой соды по утрам до завтрака и снова все прошло.
Стала изучать этот вопрос более детально и вот что я выяснила: мало того, что раствор соды надо пить регулярно, так ещё это нужно делать по определенным правилам.
Как пить раствор натрия двууглекислого, чтобы польза была наибольшей?
В первую очередь нужно изучить противопоказания. Употреблять раствор при 3 и 4 стадии рака, язвенной болезни запрещается, также стоит избегать попадания сухого порошка на слизистой глаза или вдыхать пыль из двуокиси натрия, чтобы избежать раздражения дыхательных путей. Во время беременности также исключаем эксперименты над собой.
Во вторую очередь берём себе за правило главный принцип медицины «Не навреди»! Не забываем о том, что правильный обмен веществ называется равновесие, то есть сильное ощелачивание (алкалоз) так же вредно, как и закисление. Превышать рекомендуемые дозы не нужно, во всём хороша мера.
Итак, советы и рекомендации:
Обращаю ваше внимание, что нужно ограничить не кислые продукты, а кислотные, то есть те, которые при переваривании закисляют организм. Это, главным образом, белки животного происхождения, кофе, спиртные напитки, дрожжевой хлеб, сладкая выпечка.
Существует мнение, что бобовые и зерновые также увеличивают кислотность внутренней среды. Я избавляюсь от этого очень просто: все крупы, горох, фасоль перед употреблением я промываю, эффект будет значительнее, если их замачивать, а затем воду выливать.
Другое применение пищевой соды
Эта тема настолько обширна, что в одной статье очень трудно осветить все способы использования данного вещества. Расскажу кратко, где ещё можно применять натрий двууглекислый.
Для похудения – откладываем в сторону ложки, стаканы, ничего не придется есть и пить, с содой мы принимаем ванны. Одну упаковку растворяем в воде 400 С, можно добавить морскую или поваренную соль, эфирные масла. Длительность процедуры 20 минут, в течение этого времени поддерживаем температуру ванны. Дальше оборачиваемся махровым полотенцем и отдыхаем;
В косметологии – для роста и укрепления волос перед мытьем кожу головы натирают кашицей из соды и воды;
Для детских вещей – чтобы исключить контакт ребенка с химическими веществами нужно приучиться мыть детскую посуду – соски, бутылочки, кружки и ложки – пищевой содой. Кроме этого порошок является отличным средством для обработки игрушек;
Для мужчин – применение сидячих 15-минутных ванночек помогает в лечении простатита, аденомы простаты, предупреждает вялую эрекцию и некачественную потенцию;
В саду, на огороде, дачном участке – дачники, огородники применяют раствор пищевой соды для борьбы с фитофторозом и мучнистой росой, а также ощелачивают слабокислую и кислую почву.
Заключение
Все мы разные и это замечательно! Учитесь слышать свой организм, доверяйте своим ощущениям. Организм не будет советовать то, что будет опасным для вас или навредит. Свой образ жизни, характер вы знаете как никто другой, и только вы выбираете способы, которые максимально подходят для вас. Желаю вам удачи и доброго здоровья!
Гидроксид натрия
| Гидроксид натрия | ||||||||
 | ||||||||
 | ||||||||
| Общие | ||||||||
|---|---|---|---|---|---|---|---|---|
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щелочь | |||||||
| Химическая формула | NaOH | |||||||
| Физические свойства | ||||||||
| Молярная масса | 39,997 г/моль | |||||||
| Плотность | 1,59 г/см³ | |||||||
| Термические свойства | ||||||||
| Температура плавления | 323 °C | |||||||
| Температура кипения | 1403 °C | |||||||
| Химические свойства | ||||||||
| Растворимость в воде | 108,7 г/100 мл | |||||||
| Безопасность | ||||||||
| Токсичность | Ацетат уранила-цинка | |||||||
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | желто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнен примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твердый продукт в виде гранул или хлопьев.
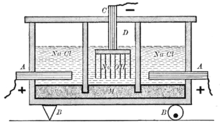
Электрохимические методы получения гидроксида натрия
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl − в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Диафрагменный метод
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую, иногда, добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и хлор, а из анодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щелочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щелочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щелоков самым эффективным способом является электролиз с ртутным катодом. Щелока, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (Для некоторых производств это критично. Например, в производстве искусственных волокон можно применять только высокочистый каустик.), а по сравнению с мембранным методом организация процесса при получении щелочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na + + е = Na 0 nNa + + nHg − = Na + Hg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твердым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизер диафрагменного или мембранного типа.
Рынок каустической соды
Мировое производство натра едкого, 2005 год
| Производитель | Объём производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Solvay | 1.252 | 2.2 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого:
ТР — твёрдый ртутный (чешуированный);
ТД — твёрдый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Показатели российского рынка жидкого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик», Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром», Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром», Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
Показатели российского рынка твердого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик», Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром», Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: