гранулематозная болезнь что это
Гранулематозная болезнь что это
При хронической гранулематозной болезни нейтрофилы и моноциты сохраняют способность поглощать каталазаположительные микроорганизмы, но из-за отсутствия метаболитов кислорода не уничтожают их. Это заболевание встречается редко (4-5:1 000 000) и наследуется рецессивно. Причиной служат мутации генов, кодирующих компоненты НАДФ-оксидазы (одного на Х-хромосоме и трех аутосомных генов).
Генетика и патогенез хронической гранулематозной болезни. Активация НАДФ-оксидазы в нейтрофилах требует сборки в клеточной мембране отдельных субъединиц фермента. Вначале происходит фосфорилирование катионного цитоплазматического белка p47phox (белок «оксидазы фагоцитов» с молекулярной массой 47 кДа). Фосфорилированный p47phox вместе с двумя другими цитоплазматическими компонентами оксидазы — р67phox и низкомолекулярной гуанозинтрифосфатазой (Rac-2) — транслоцируется в клеточную мембрану, где все эти белки взаимодействуют с цитоплазматическими доменами трансмембранного флавоцитохрома b558, образуя активную оксидазу.
Флавоцитохром представляет собой гетеродимер, состоящий из двух пептидов — p22phox и богатого углеводными остатками gp91phox. Согласно современной модели, три трансмембранных домена N-концевой части флавопротеида содержат остатки гистидина, определяющие связывание гема. Пептид р22phoxстабилизирует gp91phox. Роль p40phox в активации оксидазы остается неясной. Пептид gp91phox необходим для транспорта электронов с участием НАДФ-, флавин- и гемсвязывающего доменов. Пептид р22phox не только стабилизирует gp91phox, но и содержит сайты связывания цитоплазматических субъединиц фермента. Цитоплазматические р47phox, р67phox и Rac-2, по-видимому, играют регуляторную роль, активируя цитохром b558.
Примерно 2/3 больных с хронической гранулематозной болезнью — это мужчины, наследующие мутации расположенного на Х-хромосоме гена, который кодирует gp91phox, а 1/3 больных аутосомно-рецессивно наследуют мутацию гена, кодирующего р47phox (хромосома 7). Около 5% больных аутосомно-рецессивно наследуют дефекты генов р67phox (хромосома 1) и р22phox (хромосома 16).
Нормальная фагоцитарная функция нейтрофилов требует активации НАДФ-оксидазы. Электроны переносятся с НАДФ-Н на флавин, затем на гемовую простетическую группу цитохрома b558 и, наконец, на молекулярный кислород, приводя к образованию О2-. При неэффективном функционировании этой системы О2- не образуется.
Нарушения окислительного обмена в нейтрофилах при хронической гранулематозной болезни создают условия для выживания микробов. Среда в вакуолях фагоцитов остается кислой, и бактерии не перевариваются. Окраска макрофагов больных гематоксилин-эозином выявляет золотистый пигмент, отражающий накопление в клетках поглощенного материала, что и лежит в основе диффузного гранулематоза, давшего название этой патологии.
Клинические проявления хронической гранулематозной болезни
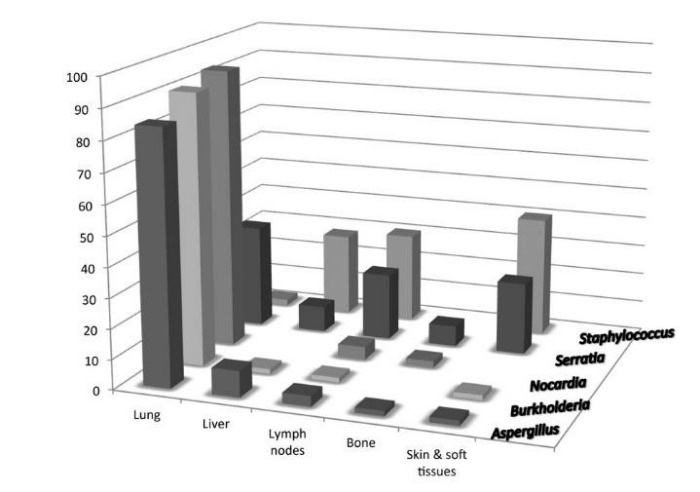
Подозревать хроническую гранулематозную болезнь следует у любого больного с повторными или необычными лимфаденитами, печеночными абсцессами, множественным остеомиелитом, частыми инфекциями в семейном анамнезе или инфекциями, вызываемыми каталазаположительными микробами (например, S. aureus).
Клинические признаки и симптомы хронической гранулематозной болезни могут возникать как в грудном, так и в раннем зрелом возрасте. Частота возникновения и тяжесть инфекционных заболеваний крайне непостоянны. Возбудителем обычно является S. aureus, хотя возможно инфицирование любыми другими каталазаположительнымим микроорганизмами. К частым возбудителям инфекций относятся Serratia marcescens, Burkhoderia cepacia, Aspergillus, Candida albicans и Salmonella. Обычно возникают пневмонии, лимфадениты и поражения кожи.
Осложнения хронических инфекций включают анемию, лимфаденопатию, гепатоспленомегалию, хронический гнойный дерматит, рестриктивные нарушения, гингивит, гидронефроз и стеноз привратника. На возможность хронической гранулематозной болезни указывают также парапроктиты и повторные кожные инфекции, в том числе фолликулиты, гранулемы и дискоидная красная волчанка. Гранулемы и воспалительные процессы, если они вызывают стеноз привратника, сужение мочеиспускательного канала или свищи прямой кишки, напоминающие болезнь Крона, требуют безотлагательного подтверждения диагноза.
Современные представления о хронической гранулематозной болезни (ХГБ)
Хроническая гранулематозная болезнь (ХГБ) — достаточно неплохо изученное на сегодняшний день наследственное заболевание, связанное с недостаточностью фагоцитарной системы, следствием которой является иммунодефицит. Впервые ХГБ была описана в 1959 году у детей, для которых болезнь оказалась смертельной [1]. Болезнь не поддавалась лечению; на аутопсии выявляли генерализованное гранулематозное воспаление, отличающееся по своей специфике от известных на тот момент инфекционных и неинфекционных заболеваний.
Сегодня нам известно намного больше. Заболевание в большинстве случаев более не является смертельным, выявляется в основном у детей (врожденный иммунодефицит проявляется достаточно быстро), неплохо купируется. Однако до сих пор ХГБ относится к заболеваниям неизлечимым.
Этиология и патогенез
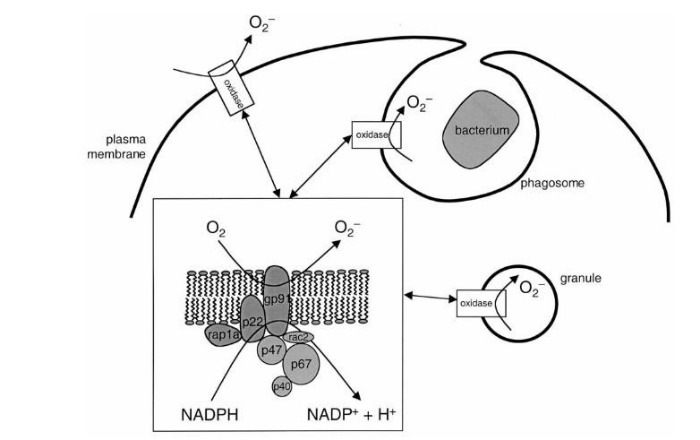
Сущность хронической гранулематозной болезни — в недостаточности фермента НАДФ-оксидазы, который представляет собой комплекс каталитических протеинов. Этот фермент, находясь в фагоцитирующих клетках, обеспечивает перенос электрона с НАДФ на молекулярный кислород: происходит т. н. «респираторный взрыв» (см. Рис. 1). Строго говоря, данный фермент есть не только у фагоцитов: единственным специфичным для них белком является трансмембранный gp91, остальные же компоненты встречаются в самых разных клетках [2].
Обратимся к рисунку 1. Белки gp91 и p22 объединяют в цитохром b558 — мембраносвязанную часть фермента НАДФ-оксидазы, остальные протеины называют цитозольными. При активации фагоцита различными медиаторами цитозольные p47 и p67 фосфорилируются и связываются вместе. Комплекс приобретает сродство к белкам p47 и rac2 — таким образом, присоединяясь к ним, данные протеины вызывают конформационные изменения в мембранном цитохроме b558, — и комплекс приобретает оксидазную активность [2, 5]. НАДФ-оксидаза переносит электрон от своего кофермента НАДФ на кислород с формированием активных форм кислорода (АФК) — O 2- и H2O2. Вот здесь и начинается самое интересное.
Классически считается, что фагоцит убивает микробы, образуя фаголизосому с бактерией или грибом, воздействуя на них большими дозами высокотоксичных АФК; однако в последнее время приобретает актуальность иная точка зрения. В 2002 году в Nature была опубликована статья, авторы которой пересмотрели всю парадигму деактивации поглощенных микробов.
Ученые обнаружили, что если в фагоцитах мышей определяется нормальный уровень активных форм кислорода, но имеется недостаточность лизосомальных ферментов — животные будут беззащитны против стафилококковых и кандидозных инфекций. То есть, несмотря на наличие нормального респираторного взрыва, иммунодефицит все равно присутствует. Стало быть, эффекторами в инактивации микроба являются не сами АФК [6].
Согласно новой модели, АФК являются медиаторами в уничтожении микроба, а непосредственные «убийцы» — ферменты лизосом, обладающие протеолитической активностью. Как известно, при захвате фагоцитом микроба формируется вакуоль — (фагосома), с которой впоследствии сливается лизосома макрофага [7]. На мембране этой вакуоли и функционирует НАДФ-оксидаза, постоянно увеличивая концентрацию АФК. Однако как уже было сказано, данный процесс — не конечный эффекторный механизм.
Наследование и генетика
Хроническая гранулематозная болезнь имеет наследственную природу. Приблизительно данной патологией страдает 1 на 250 000 [9], что делает заболевание достаточно редким и потому трудным в диагностическом отношении. Заболевание вызывает мутация любого из четырех генов, кодирующих субъединицы ключевого фермента фагоцитоза НАДФ-оксидазы. Более двух третей случаев связаны с X-сцепленным наследованием (дефект гена CYBB, кодирующего белок p-91); остальные случаи связаны с аутосомно-рецессивным наследованием генов CYBA, NCF-1 и NCF-2, кодирующих белки p22, p47 и p67 соответственно. Исходя из этого болезнь обозначают как ХГБ X91, A22, A47 и A67 (в зависимости от типа наследования и локуса гена) [10].
Примечательно, что в литературе нет (или крайне мало) доказанных случаев наследственного дефекта других субъединиц. Однако в последнее время обнаруживаются все новые мутации генов, следствием которых становится ХГБ: например, в 2009 году выделили еще один подвид ХГБ, связанный с аутосомно-рецессивной мутацией гена p-40 [11], имеются также сведения о единственном пациенте с недостаточностью белка Rac2 — [10]. Вполне вероятно, что могут существовать и другие генетические патологии, вызывающие данное заболевание.
Диагностика
Диагностика ХГБ основана на выявлении клинических признаков, кроме того, важно выявить наличие или отсутствие респираторного взрыва. Последнее можно осуществить несколькими гистологическими и иммунологическими методами, например, окрашивание нитросиним тетразолием (НТЗ) позволяет определить, вырабатывают ли клетки АФК — НТЗ будет утилизироваться активными формами кислорода, в результате чего из бледно-желтого тетразолия образуется голубой формазан [12].
Среди наиболее ярких клинических симптомов можно выделить: пиодермию, пневмонию, воспалительные процессы желудочно-кишечного тракта, лимфаденит, абсцесс печени и остеомиелит [13] на фоне рецидивирующих бактериальных и грибных инфекций.
В крови выявляется гипергаммаглобулинемия и анемия. В местах дренажей — хроническое воспаление с образованием гранулем. Также гранулемы могут формироваться в различных тканях и органах: например, в желудке гранулематозное воспаление способно привести к обструкции желудочного канала, в урогенитальном тракте — к циститу. Также следует упомянуть, что почти 20 % больных ХГБ страдает от гранулематозного колита, который легко перепутать с болезнью Крона [14].
Также следует упомянуть о недавно открытой бактерии, выявленной у пациентов с ХГБ, которую исследователи предложили назвать Granulobacter bethesdensis. Это грамотрицательная палочка, которая на данный момент не может быть отнесена ни к одной из существующих таксономических групп; бактерия поражает лимфоузлы, кроме того, резистентна к антибиотикам in vitro и, скорее всего, — in vivo [18, 19]. Предполагается, что это — лишь первая из подобных бактерий, возникшая в эру антибиотиков. На данный момент Granulobacter bethesdensis не слишком распространена, однако имеет к этому весьма опасную тенденцию.
Лечение
В настоящее время активно разрабатываются методики, которые смогут не просто позволить больным с ХГБ жить полноценно, но и в перспективе совершенно избавить их от бремени заболевания. Поскольку болезнь наследственная, крайне трудно придумать что-то существенное, однако такие попытки предпринимаются, и некоторые из них обнадеживают.
Одна из них — лечение хронической гранулематозной болезни с помощью генной инженерии [20]. В 2006 году в Nature Medicine была опубликована статья, авторы которой сообщили об успешной коррекции генома двух пациентов с X-сцепленной формой ХГБ. После лечения у пациентов определяли активность нейтрофилов с помощью позитронно-эмиссионной томографии, а также других инструментальных методов. Исследование показало, что в обоих случаях фагоциты после проведенного лечения смогли оказать сопротивление инфекции. На данный момент это — одна из самых многообещающих методик.
Еще одним способом терапии является пересадка гемопоэтических клеток [21]. Двадцати семи пациентам после миелоаблативного режима кондиционирования (подготовка пациента к трансплантации с помощью лучевой или цитостатической терапии — прим. автора) пересадили гемопоэтические стволовые клетки от наиболее подходящих доноров (по белкам HLA — главного комплекса гистосовместимости). Двадцать три пациента вполне успешно перенесли операцию, а дальнейшее наблюдение позволило говорить об излечении этих пациентов от хронической гранулематозной болезни. Однако еще 4 пациента умерли от последующих инфекций (15 %).
В остальном же современная медицина может предложить крайне немного. Это — патогенетическая и симптоматическая терапия с использованием антибиотиков, дренажей и прочего. Излишне говорить, что подобное лечение не способно избавлять пациентов от ХГБ.
Профилактика инфекций.
Крайне важно предотвращение развития инфекционного процесса. Пациенты с ХГБ испытывают невероятные трудности в повседневной жизни, например, некачественная чистка зубов спокойно может окончиться гингивитом, а царапина — тяжелой бактериемией. Потому больным необходимо тщательным образом следить за гигиеной, выполнять профессиональную чистку зубов, обрабатывать все царапины антисептиком. И, разумеется, такие пациенты должны быть привиты по всем правилам [14]. В противном же случае даже достаточно простая инфекция может окончиться летально.
Источники:
Гранулематозные поражения печени (K75.3)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
В тех случаях, когда более или менее четко отграниченные гранулёмы сопровождаются воспалительным процессом в печени, процесс обозначают как гранулематозный гепатит. Хронический гранулематозный гепатит примыкает к группе неспецифических реактивных гепатитов.
Примечания
2. Гранулематозный гепатит (ГГ) является клинико-морфологическим синдромом и должен рассматриваться (за исключением криптогенного или идиопатического ГГ) как предварительный диагноз неуточненной этиологии. При уточнении этиологии заболевание должно кодироваться в соответствующей подрубрике.
В данной подрубрике кодируется именно неуточненный или идиопатический гранулематозный гепатит. Является ли идиопатический гранулематозный гепатит специфическим синдромом или представляет собой вариант саркоидоза, еще не ясно.
Период протекания
Заболевание идиопатическим ГГ имеет хроническое течение. По некоторым данным средняя длительность симптомов до обращения к врачу при идиопатическом ГГ составляет около 19 месяцев.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
1. Системные болезни:
1.1 Гранулематозы:
— саркоидоз;
— идиопатическая гипогаммаглобулинемия;
— хроническая гранулематозная болезнь;
— гранулематоз Вегенера;
— височный артериит;
— ревматическая полимиалгия;
— узловатая эритема;
— аллергический гранулематоз;
— болезнь Крона.
1.2 Другие системные болезни:
— системная красная волчанка;
— неспецифический язвенный колит;
— ВИЧ.
1.3 Злокачественные болезни:
— болезнь Ходжкина;
— неходжкинская лимфома;
— рак.
2. Инфекции:
2.1 Микобактерии:
— туберкулез;
— атипичные микобактерии;
— бацилла Кальметта-Герена (БЦЖ);
— лепра.
2.2 Трепонема: сифилис.
2.3 Грибы:
— бластомикоз;
— кокцидиоидомикоз;
— гистоплазмоз;
— криптококкоз;
— кандидоз;
— аспергиллез.
2.4 Одноклеточные:
— шистосомоз;
— фасциолез;
— лейшманиоз;
— токсоплазмоз;
— личинки нематод.
2.5 Бактерии:
— бруцеллез;
— туляремия;
— иерсиниоз;
— листериоз;
— актиномикоз;
— брюшной тиф;
— мелиоидоз;
— болезнь кошачьей царапины;
— болезнь Уиппла.
2.6 Риккетсии:
— Ку-лихорадка;
— пятнистая лихорадка (boutonneuse fever).
2.7 Вирусы:
— вирус Эпштейна-Барр;
— вирус цитомегалии;
— вирус Коксаки.
3. Химические вещества
— бериллий;
— торотраст (оксид тория);
— сульфат меди;
— реакции на лекарственные средства.
4. Болезни печени:
— первичный билиарный цирроз;
— первичный склерозирующий холангит;
— экстраренальная обструкция желчного протока;
— аллергический холангит;
— хронический гепатит C;
— стеатоз.
II. Классификация по морфологическому признаку
1. Эпителиоидные гранулёмы состоят из узловых скоплений округлых макрофагов, часто в сочетании с многоядеными гигантскими клетками, лимфоцитами, плазматическими клетками. Встречаются, как правило, при саркоидозе и центральном казеозном некрозе при туберкулезе.
2. Фибриновые кольцевидные гранулёмы образованы волокнами фибрина, окруженными каплями жира, с сопутсnвующим воспалением. Впервые были описаны при Ку-лихорадке, но могут встречаться после инфекции цитомегаловирусом и вирусом Эпштейна-Барр, при токсическом действии аллопуринола, при системной красной волчанке, лимфоме, лейшманиозе, токсоплазмозе, гепатите А, гигантоклеточном артериите, стафилококковой инфекции, средиземноморской пятнистой лихорадке (Rickettsia conorii).
3. Липогранулёмы образованы отложением липидов и вакуолизированными макрофагами. Наблюдаются при эндо- или экзогенном накоплении жира (например, при избыточном поступлении/накоплении жира, длительном применении минеральных масел в качестве слабительного, инъекциях масляных растворов золота).
4. Микрогранулёмы состоят из небольших округлых скоплений купферовских клеток и довольно неспецифичны.
III. Классификация по размеру
Обычно гранул`мы представляют из себя образования диаметром 1-2 мм. Меньшие образования описываются как микрогранулемы. Большие образования (достигающие временами 4-4,5 см) описываются как гигантские гранулемы.
IV. При визуализации с помощью МРТ условно различают так называемые «казеозные» и «неказеозные» гранулёмы, характеризующиеся различным уровнем сигнала (особенно при контрастировании гадолинием), что имеет определенную диагностическую роль в диагностике туберкулеза.
V. По локализации (могут встречаться как изолированная, так и комбинированная локализации, что в ряде случаев имеет определенное клиническое значение):
VI. В клинической практике может быть применена оценка активности и распространенности процесса (элементы общей классификации гепатитов).
Этиология и патогенез
Патофизиология
Механизмы, ведущие к формированию гранулём, были частично объяснены. Фокальное скопление макрофагов может быть вызвано активизацией иммунной системы, непосредственно изоляцией инородного агента макрофагами или обоими эти механизмами.
Активизация иммунной системы без изоляции инородного агента может производить гранулёмы при аллергии или саркоидозе. Изоляция инородного агента без активизации иммунной системы происходит, когда инородный агент фагоцитируются макрофагами.
Активизация иммунной системы и изоляция происходят, когда инородный агент органический, но не уничтожается макрофагами и сохраняется внутри этих клеток, как происходит с внутриклеточными патогенами (например, микобактериями).
При некоторых инфекционных болезнях формируются »хорошо» сформированные гранулёмы, но диссеминированная форма той же самой инфекции бывает связана с »плохо» сформированными гранулёмами.
Эпидемиология
Признак распространенности: Редко
Гранулематозные изменения встречаются в среднем при выполнении 10% биопсий печени (разброс 2,4-14,6%).
Приблизительная международная статистика показывает указанное ниже распределение гранулематозных гепатитов (ГГ) по основной этиологии (перечень этиологии неполный).
Факторы и группы риска
Для данной подрубрики факторы и группы риска не определены.
Наиболее значимыми факторами считаются прием некоторых лекарственных препаратов и туберкулез.
Гранулёмы образуются в печени в 30% случаев при приеме аллопуринола, нитрофурантоина, альфа-метилдопы, фенилбутазона, карбамазепина, прокаинамида, дифенилгидантоина, хинидина, изониазида, сульфаниламидов.
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Общий подход
Клиническая картина гранулематозного гепатита (ГГ) определяется симптомами основного заболевания. В связи с этим клинические проявления чрезвычайно вариабельны: в ряде случаев обнаружение гранулематоза печени является случайной находкой для клинициста, в других сопровождается выраженными клиническими изменениями. Характерных клинических симптомов нет.
Ниже приведены (с ознакомительной целью) некоторые клинические аспекты ГГ при различных уточненных заболеваниях.
Диагностика
Трудности лабораторной и инструментальной диагностики лежат в соблюдении баланса между необходимостью и достаточностью огромного числа тестов, которые могут понадобиться для достоверного определения гранулематозного гепатита (ГГ) как идиопатического (диагностика методом исключения).
Минимальный перечень обследования для пациентов с ГГ:
— обзорная рентгенография грудной клетки;
— бактериологическое исследование для выделения бруцелл, микобактерий и грибков;
— серологическая диагностика для Ку-лихорадки, бруцеллеза, сифилиса, гепатитов В и С;
— туберкулиновые кожные пробы;
— анализ на антимитохондриальные антитела.
Другие специальные тесты могут указать на ряд заболеваний, связанных с гранулематозным гепатитом, и проводиться по показаниям.
Поскольку ГГ является случайной находкой на биопсии и может рассматриваться (за исключением идиопатического ГГ) как предварительный диагноз, необходим поиск для обнаружения вероятных причин ГГ (см. раздел «Этиология и патогенез») всеми доступными способами.
КТ, МРТ
Исследования должны быть выполнены в обязательном порядке для исключения туберкулеза, саркоидоза, злокачественных новообразований не только в печени, но и в других органах.
На МРТ, являющейся «золотым стандартом» неинвазивной диагностики ГГ, гранулёмы печени обычно выявляются как дискретные, резко очерченные узловые образования в печени размерами 0,5-4,5 см. Характеристика сигналов при МРТ (T1 и T2), а также контрастирование гадолинием (С+(Сd)) позволяет в большинстве случаев различать казеозные и неказеозные гранулёмы, что важно для диагностики туберкулеза.
Дополнительные МРТ-признаки могут включать увеличение портальных лимфатических узлов и селезенки.
Лабораторная диагностика
Пациенты с ГГ нуждаются в проведении значительного количества тестов, включая серологические, бактериологические, ПЦР и другие тесты различных сред организма для дифференциальной диагностики и выявления возможной этиологической причины ГГ.
Диагноз идиопатического ГГ возможен в качестве основного заболевания только после исключения всех возможных причин (см. раздел «Этиология и патогенез»).
Дифференциальный диагноз
I. Дифференциальный диагноз следует проводить со всеми объемными образованиями или с заболеваниями, вызывающими нарушения архитектоники в печени:
— опухоли печени доброкачественные и злокачественные (первичные и метастазирующие);
— кисты печени;
— микрогамартомы печени;
— множественные абсцессы печени;
— доброкачественная узловая гиперплазия печени.
II. Ко второй группе дифференцируемых заболеваний относятся гранулематозные гепатиты (ГГ) установленной этиологии, кодирующиеся в других подрубриках. Дифференциальный диагноз в этих случаях определяется обширным списком заболеваний, сопровождающихся гранулематозом печени.
Последовательность необходимых исследований следующая:
1. Общий анализ крови (СОЭ, число лейкоцитов и эозинофилов).
2. Кожные пробы Манту и Квейма.
3. Микроскопия и исследование на культуру туберкулеза в моче и мокроте.
4. Исследование кала на наличие паразитов, скрытого кровотечения.
5. Рентгенография грудной клетки.
6. Исследование сыворотки крови на сифилис, бруцеллез, цитомегаловирус. Определяют содержание иммуноглобулинов, антимитохондриальных антител (АМА).
При необходимости выполняют более сложные исследования:
— биопсия лимфатических узлов и исследование их на культуру;
— стернальная пункция с микроскопией и посевом на культуру;
— колоноскопия с биопсией;
— холангиография и прочее.
В клинической практике значительные трудности может вызвать разграничение ранних стадий первичного билиарного цирроза и саркоидоза с тяжелым холестатическим поражением печени. Существенное значение имеет выявление антимитохондриальных антител, как специфического маркера, первичного билиарного цирроза. Вовлечение в патологический процесс лимфатических узлов корней легких и положительная проба Квейма позволяют утвердиться в диагнозе саркоидоза.
Сложную проблему представляет доказательство лекарственной природы гранулематоза. Основные лекарственные препараты, к которым развивается реакция гиперчувствительности с гранулематозным поражением печени: ацетилсалициловая кислота, хлорпропамид, диазепам, галотан, левопа (L-дофа), оксациллин, пенициллин, хинидин, хинин, нитрофурантоин и другие.
Критерием лекарственного гранулематоза является четкая связь между приемом лекарства и развитием побочной реакции, а также клиническое, биохимическое и гистологическое улучшение, наступающее после отмены лекарства.
III. Существует практический вариант пошаговой стратегии выявления этиологической причины ГГ.
Когда наличие внепеченочных проявлений ведет к диагностированию гранулематозной болезни до обнаружения вовлечения печени, наличие гранулём печени может быть предположено, исходя из клинических или биохимических свидетельств вовлечения печени.
Биопсия печени может быть необходима для дифференциального диагноза в редких случаях, когда могут подозреваться различные формы вовлечения печени (например, саркоидоз с холестазом или с портальной гипертонией).
Исследование причины развития гранулём печени
2. Воздействие лекарственных средств и химических веществ (подробный анамнез, пробная отмена или замена лекарств).
3. Внепеченочное вовлечение:
— экспертиза кожи и биопсия повреждений (системная красная волчанка, псориаз, саркоидоз, болезнь кошачьих царапин);
— лимфатические узлы (лимфома, болезнь Ходжкина, саркоидоз, туберкулез);
— рентгенограмма легких или КТ (лимфома, болезнь Ходжкина, саркоидоз, туберкулез, Ку-лихорадка);
— экспертиза глаз и центральной нервной системы (саркоидоз, болезнь Ходжкина, болезнь Уиппла);
— сердце (Ку-лихорадка, саркоидоз);
— желудочно-кишечный тракт (болезнь Уиппла, болезнь Крона, неспецифический язвенный колит, туберкулез, брюшной тиф);
— суставы и кости (саркоидоз, системная красная волчанка, бруцеллез, туберкулез).
4. Серологические тесты и культуральные исследования крови:
— серология (антимитохондриальные и антиядерные антитела, Brucella, Coxiella burnetii, Rickettsia, Toxocara, Salmonella, вирус Эпштейна-Барр, вирус цитомегалии);
— культуральные исследования крови (Brucella, Salmonella, Coxiella burnetii, микобактерии, вирус Эпштейна-Барр, вирус цитомегалии).
5. Наблюдение в течение 3 месяцев за тем, появляются ли новые признаки заболевания.
Тщательное исследование экземпляра биопсии, в котором были обнаружены гранулёмы, помогает в определении причины заболевания.
Экспертиза может показывать:
— минеральные включения или инородные тела в макрофагах;
— яйца шистосом в центре гранулёмы;
— казеозный некроз, предполагающий туберкулез;
— бактерии, микобактерии или грибы;
— холангит, предполагающий первичный билиарный цирроз или признаки первичного склерозирующего холангита, стеатоза и алкогольного повреждения печени.
Материал биопсии может также использоваться для культуральных исследований или ПЦР для обнаружения геномов различных патогенов.
На втором шаге должна быть исследована история приема лекарственных средств.
На третьем шаге исследование внепеченочного вовлечения может показать специфическую связь (например, саркоидоз) или позволит обнаружить другой участок, который может быть использован для дальнейшей гистологической экспертизы (например, увеличенные лимфатические узлы при болезни Ходжкина или лимфомы) или для дальнейшего бактериологического исследования (например, легкое, кожа, лимфатический узел с микобактериями). Четвертый шаг состоит из серологических и бактериологических исследований крови, которые должны рассматриваться в эпидемиологическом контексте.
Случаи, в которых внепеченочное вовлечение не было обнаружено и не было других причин, были обозначены как «идиопатический гранулематозный гепатит». Результат наблюдения идиопатического гранулематозного гепатита был благоприятен, хотя кратковременная или длительная кортикостероидная терапия была необходима в более чем половине случаев. Имеются значительные сомнения, должен ли идиопатический гранулематозный гепатит рассматриваться как вариант саркоидоза печени.
Специфические случаи
Гранулёмы в печени могут быть найдены при биопсии, выполненной по поводу негранулематозной болезни печени (например, алкогольной болезни или хронического вирусного гепатита). В этих состояниях, когда все признаки могут быть приписаны болезни печени, и не имеется никаких проявлений, предполагающих интеркуррентную болезнь, исследование может быть ограничено саркоидозом и туберкулезом.
После трансплантации печени, гранулёмы могут быть найдены у 5-10 % пациентов, главным образом в течение первого года. Приблизительно 30% этих гранулём имеет неизвестное происхождение и клинически незначительны. Другие связаны с первичным билиарным циррозом или с инфекцией (например, туберкулезом или вирусом цитомегалии).